近年来,随着能源需求的不断增长,天然气作为一种高效、优质的清洁能源,在化石能源中的使用占比越来越高。世界各国也加大了天然气的勘探和开发力度[1]。在部分气田的开发过程中,H2S、CO2 等气体往往随着甲烷等碳氢化合物从地层经过油管进入地面管线或设备,造成井下管柱、地面管线和设备的严重腐蚀[2]。特别是在高含硫气田的开发过程中,油管中还可能存在S 沉积[3],导致油管堵塞和严重的局部腐蚀[4]。
S腐蚀的机理十分复杂。根据目前的研究报道,可能的腐蚀机理有:催化机理[5]、水解反应机理[6]、电化学腐蚀机理[7]、多硫化物腐蚀机理[8]、直接腐蚀机理[9]以及S 的氢脆及应力腐蚀机理[10]。S 腐蚀具有破坏性强、发展迅速和防护难度高等特点,已经成为含硫气田生产安全的重要挑战之一。在高含H2S 气井中,为了防止H2S 腐蚀和硫化物应力腐蚀开裂,通常选用抗硫碳钢作为油套管材质[11]。然而,H2S 和S 往往同时存在,可能导致抗硫碳钢发生S 腐蚀[12],但相关标准并没有阐明抗硫碳钢在S 环境中的适用性[13]。在天然气开采过程中,油管的S 腐蚀可能受到温度和湿度的影响,但截止目前,相关的研究尚未见报道。因此,开展抗硫碳钢的S 腐蚀行为研究,明确不同温度和湿度条件下S 腐蚀的特征和腐蚀机理,对保障含硫天然气的开采安全具有重要意义。
在较低的温度下,干燥的环境中S 不会对碳钢造成腐蚀,因此,环境的相对湿度是开展S 腐蚀相关研究应该考虑的一个重要因素。目前,较多学者将试样完全浸没在含S 的腐蚀液中进行腐蚀评价和腐蚀机理研究,这与现场工况环境存在一定的差异,不能体现湿度对S 腐蚀的影响。因此,为了明确抗硫碳钢在不同温度和湿度条件下的S 腐蚀特征和腐蚀机理,本文开展了P110SS 特种抗硫钢在不同湿度和温度条件下的S 腐蚀实验。采用X 射线光电子能谱(XPS)和扫描电子显微镜(SEM)等分析了P110SS 钢的S 腐蚀产物组成、腐蚀产物形貌及厚度、腐蚀产物截面形貌以及去膜后样品表面微观形貌。最后,分析了不同温度和湿度条件下,抗硫钢的S 腐蚀机理。研究结果能够为S 腐蚀控制提供参考。
1 实验方法
实验所用材料为P110SS 特种抗硫钢,其化学成分(质量分数,wt.%)为:C 0.20,Cr 1.06,Mo 0.89,Mn 0.45,Si 0.23,V 0.07,Fe 余量。实验中,采用了两种规格的长方体试样:30mm×15mm×3mm 和10mm×10mm×1.5mm。第一种试样用作表面腐蚀产物微观形貌观察和去膜后基体腐蚀形貌观察,第二种试样用作腐蚀截面微观形貌观察和XPS 分析。图1 为P110SS 钢的金相组织图。由图可知,P110SS 钢主要由回火索氏体组成。元素硫选用升华硫粉,分子式为S8。
图2 为实验装置示意图,整个装置由广口瓶、反应烧杯、温湿度传感器、加热装置和玻璃支架组成。P110SS 试片放置于反应烧杯内的玻璃支架上,广口瓶盛放纯水,使用温湿度传感器(VMS-3002-WS)来监测反应烧杯内的相对湿度和温度。实验过程中,反应烧杯内的相对湿度控制方法如下:向除氧的纯水中通入干燥的CO2,通过控制CO2 流量以及纯水的温度来控制反应烧杯内相对湿度(气体流量采用玻璃转子流量计测量;加热装置w 选用SZCL 型加热套)。表1 为不同温度下测得的反应烧杯内的相对湿度。反应温度通过X1010T 型恒温加热台调控,反应烧杯外加保温层。

图1 P110SS 钢的金相组织
表1 反应瓶内的相对湿度
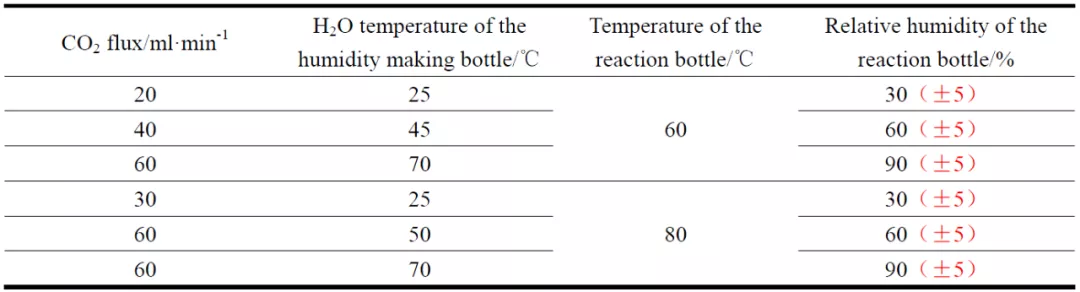
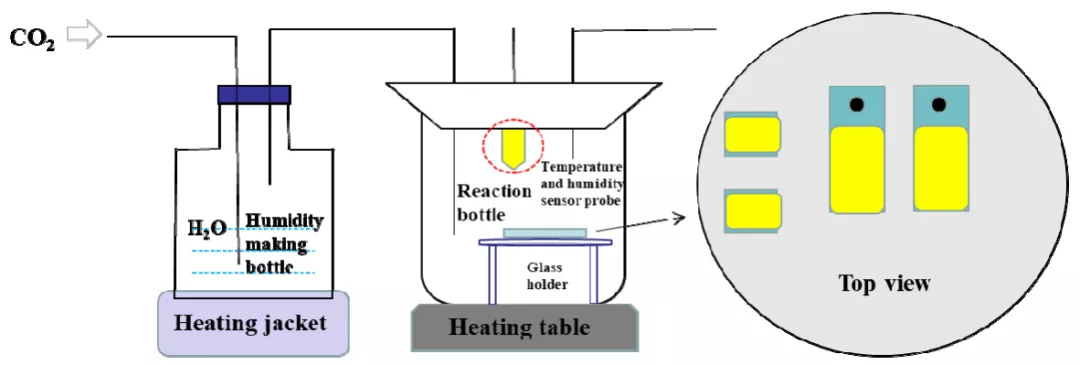
图2 实验装置示意图
采用400、1500 目的砂纸逐级打磨试样表面,用乙醇和丙酮清洗试片后,用N2 将试片吹干。每组实验用两种尺寸的试片各两片。将S 和NaCl 按照质量比2:1 的比例混合,搅拌均匀后覆盖在试片表面,然后放入反应瓶中。实验开始前,湿气瓶通2h CO2,反应瓶通2h N2 来除去实验装置中的O2,除氧后,按图2 所示连接实验装置。反应瓶温度控制在60℃和80℃;相对湿度调节为30%、60%和90%,实验时间为120h。实验结束后,取出试片,并用N2 吹干。尺寸为10mm×10mm×1.5mm 的试样,其一密封保存待XPS检测,另一试样用环氧树脂封住,将侧面抛光用于截面微观形貌观察;尺寸为30mm×15mm×3mm 的试样,其一密封保存以用于腐蚀产物微观形貌观察,另一试样用去膜液去除表面腐蚀产物,并用酒精清洗,N2 吹干,用于去膜后基体腐蚀微观形貌观察。去膜液由10g 六次甲基四胺、100mL 浓盐酸和900mL 纯水配制。
采用VG Multilab 2000 型X 射线光电子能谱(XPS)仪测试腐蚀产物的化学组成。仪器真空腔基压范围为10-7~10-8Pa,以Al Ka 作为X 射线源(1486.6eV),光电子能谱通能为45eV、停留时间为50ms、步长为0.2eV,得到的数值通过C1s(284.6eV)矫正。利用XPSPEAK41 软件对XPS 数据进行分峰拟合。采用ZEISS EV0 MA15 型扫描电子显微镜(SEM)观察去除腐蚀产物膜前后试片的腐蚀形貌和腐蚀产物膜截面形貌。
2 结果与讨论
2.1 腐蚀产物成分分析
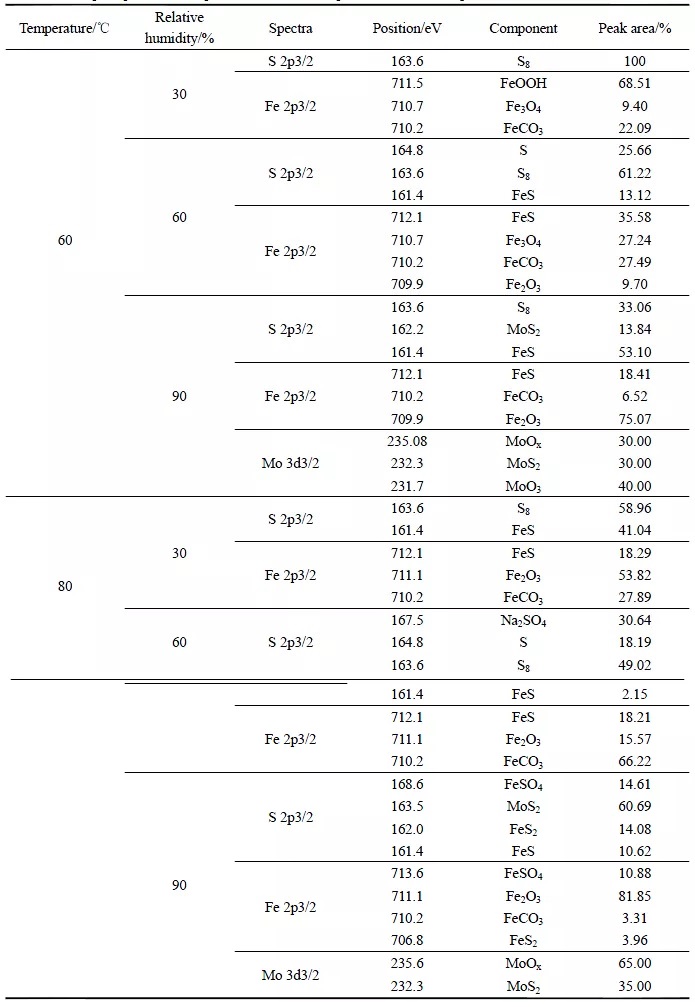
图3 为60℃时不同相对湿度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨谱。S(2p3/2)的高分辨谱(图3a)显示,164.8eV、163.6eV、162.2eV 和161.4eV 处的峰分别对应于S(单质)[14]、S8(单质)[15]、MoS2[16]、FeS[17];Fe(2p3/2)的高分辨谱(图3b)显示,712.1eV、711.5eV、710.7eV、710.2eV和709.9eV 处的峰分别对应于FeS[17]、FeOOH[18]、Fe3O4[19]、FeCO3[20]和Fe2O3[21];Mo(3d3/2)的高分辨谱(图3c)显示,235.08eV、232.3eV 和231.7eV 处的峰分别对应于MoOx[22]、MoS2[23]和MoO3[24]。各物质的相对含量见表2。
由图3a 和表2 可知,在温度为60℃,相对湿度为30%的条件下,XPS 图谱数据较为散乱、且信号较弱,腐蚀产物中S 含量较低,仅存在硫单质S8,无S 的其他化合物存在。这表明,S 在该条件下很可能未参与腐蚀反应,试样的腐蚀主要是CO2 和Cl-造成的[25, 26]。当相对湿度增加到60%时,腐蚀产物中出现FeS,这表明S 已经参与了腐蚀反应。当相对湿度达到90%后,除了FeS 之外,还出现了少量Mo 的硫化物MoS2。Mo(3d3/2)的XPS 高分辨谱如图3c 所示,Mo 本可以提升金属耐腐蚀的能力,还能使金属晶粒细化提高淬透性和热强性[27],MoS2 的出现表明试片表面腐蚀程度增加。
从Fe(2p3/2)的高分辨图谱(图3b)可以看出,在温度为60℃,相对湿度为30%的条件下未发现铁硫化合物的存在,这与S(2p3/2)的XPS 高分辨谱显示的结果是一致的。在相对湿度为60%和90%的条件下均出现了腐蚀产物FeS。同时,60℃不同湿度条件下均有FeCO3,这表明在不同湿度条件下,CO2 均参与了腐蚀反应。
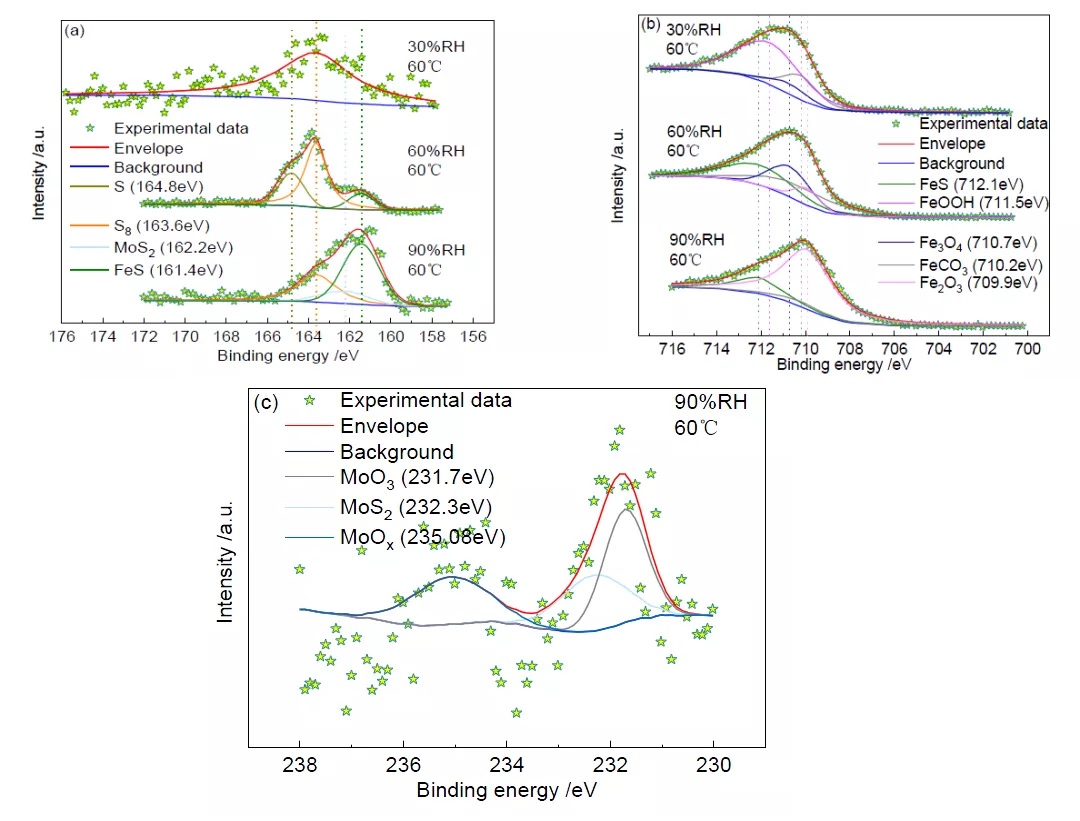
图3 60℃、不同相对湿度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨谱
图4 为80℃时不同相对湿度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨谱。S(2p3/2)的高分辨谱(图4a)显示,168.6eV、167.5eV、164.8eV、163.6eV、163.5eV、162.0eV 和161.4eV 处的峰分别对应于FeSO4[28]、Na2SO4[29]、S(单质)、S8(单质)、MoS2[30]、FeS2[31]和FeS;Fe(2p3/2)的高分辨谱(图4b)显示,713.6eV、712.1eV、711.1eV、710.2eV 和706.8eV 处的峰分别对应于FeSO4[32]、FeS、Fe2O3[33]、FeCO3 和FeS2[17];Mo(3d3/2)的高分辨谱(图4c)显示,235.6eV 和232.3eV 处的峰分别对应于MoOx[22]和MoS2[23]。各物质的相对含量见表2。
由图4a 和表2 可知,温度为80℃时,即使在相对湿度为30%的条件下,仍发现了腐蚀产物FeS。这说明了温度升高后,即便是在30%的湿度下,S 仍然能够参与腐蚀反应。当相对湿度达到60%时,腐蚀产物中除了FeS 外,还出现了硫酸盐,硫酸盐的出现证实了S 在此温湿条件下发生了水解反应,方程式为:
S8 + 8H2O → 6H2S + 2H2SO4 (1)
当相对湿度增加到90%后,腐蚀产物中出现了FeSO4、FeS2 和MoS2。FeSO4 的存在证实S 水解反应的确存在,湿度升高后,生成了更多的酸,导致试片发生了酸腐蚀。同时,腐蚀产物中有MoS2 存在,Mo(3d)的高分辨图谱如图4c 所示。
由Fe(2p3/2)的XPS 拟合结果(图4b)可知,在不同的湿度条件下均存在FeCO3。在相对湿度为30%和60%条件下的腐蚀产物组成相同,均由FeS、Fe2O3 和FeCO3 组成。当相对湿度达到90%时,FeS 转换成FeS2,S 水解反应加剧,生成了较多H2SO4,导致腐蚀产物中出现了FeSO4。
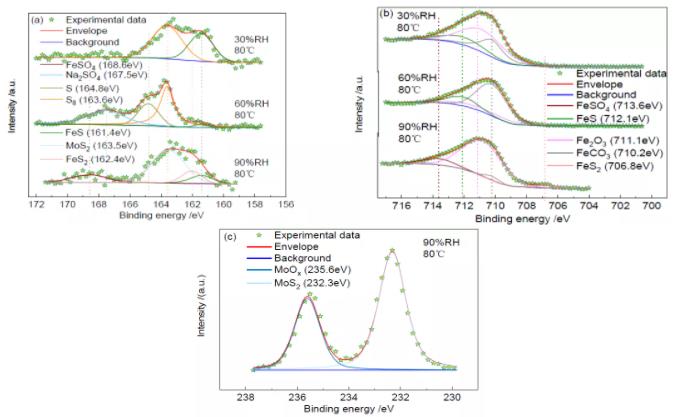
图4 80℃、不同相对湿度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨谱
表2 不同温湿度下各物质峰面积比
根据XPS 结果分析可知,P110SS 钢的S 腐蚀特征和腐蚀机理随温度和湿度的变化而改变。在温度为60℃、相对湿度为30%的条件下,S 不参与腐蚀反应;升温或增加湿度会导致S 腐蚀发生。在温度为60℃时,即使增加相对湿度,S 也不会发生水解反应;在80℃、相对湿度为60%及以上时,S 发生了水解反应。
2.2 表面及截面分析
2.2.1 腐蚀产物表面形貌
图5 为不同温湿度条件下P110SS 钢表面腐蚀产物微观形貌。在温度为60℃时,不同相对湿度条件下的腐蚀产物膜差异明显。在相对湿度为30%时(图5a),腐蚀产物较少,腐蚀产物膜表面可见细小裂缝;在相对湿度为60%时(图5b),腐蚀产物膜出现龟裂现象,无裂缝处表面较为平整均匀;当相对湿度达到90%时(图5c),腐蚀产物膜裂缝增多、变宽。
当温度为80℃时,在相对湿度为30%的条件下(图5d),腐蚀产物膜表面平整均匀,有较多细小裂缝;在相对湿度为60%时(图5e),腐蚀产物膜出现裂缝,表面凹凸不平;当相对湿度达到90%时(图5f),腐蚀产物膜质地疏松且易脱落。
由腐蚀产物微观形貌分析可知:温度主要影响腐蚀产物膜的致密度。当温度为60℃时,产物膜裂缝呈迸裂状;当温度为80℃时,产物膜裂缝呈撕裂状。有研究指出,这种腐蚀产物膜特征与温度有关,即温度升高,腐蚀产物膜致密度下降,产物膜表面裂缝的形貌发生显著改变[34]。

图5 不同温湿度下覆盖S 的P110SS 钢表面腐蚀产物形貌
(b) 60%RH/60℃, (c) 90%RH/60℃, (d) 30%RH/80℃, (e) 60%RH/80℃ and (f) 90%RH/80℃
2.2.2 腐蚀产物膜截面分析
为进一步分析温湿度对腐蚀产物膜厚度和微观结构的影响,采用SEM 观察了腐蚀截面的微观形貌,见图6。在温度相同的条件下,腐蚀产物膜的厚度随相对湿度的升高而增加;在湿度相同的条件下,腐蚀产物膜的致密度随温度的升高而下降。
当温度为60℃时,在相对湿度为30%的条件下(图6a),腐蚀产物膜层的厚度约为10μm;在相对湿度为60%的条件下(图6b),腐蚀产物膜厚度约为17μm,膜层间孔隙较多;当相对湿度增加到90%时(图6c),腐蚀产物膜厚度增加到30μm,膜层较为致密。
在温度为80℃的条件下,当相对湿度为30%时(图6d),腐蚀产物膜厚度约为7μm,且致密性较差;当相对湿度为60%时(图6e),腐蚀产物膜增厚至23μm,膜层中出现较多裂缝;当相对湿度达到90%后(图6f),腐蚀产物膜厚度达到44μm,膜层中有较多垂直于试片表面的细小裂缝,同时可见明显点蚀坑剖面,点蚀深度约为12μm,点蚀坑直径约为30μm。

图6 不同温湿度下覆盖S 的P110SS 钢腐蚀截面SEM 图
2.2.3 去膜后试片腐蚀形貌
图7 为不同温湿度条件下P110SS 钢表面去除腐蚀产物膜后的SEM ,图8 为在30%RH/60℃条件下覆盖物不含S 时的P110SS 钢表面去除腐蚀产物膜后的SEM。当温度为60℃时,在相对湿度为30%的条件下(图7a),试片表面出现了点蚀坑,点蚀坑边缘平滑,由前文XPS 分析结果可知,该条件下S并未参与试片的腐蚀反应,由图8 可知,在不含S 的条件下,试片表面出现了明显的点蚀坑,这表明试片的点蚀是由CO2 和Cl-造成的;在相对湿度为60%的条件下(图7b),S 参与腐蚀反应,腐蚀主要表现为全面腐蚀的特征;当相对湿度达到90%时(图7c),S 腐蚀加重,试片表面出现较多腐蚀裂缝,腐蚀仍表现为全面腐蚀的特征。
当温度为80℃时,在相对湿度为30%的条件下(图7d),试片表面出现较多点蚀坑,点蚀坑边缘锐利,这表明,升高温度可以提高S 和试片表面的活性,S 参与腐蚀反应导致了试片表面点蚀的发生;在相对湿度为60%的条件下(图7e),试片的腐蚀表现出全面腐蚀的特征;在相对湿度达到90%时(图7f),由于元素硫发生了水解反应,试片表面局部酸化,使得腐蚀表现出全面腐蚀并伴随点蚀的特征。

图7 不同温湿度下覆盖S 的P110SS 钢表面去膜后形貌

图8 30%RH/60℃条件下覆盖物不含S 时的P110SS 钢表面去膜后形貌
2.3 腐蚀机理分析
通过XPS 以及腐蚀产物微观形貌分析,得到了P110SS 抗硫钢在不同温度和湿度条件下的S/CO2/Cl-体系中的腐蚀机理:
60℃时,在相对湿度为30%的条件下,S 未参与腐蚀反应,此温湿度下S 性质稳定。试片表面的非金属夹杂物在Cl-的作用下会形成局部腐蚀,由于闭塞电池的作用,坑外的Cl-向坑内迁移,而带正电的坑内金属离子向坑外迁移,从而产生明显点蚀坑[26]。相对湿度达到60%及以上后,试片表面形成薄液膜,由CO2 水解产生的H+增多,S 可能在覆盖的部位发生阴极反应生成了H2S,使得试片表面H2S 浓度很高[35],实验尾气有浓烈的臭鸡蛋气味可以证明H2S 的产生,H2S 溶于水逐步电离生成H+和S2-。H+作为强去极化剂加速了阴极反应,进而导致试片的腐蚀,并生成了腐蚀产物FeS,FeS 的自身结构缺陷使其具有半导体特性,进一步促进腐蚀的加重[5]。同时,Mo 的溶解极大地降低了试片的耐蚀性能[27],促进了腐蚀向更严重的趋势发展。主要反应如下:
S+2H++2e-→H2S (2)
H2S→H++HS-→2H++S2- (3)
Fe→Fe2++2e- (4)
Mo→Mo4++4e- (5)
Fe2++S2-→FeS (6)
Mo4++2S2-→MoS2 (7)
当温度升高到80℃时,S 的反应活性提高,在相对湿度为30%的条件下也可能按照上述方程式反应生成FeS。当相对湿度增大到60%及以上时,水电离生成更多的H+吸附于S 表面,改变了S 的极性与分子结构,进一步地增加了其活性,导致了S 水解反应的发生,化学反应式为[36]:
(x+y+1)S+yH2O→(y+1)HS-+SxOy2-+(y-1)H+ (8)
其中,氧化态产物SxOy2-可以为S2O32-、SO32-、SO42-和SxO62-中的一种或几种。随着反应的进行,HS-和S2-浓度进一步提高,硫化物逐渐积累,当生成的硫化物膜不能够有效地阻止腐蚀性阴离子向腐蚀产生的坑内迁移的时候,腐蚀造成的缺陷处将会形成闭塞的腐蚀电池,从而导致点蚀的加重。FeS 还会催化S 的水解生成更多的SO42-和S2-,同时,其在80℃、90%RH 的条件下易失去一个电子生成[FeS]+,[FeS]+会与S2-和H+反应生成具有半导体特性的FeS2,其附着力差,易脱落,也会导致局部腐蚀的发生[37],化学反应方程式为:
FeS-e-→[FeS]+ (9)
2[FeS]++2S2-+2H+→2FeS2+H2 (10)
3 结论
(1)在不同的温度和湿度条件下,P110SS 钢的S 腐蚀特征不同。在温度为60℃时,S 的腐蚀主要以全面腐蚀为主。当温度为80℃时,在相对湿度为30%的条件下,腐蚀主要以点蚀为主;在相对湿度为60%的条件下,腐蚀主要为全面腐蚀;在相对湿度为90%的条件下,腐蚀以全面腐蚀为主并伴随严重的点蚀。
(2)在不同的温度和湿度条件下,P110SS 钢表面腐蚀产物膜的致密度和厚度不同。温度主要影响腐蚀产物膜的致密度,即温度升高,产物膜致密度下降;湿度主要影响腐蚀产物膜厚度,即湿度升高,腐蚀产物膜厚度增加。
(3)在不同的温度和湿度条件下,P110SS 钢的元素硫腐蚀机理不同。在温度为80℃、相对湿度为60%和90%时,腐蚀的主要原因是S 发生了水解反应,腐蚀产物主要为FeS 和FeSO4;其他实验条件下P110SS钢的S 腐蚀主要原因推测是S 直接参与了腐蚀的阴极反应,腐蚀产物主要为FeS。
参考文献
[1] Mao T. Research on elemental sulfur corrosion and control technology in high sulfur gas fields[D]. Southwest Petroleum University, 2017. (毛汀。 高含硫气田元素硫腐蚀及控制技术研究[D]. 西南石油大学, 2017.)
[2] Ge P L, Zeng W G, Xiao W W,et al.Effect of Applied Stress and Medium Flow on Corrosion Behavior of Carbon Steel in H2S/CO2 Coexisting Environment[J]. Journal of Chinese Society for Corrosion and Protection,2021,41(02):271-276. (葛鹏莉,曾文广,肖雯雯,高多龙,张江江,李芳。H2S/CO2 共存环境中施加应力与介质流动对碳钢腐蚀行为的影响[J].中国腐蚀与防护学报,2021,41(02):271-276.)
[3] Santos J P L, Lobato A K C L, Moraes C, et al. Determination of elemental sulfur deposition rates for different natural gas compositions[J]. Journal of Petroleum Science and Engineering, 2015, 135: 461-465.
[4] Li J L, Zhu S D, Qu Z H, et al. Research Progress on Corrosion of Elemental Sulfur [J]. Hot Working Technology, 2015, 44(2):20-24. (李金灵,朱世东,屈撑囤等。元素硫腐蚀研究进展[J]. 热加工工艺, 2015, 44(2): 20-24.)
[5] MacDonald D D, Roberts B, Hyne J B. The corrosion of carbon steel by wet elemental sulfur[J]. Corrosion Science, 1978, 18(5):411-425.
[6] Maldonado-Zagal S B, Boden P J. Hydrolysis of elemental sulphur in water and its effect on the corrosion of mild steel[J]. British Corrosion Journal, 1982, 17(3): 116-120.
[7] Schmitt G. Effect of elemental sulfur on corrosion in sour gas systems[J]. Corrosion, 1991, 47(4):285-308.
[8] Wilken G. Effect of environmental factors on downhole sour gas corrosion[C]//CORROSION 96. One Petro, 1996.
[9] Dowling N. Sulfur-related corrosion mechanisms[J]. Corrosion Society, Calgary Section Elemental Sulfur Corrosion and its Mitigation. Calgary: NACE, 2010.
[10] Gee R, Chen Z Y. Hydrogen embrittlement during the corrosion of steel by wet elemental sulfur[J]. Corrosion science, 1995, 37(12):2003-2011.
[11] Yang J Q, Zhang Z H, Zhang C X, et al. Selection and evaluation of low alloy steel for sour service[J]. Chemical engineering of oil & gas, 2014, 43(3): 275-278. (杨建强, 张忠铧, 张春霞, 等。 低合金钢抗硫油套管选材与评价方法[J]. 石油与天然气化工, 2014, 43(3): 275-278.)
[12] Zhang N, Zeng D, Zhang Z, et al. Effect of flow velocity on pipeline steel corrosion behaviour in H2S/CO2 environment with sulfur deposition[J]. Corrosion Engineering, Science and Technology, 2018, 53(5): 370-377.
[13] GB/T 20972.3-2008, Petroleum and natural gas industries—Material for use in H2S-containing environments in oil and gas production—Part 3: Cracking-resistant CRAs (corrosion-resistant alloys) and other alloys[S]. (GB/T 20972.3-2008, 石油天然气工业 油气开采中用于含硫化氢环境的材料 第3 部分:抗开裂耐蚀合金和其他合金[S].)
[14] Thomas J M, Adams I, Williams R H, et al. Valence band structures and core-electron energy levels in the monochalcogenides of gallium. Photoelectron spectroscopic study[J]. Journal of the Chemical Society, Faraday Transactions 2: Molecular and Chemical Physics, 1972, 68: 755-764.
[15] Peisert H, Chassé T, Streubel P, et al. Relaxation energies in XPS and XAES of solid sulfur compounds[J]. Journal of electron spectroscopy and related phenomena, 1994, 68: 321-328.
[16] Patterson T A, Carver J C, Leyden D E, et al. A surface study of cobalt-molybdena-alumina catalysts using x-ray photoelectron spectroscopy[J]. The Journal of Physical Chemistry, 1976, 80(15): 1700-1708.
[17] Alt H, Binder H, Sandstede G. Mechanism of the electrocatalytic reduction of oxygen on metal chelates[J]. Journal of Catalysis, 1973, 28(1):8-19.
[18] Tan B J, Klabunde K J, Sherwood P M A. X-ray photoelectron spectroscopy studies of solvated metal atom dispersed catalysts. Monometallic iron and bimetallic iron-cobalt particles on alumina[J]. Chemistry of Materials, 1990, 2(2): 186-191.
[19] Marcus P, Grimal J M. The anodic dissolution and passivation of NiCrFe alloys studied by ESCA[J]. Corrosion Science, 1992, 33(5):805-814.
[20] Li D G, Feng Y R, Bai Z Q, et al. Characteristics of CO2 corrosion scale formed on N80 steel in stratum water with saturated CO2[J]. Applied surface science, 2007, 253(20): 8371-8376.
[21] Paparazzo E. XPS and auger spectroscopy studies on mixtures of the oxides SiO2, Al2O3, Fe2O3 and Cr2O3[J]. Journal of electron spectroscopy and related phenomena, 1987, 43(2): 97-112.
[22] Anwar M, Hogarth C A, Bulpett R. Effect of substrate temperature and film thickness on the surface structure of some thin amorphous films of MoO 3 studied by X-ray photoelectron spectroscopy (ESCA)[J]. Journal of materials science, 1989, 24(9): 3087-3090.
[23] Shuxian Z, Hall W K, Ertl G, et al. X-ray photoemission study of oxygen and nitric oxide adsorption on MoS2[J]. Journal of Catalysis, 1986, 100(1): 167-175.
[24] Caceres C V, Fierro J L G, Lazaro J, et al. Effect of support on the surface characteristics of supported molybdena catalysts[J]. Journal of Catalysis, 1990, 122(1): 113-125.
[25] Bai H T, Yang M, Dong X W,et al.Research Progress on CO2 Corrosion Product Scales of Carbon Steels[J]. Journal of Chinese Society for Corrosion and Protection,020,40(04):295-301. (白海涛,杨敏,董小卫,马云,王瑞。CO2 腐蚀产物膜的研究进展[J].中国腐蚀与防护学报,2020,40(04):295-301.)
[26] Kruizenga A M. Corrosion mechanism in chloride and carbonate salts[J]. Sandia National Laboratories, Livermore, CA Report No. SAND2012-7594, 2012.
[27] Zheng S, Li C, Qi Y, et al. Mechanism of (Mg, Al, Ca)-oxide inclusion-induced pitting corrosion in 316L stainless steel exposed to sulphur environments containing chloride ion[J]. Corrosion science, 2013, 67: 20-31.
[28] Lindberg B J, Hamrin K, Johansson G, et al. Molecular spectroscopy by means of ESCA II. Sulfur compounds. Correlation of electron binding energy with structure[J]. Physica Scripta, 1970, 1(5-6): 286.
[29] Swartz W E, Hercules D M. X-ray photoelectron spectroscopy of quaternary phosphonium compounds[J]. Analytical Chemistry, 1971, 43(8):1066-1069.
[30] Durbin T D, Lince J R, Didziulis S V, et al. Soft X-ray photoelectron spectroscopy study of the interaction of Cr with MoS2[J]. Surface science, 1994, 302(3): 314-328.
[31] Karthe S, Szargan R, Suoninen E. Oxidation of pyrite surfaces: A photoelectron spectroscopic study[J]. Applied Surface Science, 1993, 72(2):157-170.
[32] Goonasekere K G A. A case study of irrigation water management at Kaudulla irrigation scheme and development of water management alternatives for the dry zone of Sri Lanka[D]. Virginia Polytechnic Institute and State University, 1985.
[33] Seyama H, Soma M. Fe 2p spectra of silicate minerals[J]. Journal of electron spectroscopy and related phenomena, 1987, 42(1):97-101.
[34] Chen T H, Xu L N, Chang W, et al. Effect of Cr Content and Temperature on Corrosion Resistance of Low Cr Pipeline Steel [J]. Natural Gas Industry, 2011, 31(9): 93-97. (陈太辉,许立宁,常炜等。Cr 含量和温度对低Cr 管线钢抗CO2 腐蚀的影响[J].天然气工业, 2011, 31(9): 93-97.)
[35] Lin H C,Yang X Q.Potential phase changes during extraction of very high H2S-bearing gas wells [J]. Corrosion science and protection technique, 1992, 4(4): 308-311. (林海潮, 杨秀清。 特高含 H2S 气井开采过程中可能发生的相态变化 [J]. 腐蚀科学与防护技术, 1992, 4(4): 308-311.)
[36] Deng T, Ke J J, Chen J Y. Kinetics of Disproportionation of Elemental Sulfur in Aqueous Solutions [J]. Journal Chemical Industry and Engineering, 1984, 4: 328-333. (邓彤, 柯家骏, 陈家镛。 元素硫的歧化反应动力学研究[J]. 化工学报, 1984, 4: 328-333.)
[37] Yang L Q. The study of the elemental sulfur corrosion mechanism of X65 pipeline steel under the suspended sulfur environment [D]. Northwest University, 2017. (杨力强。 X65 管线钢悬浮硫腐蚀机理研究[D]. 西北大学, 2017.)
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





