阴极保护与防腐蚀涂层联合使用,是目前公认的对埋地或浸没金属结构物进行腐蚀防护的有效手段。早在1823年,英国化学家戴维受海军部委托,着手研究铜皮包覆的木船在海洋中的防腐蚀问题。他经过长期试验发现铜和锌或铜和铁的接触可以使铜得到保护。1824年,戴维在船体上进行了实用性试验,用铁作为阳极,面积为铜皮总面积的1/80,取得良好的保护效果。他在1826年的报告中提出:当浸没在液体中的不同金属用导线连接成回路时,一种金属的腐蚀受到促进,而另一种金属的腐蚀会受到抑制,这就是铜船通过连接铁或锌而受到保护的原因。
戴维的研究结论被后世视为最早的阴极保护理论。虽然戴维早在1823年就发现了活泼金属可以对不活泼金属起到阴极保护的作用,但是阴极保护的作用机理在此后很长一段时间内都没有发展和确立。即便是现在,阴极保护的作用机理仍处于争论状态。
阴极保护机理
部分阴极保护标准中给出了阴极保护的定义:
NACE SP0169-2013规定:
阴极保护的定义是:通过使金属表面成为电化学电池的阴极来减少金属表面腐蚀的一种技术。
ISO 8044-2020规定:
阴极保护的定义是:通过降低电极电位使金属的腐蚀速率显著降低的电化学保护方法。
以上两个定义都未涉及到阴极保护机理。但通常认为,在施加阴极保护之前腐蚀结构同时具有阴极和阳极,阴极是发生还原反应的电极,阳极是发生氧化反应即腐蚀的电极。因此,如果所有的阳极区域都能转化为阴极区域,那么整个结构就会变成阴极,腐蚀就会消除。
目前最为流行的阴极保护机理是MEARS和BROWN以及HOAR分别提出的经典阴极保护机理即阳极溶解减缓机理;除此之外,阴极保护机理还有基于热力学的免蚀机理和钝化机理。
1 阳极溶解减缓机理
在早期对阴极保护的防腐蚀作用的多种阐释中,HOAR利用局部腐蚀电池的概念对阴极保护机理进行了解释,他提出阴极保护的机理应该是阳极溶解的受阻,而不是亚铁离子的再沉积;M?LLER提出当阴极的电位极化至与阳极电位一致时,腐蚀将停止,这里阳极电位的定义是阳极金属的平衡电极电位。
在同一时期,MEARS和BROWN以及HOAR等都尝试使用电偶对来描述、验证阴极保护的机理。MEARS和BROWN在1938年发表的文章中提出:当腐蚀类型属于完全的电化学腐蚀时,有必要将腐蚀电池的阴极电位极化至阳极的开路电位,以获得完全的阴极保护。
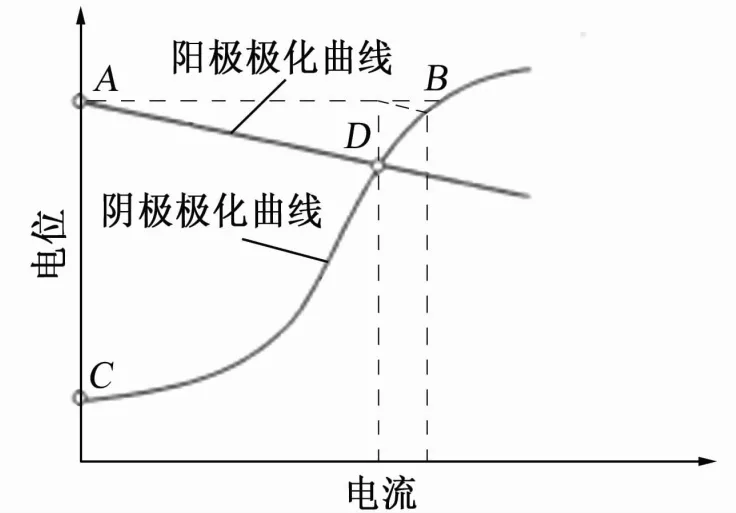
基于腐蚀电化学理论,MEARS和BROWN认为金属表面的不均匀性以及腐蚀介质的差异等原因会造成金属表面不同位置之间存在电位差,从而产生腐蚀电流。金属表面电位较正的阴极极化曲线和电位较负的阳极极化曲线相交,如图1所示。如果忽略IR降,则两条曲线交叉点(D点)所对应的横坐标数值即为腐蚀电流。在该腐蚀电池中,阳极极化和阴极极化都是由腐蚀电流引起的。如果使用外部直流电源给该腐蚀电池提供电流,将阴极电位极化到阳极电位(B点),此时整个金属表面处于等电位状态,不存在释放腐蚀电流的阳极。如果腐蚀属于完全的电化学腐蚀且阴极周边的产物不会导致腐蚀,就可实现100%的有效保护。
图1 阴极极化曲线和阳极极化曲线示意
为了验证所提出的阳极溶解减缓机理,MEARS和BROWN设计了电偶对试验装置。在该装置中,铜电极作为腐蚀电池的阴极,锌电极作为腐蚀电池的阳极,铂电极作为外加电流阴极保护的辅助阳极。试验电解质为质量分数为20%的NaCl溶液。用两个毫安表分别测量阴极与阳极之间的电流以及外部直流电源的输出电流。测试中使用甘汞电极测量阴极和阳极的混合电位,使用电压表直接测量阴极与阳极之间的电位差。在外部直流电源回路中安装有可调电阻,通过调整可调电阻的电阻值来调整阴极保护电流。开关S1用于控制阴极(铜)与阳极(锌)之间的导通与隔断。
在S1闭合的情况下,随着外部阴极保护电流逐步增大,阴极与阳极之间的电流(腐蚀电流)逐步减小至零;当腐蚀电流减少至零时,阴极的电位为-1.1687V,阳极的电位为-1.1689V,电位差接近于零。试验结果很好地验证了MEARS和BROWN提出的阳极溶解减缓机理,即当腐蚀电流降至零时,阴极的电位应降至阳极的开路电位。
在试验中,铜电极作为外加电流保护系统的阴极,调整可调电阻的阻值,得到不同的阴极电位。每调整一次阻值后,都相应的临时闭合S1测量阴极和阳极间的电流,在临时闭合S1 后,使用甘汞电极测量两种金属的混合电位。当阴极电位被极化到阳极的开路电位时,闭合S1,阴极和阳极之间的腐蚀电流为零。可见,当阴极(铜)被极化到阳极(锌)的开路电位后,与铜的连接不会对锌造成电化学腐蚀。
2 基于热力学的免蚀机理
阴极保护的热力学免蚀机理是指将结构物极化到在特定环境中的热力学稳定电位,即Pourbaix(电位-pH)图中的免蚀区。
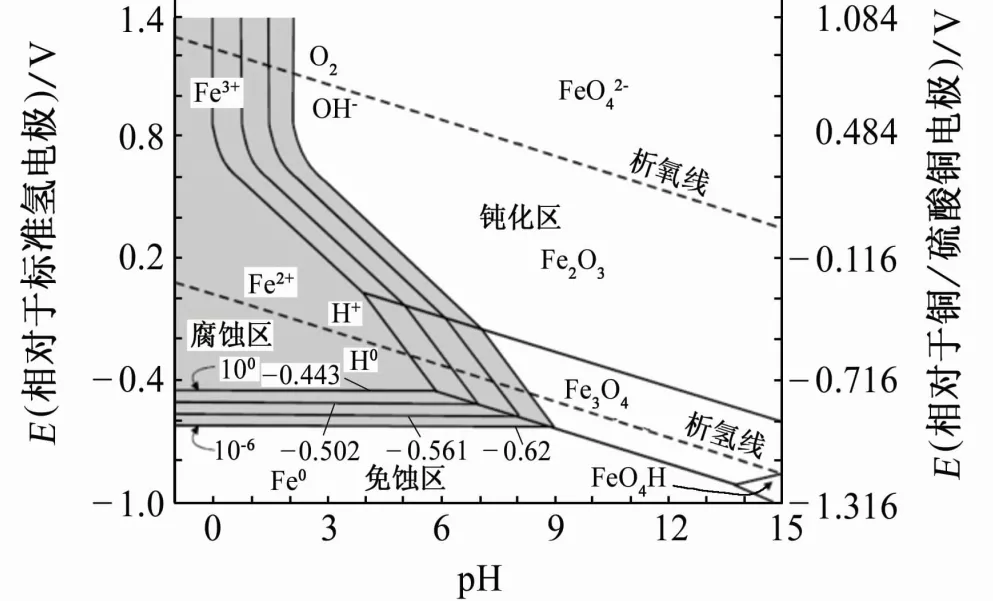
基于热力学数据所绘制的铁-水体系的Pourbaix图中存在腐蚀区、免蚀区和钝化区3种区域,如图2所示。在免蚀区内,电位和pH的变化不会引起金属腐蚀,即在热力学上金属处于稳定状态。阴极保护的理论保护电位即为金属进入免蚀区的临界电位。
图2 铁-水体系的Pourbaix图
根据Pourbaix图,理论保护电位与介质pH有密切的关系。从热力学的角度来看,只要铁电极的电位比上述电位值更负就不会发生腐蚀。比如,pH小于9时,只要铁电极的电位负于-0.620V(相对于标准氢电极),铁就不会发生腐蚀。由此基于热力学免蚀概念确定了阴极保护的作用机理。
3 基于热力学的钝化机理
1). 阴极极化造成pH增大及表面碱性化
KUHN在1928年的文章中介绍了他在埋地铸铁管道上应用阴极保护的开创性工作,他在文中提出电流可能流入阴极区形成氢氧化物膜从而保护这些区域免于腐蚀。EVANS也基于试验提出,阴极保护的有效性是通过表面钝化实现的。
当对结构物施加阴极保护电流时,在结构物与电解质的界面发生阴极反应,常见的阴极反应包括:
H++ e- → Ho
2H2O + O2 + 4e- → 4OH-
2H2O + 2e- → H2 +2OH-
上述所有阴极反应都令反应界面的pH上升,呈现碱性。
BARLO等研究了在充气、充氧和除气条件下,界面pH对钢铁腐蚀速率的影响。结果表明:在除气条件下,当钢表面的pH从8上升到9.3时,腐蚀速率降低到0.0254mm/a以下;在充气条件下,当pH上升到10时,腐蚀速率降低到0.0254mm/a以下;在充氧条件下,当pH上升到10.7时,腐蚀速率降低到0.0254mm/a以下。这表明界面的碱性化可以有效抑制腐蚀。
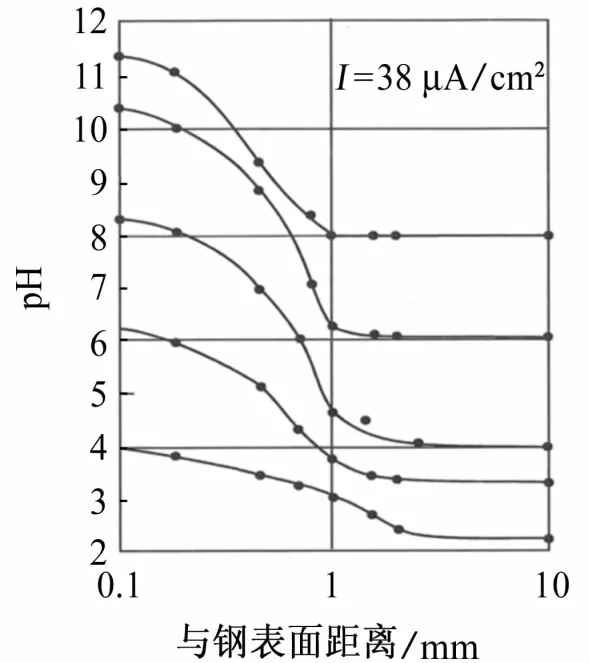
由阴极极化造成的pH上升现象在结构物与电解质的界面处最明显,在远离界面方向,pH逐渐恢复至电解质本体水平。图3为在不同本体pH环境中对结构物施加密度为38μA/cm2的阴极极化电流时界面附近pH的梯度分布。测试结果表明,在距离界面1mm处,pH基本降低到电解质本体pH水平。
图3 结构与电解质界面处pH的梯度分布
诸多研究表明钢材表面碱性化能有效减缓腐蚀,但阴极保护有效性的钝化机理一直未得到广泛的认可。
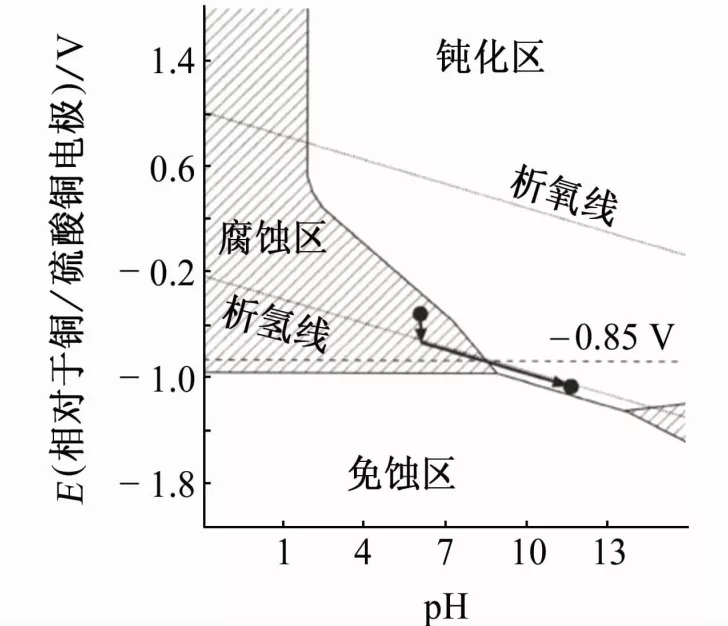
当对钢材施加阴极极化电流时,如果钢的电位已经达到了析氢电位,很难再将钢电位极化到比析氢电位更负的程度,钢的极化电位与析氢电位基本一致。此时继续增大阴极极化电流密度,电位将继续变负而pH继续增大,且钢表面电位与pH近似存在线性关系,如图4所示,电位就是pH的间接指示,随着阴极电流密度增大,钢的状态从腐蚀区逐渐转入钝化区。
图4 钢表面pH与电位的线性关系
在上文关于免蚀机理的讨论中提到,只要铁的电位处于免蚀区,就能达到阴极保护的要求。但在实践中,通常使用正于免蚀电位的阴极保护准则就可以达到有效的保护。事实上当阴极电位极化到析氢电位时,较难将电位再继续极化到更负水平而进入免蚀区。此时反应界面的氧已经基本消耗殆尽,腐蚀速率显著降低。当pH大于9时,铁进入钝化区(电流密度非常大时才可能进入免蚀区),不再有腐蚀的风险,对应的析氢平衡电位为-847mV(相对于铜/硫酸铜电极),这个电位与诸多标准中的极化电位准则吻合。
2). LEEDS的研究介绍
LEEDS等研究了低碳钢在三种不同溶液(3.5%盐水pH7、人造海水pH7.5、碱性溶液pH10)中的极化和表面钝化现象。在试验中,以恒电位模式对试样施加阴极电流,电位控制区间为-1.40~-0.65V(相对于Ag/AgCl电极,电极内溶液为3.5%NaCl)。
结果表明,在以恒电位模式施加阴极极化电流后,所有试样的电流密度都出现了显著下降。在试验开始的第3天,所有试样的表面都出现了膜/沉积物,膜/沉积物的成分取决于pH及电位。在3.5%盐水溶液中,试样表面没有钙质沉积物,当极化至-1.3~-1.4V时,表面的氧化物膜最完整,这些试样的腐蚀速率最低,膜的主要成分是磁性氧化铁和少量氢氧化亚铁。通常磁性氧化铁具有良好的导电性,但是氢氧化亚铁会使磁性氧化铁膜失去导电性,从而降低维持阴极保护所需的电流密度。在碱性溶液中的试样表面出现一层黑色的膜,但因厚度太小无法进行XRD分析。该层黑色的膜上覆盖着钙质沉积物。溶液中的钙和镁限制了铁氧化物的形成,所以氧化物膜的厚度很小。在试验中,电流密度持续降低,这意味着有一层“绝缘防腐蚀层”逐渐覆盖了钢铁表面。在人造海水中,试样表面覆盖了钙质沉积物,没有发现氧化物膜。
综上,LEEDS认为施加阴极保护可以使钢表面出现铁氧化物膜或钙质沉积物,它们可以和防腐蚀层一样,起到良好的防腐蚀作用,且膜/沉积物的组成成分取决于界面的pH和极化电位等因素。
基于试验所总结出的阴极保护电位准则:对于陆地应用,保护电位范围为-0.90~-1.1V(相对于铜/硫酸铜电极),pH为7~13;对于海洋应用,保护电位范围为-0.95~-1.1V(相对于铜/硫酸铜电极),pH 范围7~11。
3). BUCHLER的研究介绍
在BUCHLER等的研究工作中,基于界面是否可以积聚氢氧根离子(pH是否可以升高)提出了两种阴极保护准则。
(1)氢氧根离子可以在钢表面积聚
在没有硫酸盐还原菌、流动水或其他阻碍阴极保护令pH升高的环境中,可以使用较正的保护电位。在金属/溶液界面可以积聚氢氧根离子,有利于浓差极化和表面钝化。在这种情况下推荐断电电位准则:瞬间断电电位至少达到-850mV(相对于铜/硫酸铜电极)。在良好敷设情况下,所测试的断电电位不是Fe/Fe(II)电极电位,而是氢电极的平衡电极电位,-850mV(相对于铜/硫酸铜电极)对应的pH为9,只要pH大于9,防腐蚀层上所有破损点都会得到有效保护。
(2)不确定氢氧根离子是否可以在钢表面积聚
如果防腐蚀层破损点周边有硫酸盐还原菌、流动水或其他阻碍阴极保护令pH上升的条件存在,比-850mV(相对于铜/硫酸铜电极)更负的电位未必能消除腐蚀。此时建议使用-950 mV(相对于铜/硫酸铜电极)的保护电位准则。
讨论
1 对阳极溶解减缓机理的讨论
MEARS和BROWN以及HOAR差不多在相同的时间提出了类似的阳极溶解减缓机理,即将阴极电位极化到阳极的开路电位,消除金属表面的电位差,从而使阳极不再腐蚀溶解。在他们的验证实验中,使用铜和锌分别模拟阴极和阳极,将阴极极化到阳极的开路电位,就消除了阴极与阳极之间的电位差。虽然这种方法可以形象地展示由阴、阳极电位差变小带来的腐蚀电流降低效应。但是该理论存在瑕疵,其中的“开路电位”是指金属的自腐蚀电位,不是平衡电极电位,所以“阳极”还是处于自腐蚀状态。
从消除电位差、降低阳极腐蚀的角度来看,使用混合电位理论可以更准确地描述阴极保护的机理。将结构物从其自腐蚀电位极化到阳极的平衡电极电位,就完全消除了腐蚀。
阴极保护机理与热力学免蚀机理在某种程度上是一致的。如果阳极溶解减缓机理中的“开路电位”即平衡电极电位对应的亚铁离子活度为10-6mol/L,那么这个“开路电位”与Pourbaix中的免蚀电位就是相同的(pH小于9时)。
2 对热力学钝化机理的讨论
在有阴极保护管道的防腐蚀层破损点或鼓包处经常可以观察到黑色的覆盖膜。这种膜显然与管道表面pH升高有关,但是它的产生机理有待研究和澄清,它可能是由阴极保护单独作用产生的,或外部其他因素与阴极保护共同作用产生的。
阴极保护产生的高pH环境可促进钢表面氧化物钝化膜的形成,但这并不是唯一影响因素,土壤溶液成分、含氧量、硫酸盐还原菌、外部交直流干扰、钙镁沉积物等因素都可能对钝化膜的形成产生影响。
钢结构物表面在阴极保护状态下产生钝化膜的理论一直受到质疑。业界中较普遍的看法是发生阴极反应的碳钢/溶液界面具有很强的还原性,不具备形成钝化膜的条件。
业界尚需对埋地管道表面膜的形成机理进行更深入的研究。明确破损点表面氧化物膜的生成机理,对交流干扰、动态直流干扰的防护工作具有重大意义。
结论
MEARS和BROWN的阳极溶解减缓机理可以形象地展示腐蚀电池中电压差减小带来的腐蚀电流降低效应,但该机理在描述上有瑕疵。基于消除腐蚀电池的原理,阳极溶解减缓机理更准确的描述是:阴极保护将腐蚀电池中的阴极电位极化到阳极的平衡电极电位从而消除了腐蚀。
在施加阴极保护后,随着时间的推移,外加电流密度也显著降低,特别是在应用阴极保护的初始阶段,这被认为是表面膜或钙质沉积物形成导致的效应。阴极保护带来的界面碱性化是发生上述变化的起因之一。
阴极保护钝化理论受到广泛的质疑,发生阴极反应的碳钢/溶液界面具有很强的还原性,不具备形成钝化膜的条件。碳钢表面发生阴极极化时,表面产物膜的形成机理仍需进一步研究。
阴极保护能缓解腐蚀可能是多种因素共同作用的结果,包括且不仅限于:腐蚀电池中的阴极得到极化,令腐蚀电池中的电位差降低从而降低了腐蚀速率;界面的溶解氧被阴极反应消耗;氯离子等有害阴离子被驱离界面;施加阴极电流后界面呈现碱性,所形成的氧化物膜或钙质沉积物起到良好的屏蔽作用,减小了氧还原反应的极限电流密度。
无论是阳极溶解减缓机理、免蚀机理还是钝化机理,各种机理所对应的保护电位准则与现行标准中提出的-850mV(相对于铜/硫酸铜电极)极化电位准则基本是一致的。虽然目前还未明确阴极保护效应的机理,但这并不妨碍业界对该技术的应用。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414