CO2大点源包括大型化石燃料或生物能源设施、主要CO2排放型工业、天然气生产、合成燃料工厂以及基于化石燃料的制氢工厂[1,2]。随着工业化进程的不断推进,CO2的捕集与封存开始受到重视。目前,工业最常用单乙醇胺 (MEA) 捕集CO2[3,4,5,6]。为了节约成本,常用碳钢作为吸收装置和汽提装置材料,但碳钢易被腐蚀,因此捕集过程中的腐蚀问题日益凸显。本文总结了国外近年来对MEA-CO2腐蚀体系腐蚀机理及缓蚀剂的主要研究成果,为解决CO2捕集过程中的腐蚀问题,保证装置安全高效运行研究提供参考。
1 腐蚀机理
单乙醇胺 (MEA) 溶液在吸收CO2过程中的化学反应式如式 (1),RNH2、RNHCOO-、RNH3+分别代表胺、氨基甲酸根离子。氨基甲酸根离子与质子化胺水解产生的H3O+和HCO3-是导致溶液具有腐蚀性的主要原因[7]。
![]()
Soosaiprakasam等[8]在研究MEA吸收CO2溶液腐蚀行为时较全面地提出MEA-CO2溶液对碳钢的腐蚀机理,碳钢在该腐蚀体系中发生了电化学腐蚀。在无氧的条件下阴极反应主要是自由水、水合氢离子、HCO3-的还原反应[9],如式 (2)~(4),在有氧条件下阴极反应除了式 (2)~(4),还增加了氧气的还原反应,见式 (5)。

其中,反应式 (3) 中水合氢离子有4个来源,如式 (6)~(9)。
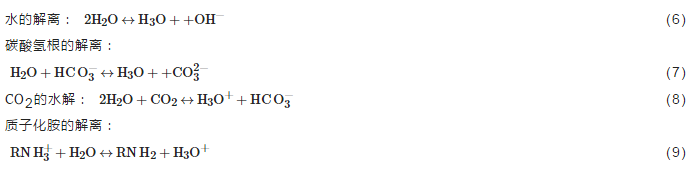
反应式 (4)、(7) 中HCO3-有两个来源,一是CO2的水解如式 (8),二是氨基甲酸根的水解,如式 (10)。
氨基甲酸根水解:

2 影响因素
2.1 氧
溶液中有氧时,MEA-CO2-O2腐蚀体系中阴极反应一部分为氧气得电子生成OH-,在该体系下氧气溶于溶液中对钢材的腐蚀有一定的影响。
Veawab等[10]研究了在80 ℃和30 ℃下MEA-CO2-O2体系中氧气浓度对1020碳钢腐蚀行为的影响,研究发现,进气氧含量从0%升高到10%,80 ℃溶液中碳钢腐蚀速率增加,由0.82 mm/a增加到1.16 mm/a。但在30 ℃溶液中碳钢的腐蚀速率先降低后升高,当进气氧含量为3%时,碳钢的腐蚀速率降至0 mm/a,当氧气浓度升高至10%时,碳钢的腐蚀速率上升至0.0254 mm/a,Veawab等认为,出现这种现象的原因是氧气的增加使碳钢表面生成了钝化膜,因此降低了腐蚀速率。
Kladkaew等[7]在通过极化曲线研究氧气浓度对1020碳钢腐蚀行为影响时也证实了上述结论,实验进气氧气含量为0%、6%、21%和100%,溶液温度为80 ℃,钝化电流密度由小至大排序为21%<6%<100%<0%,表明溶液中一定浓度的溶解氧有助于金属表面形成更加稳定的氧化膜,但过多的氧反而会降低钝化膜的稳定性。除此之外,其实验得到的不同氧气浓度极化曲线中电流密度相差不大,表明氧气浓度的变化对腐蚀的影响不大。
Soosaiprakasam等[8]在研究MEA-CO2-O2腐蚀行为时观察到随着氧气的增加,极化曲线塔菲尔区的阴极曲线斜率数值变大,阳极曲线斜率并未发生变化,说明氧气的增加带来了新的阴极反应,但对阳极反应速率并未有太大影响,即金属的腐蚀速率并未显著升高。由此,推测氧气在水中溶解度有限,氧气浓度的提升并不能使溶液的氧化性质有明显提升从而增加腐蚀速率。
2.2 MEA浓度
MEA浓度是影响MEA-CO2溶液腐蚀性的重要因素。随着MEA浓度升高,腐蚀速率不断升高。MEA浓度升高意味着溶液中吸收CO2的能力升高,导致溶液中RNHCOO-、RNH3+、HCO3-数量增多,从而引起腐蚀速率增加[10]。Soosaiprakasam等[8]在研究MEA浓度对溶液腐蚀影响时观察到不同MEA浓度下的Tafel阴阳极曲线斜率的变化,这说明了当MEA浓度发生改变,阴阳极的腐蚀反应也发生了一定的变化。Kladkaew等[7]在实验中观察到不同MEA浓度下极化曲线钝化区的电流密度也不相同,随着MEA浓度升高,钝化电流密度升高,表明了MEA浓度升高使钝化膜的保护性能降低。
2.3 温度
从反应动力学方面考虑,温度是影响化学反应一个重要因素。温度的改变导致各反应平衡变化,包括CO2的吸收,氨基甲酸根的形成,氨基甲酸根的水解,溶液的pH值和化学物质的溶解度[11]。一般来说,随着溶液温度升高,腐蚀速率升高。丹麦火力发电厂的燃烧后CO2捕集工业试验装置和加拿大某厂的天然气燃烧后捕集CO2工业试验装置中温度较高的部位 (100~120 ℃),如汽提塔顶部、汽提塔底部、汽提塔进出口管线等,腐蚀速率较高[12]。随着温度升高,反应式 (1) 会增强,因此溶液中存在的较大量的H+、HCO3-以及H3O+。检测到溶液pH值在降低,从而使金属溶解和氧化剂还原之间的平衡受到干扰,为保持平衡,更多的Fe将溶解到溶液中,随后产生更多的电子用于氧化剂的还原。从而加速腐蚀速率[7,10],Soosaiprakasam等[8]研究温度对MEA-CO2腐蚀体系影响时,发现在40 ℃时钝化区电流密度比80 ℃时低,但40 ℃时的电流密度波动较大。表明了40 ℃时钝化膜虽抗腐蚀效果好,但40 ℃时形成的钝化膜稳定性没有80 ℃高。结合Pourbaix图提出观点,认为出现这种现象的原因是:Fe(OH)4-的存在导致氧化膜的不断溶解与沉淀。
2.4 CO2浓度
CO2浓度是影响CO2捕集过程中腐蚀行为和腐蚀速率的一个重要因素,CO2浓度增加可以大大提升溶液对碳钢的腐蚀速率。这是因为随着CO2负荷的增加,使反应式 (1) 和反应式 (8) 往右方向移动,形成更多的HCO3-和RNH3+[11],从而产生大量的H3O+需要被还原,加速了金属的溶解。从极化曲线中可以看出,当CO2浓度升高时,阴极与阳极电流密度都要变大,且阴极电流密度变化更加明显[8,10],表明CO2浓度的增加主要通过提高氧化剂的还原速率来提高腐蚀速率。Kladkaew等[7]提出,CO2浓度的升高导致钝化区电流密度的升高,不利于钝化膜的形成。
2.5 热稳定盐 (HSS)
MEA在吸收CO2过程中会发生氧化降解和热降解[13],生成多种有机酸,如乙醇酸、丙酸、甲酸、草酸、醋酸等。这些酸在溶液中会形成胺盐或者热稳定盐 (HSS),而胺盐与热稳定盐一旦形成不可被降解并一直存在于装置中[11],加速金属腐蚀[14],腐蚀机理如式[15](15)、(16)。溶液中的Fe2+会与水结合形成Fe(H2O)62+,Fe(H2O)62+又会与热稳定盐阴离子反应生成络合物,反应将向生成络合物的方向移动,促进Fe的溶解形成Fe2+。

Tanthapanichakoon等[16]研究了不同热稳定盐以及热稳定盐的浓度对MEA-CO2溶液对碳钢1018和304不锈钢腐蚀性的影响,研究采用了六种热稳定盐 (草酸盐、甲酸盐、丙二酸盐、乙醇酸盐、丁二酸盐、醋酸盐),实验溶液采用5.0 kmol/m3 MEA溶液,实验温度为80 ℃,CO2负荷为0.2 mol/mol MEA。研究发现,六种热稳定盐会促进MEA-CO2溶液对1018碳钢的腐蚀,随着盐浓度升高腐蚀作用增强,其中草酸盐对碳钢腐蚀影响效果最大,丙二酸盐次之,甲酸盐第三。这3种盐会改变阳极与阴极反应机理,并减慢钝化膜的形成以及降低钝化膜对金属的保护作用,但可以扩大金属处于钝化区的电位区间。而乙醇酸盐、丁二酸盐、醋酸盐对腐蚀影响要远远小于前3种盐,并不会影响阴极与阳极的反应以及钝化膜的形成和保护作用。除此之外,作者还提出这六种热稳定盐不会造成碳钢的点蚀,也不会加剧MEA-CO2对304不锈钢的腐蚀性。
哌嗪是一种环状仲胺,由于其特殊的环状胺结构,哌嗪可以更快速的与CO2反应形成氨基甲酸根[17]。工业上常在MEA溶液中加入哌嗪以提高CO2吸收速率[18]。Nainar等[19]研究了不同热稳定盐 (醋酸盐、甲酸盐、草酸盐、硫代硫酸盐) 对MEA与哌嗪混合溶液对碳钢腐蚀性影响,研究结果表明,甲酸盐是提升溶液腐蚀性能最强的热稳定盐,其次是醋酸盐,最后是草酸盐和硫代硫酸盐;热稳定盐可以增强溶液的导电性可能是增强溶液腐蚀性能的原因之一。
Fytianos等[20]将5种热稳定盐所对应的有机酸 (乙醇酸、丙酸、甲酸、草酸、醋酸) 与质量分数30%MEA,CO2负荷0.4 mol/mol MEA溶液混合放置在316L不锈钢管中,实验温度保持在135 ℃。腐蚀严重程度由大到小依次为草酸、丙酸、甲酸、醋酸、乙醇酸。该科研团队所做实验用钢材虽然与上述Tanthapanichakoon团队的不同,但是热稳定盐的腐蚀影响程度结果却是一致的。
3 防腐措施
目前,应用缓蚀剂来解决CO2捕集过程中存在的腐蚀问题是最经济、最灵活的方法,可以应用于现有固定的装置设备,而不需要进行任何重大的工艺修改。
按照化学组成可以将缓蚀剂分为无机型缓蚀剂和有机型缓蚀剂[21]。针对工业醇胺捕集CO2系统,无机型缓蚀剂大部分为重金属盐,如钒、锑、铜、钴、锡、硫等的化合物。有机型缓蚀剂一般为有机胺类与羧酸类[22]。由于有机型缓蚀剂的缓蚀效果普遍低于无机型缓蚀剂,工业捕集CO2时一般偏向于采用无机型缓蚀剂,其中偏钒酸钠 (NaVO3) 是该系统中最常用缓蚀剂,最高可使抑制效果达97%。根据文献记录[23],在单乙醇胺 (MEA) 吸收酸性气体装置中加入1300 mg/kg的偏钒酸钠后可使得金属材质的腐蚀速率降低至0.0254 mm/a。但这些无机型缓蚀剂大多是剧毒,对于人体和环境都有很大的伤害,且处理费用高。硫代硫酸钠是无机缓蚀剂中相对来说毒性偏低的。
Sureshkumar等[24]运用电化学阻抗评估了硫代硫酸钠的缓蚀效率。腐蚀试样采用1018碳钢,实验溶液采用浓度为5.0 kmol/m3 MEA的饱和CO2溶液,实验中硫代硫酸钠浓度为250~10000 mg/kg。实验结果显示添加硫代硫酸钠短期内缓蚀效率可达91%~94%,其浓度变化所带来的缓蚀效率变化甚微。然而,硫代硫酸根离子吸附在金属表面,会引起钝化膜不稳定,因此硫代硫酸钠并不能起到长期缓蚀作用。
有机缓蚀剂毒性较低,近年来有学者开始研究其防腐效率。Veawab等[22]针对浓度为3.0 kmol/m3 MEA的饱和CO2溶液,在40 ℃至80 ℃的条件下,研究了有机型缓蚀剂的缓蚀效率。有机缓蚀剂芳香胺以及不同结构的含氮官能团的有机物,例如:咪唑、六亚甲基安、环己胺、二甲基吡啶,其腐蚀抑制率均低于60%。而长链脂肪胺、羧酸、亚砜等的腐蚀抑制率可高于75%。
4 结论
(1) MEA捕集CO2过程中生成氨基甲酸根离子、质子化胺以及CO2的水解是导致溶液具有腐蚀性的主要原因。
(2) 碳钢在MEA-CO2溶液中存在电化学反应,阳极反应为碳钢失电子溶解,阴极反应为游离水、H3O+、HCO3-得电子生成氢气以及O2得电子还原成OH-。
(3) 影响MEA-CO2腐蚀体系的主要因素有:氧气浓度、MEA浓度、CO2、温度、热稳定盐,氧气浓度升高、MEA浓度升高、CO2负荷增大、溶液温度升高以及热稳定盐浓度升高,可使溶液腐蚀性增强。不同热稳定盐对溶液腐蚀性影响不同,其中草酸盐对溶液腐蚀影响最大。
(4) 目前常用添加缓蚀剂来降低CO2捕集过程中的腐蚀,常用的无机缓蚀剂为偏钒酸钠,腐蚀抑制效果达97%,但毒性高。毒性较低的硫代硫酸钠的腐蚀抑制效果可达91%~94%,但不能起到长期缓蚀作用。有机缓蚀剂毒性较低,但腐蚀抑制效果普遍较低。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62313558-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





