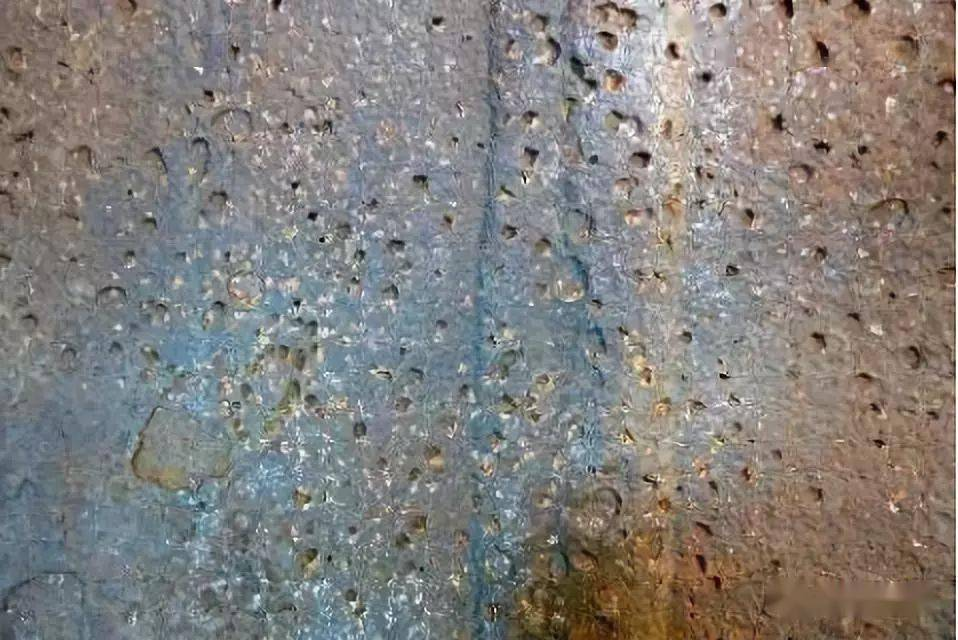在众多工业领域及日常生活环境中,金属材料广泛应用于各类设施与设备。然而,金属腐蚀问题一直是影响其使用寿命和安全性的关键因素。在诸多引发金属腐蚀的因素中,氯离子腐蚀表现得尤为突出,给工业生产和基础设施维护带来了严峻挑战。
氯离子广泛存在于海水、土壤、工业废水以及一些特定的化工生产环境中。其对金属材料的侵蚀作用不仅会导致金属结构的损坏,还可能引发安全事故,造成巨大的经济损失。因此,深入了解氯离子腐蚀的机制、影响因素及有效的防护措施,对于保障各类设施的安全稳定运行具有重要意义。
一、氯离子腐蚀的化学反应机制:微观世界的“侵蚀密码”
氯离子(Cl⁻)在腐蚀过程中扮演着极为活跃的角色。对于常见金属如钢铁,其腐蚀反应通常从金属表面的阳极氧化开始。在阳极区域,铁原子(Fe)失去电子变成亚铁离子(Fe²⁺)进入溶液,即Fe - 2e⁻ → Fe²⁺。而在阴极区域,由于溶液中存在溶解氧,会发生氧的还原反应,即O₂ + 2H₂O + 4e⁻→ 4OH⁻。当溶液中有氯离子存在时,情况变得更为复杂。
氯离子半径小、活性高,具有很强的穿透能力。它能够破坏金属表面原本形成的钝化膜,这层钝化膜在正常情况下可以阻止金属进一步被氧化。氯离子通过吸附在钝化膜表面,与金属离子形成可溶性的络合物,导致钝化膜局部溶解,从而暴露出新鲜的金属表面,加速阳极溶解过程。例如,在不锈钢中,铬(Cr)元素会在表面形成一层致密的Cr₂O₃钝化膜,阻止金属与外界环境接触。
但当氯离子存在时,它会与Cr³⁺形成络合物[CrCl₆]³⁻,使得钝化膜被破坏,引发不锈钢的点蚀等局部腐蚀现象。从微观角度看,氯离子的存在改变了金属表面的电化学平衡,促使腐蚀反应加速进行,这是氯离子腐蚀的核心化学反应机制。
二、氯离子腐蚀的常见类型:多面“腐蚀杀手”的肆虐方式
(一)点蚀:金属表面的“隐形炸弹”
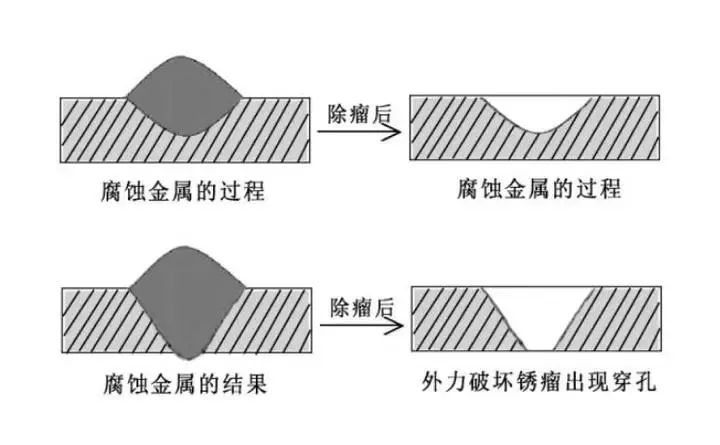
点蚀,也称为小孔腐蚀,是氯离子腐蚀中较为常见且具有隐蔽性的一种类型。在含有氯离子的溶液中,金属表面的某些局部区域,由于钝化膜的缺陷或其他原因,氯离子优先吸附并破坏钝化膜。一旦钝化膜被局部破坏,就形成了一个微小的阳极,而周围大面积未被破坏的钝化膜区域成为阴极,构成了一个腐蚀微电池。
由于阳极面积远小于阴极面积,阳极电流密度很大,使得腐蚀在这个微小区域迅速向深处发展,形成小孔。这些小孔初期可能难以被发现,但随着时间推移,会逐渐加深、扩大,最终可能穿透金属,严重影响金属结构的强度。例如在海洋环境中的船舶外壳,长期与海水接触,海水中高浓度的氯离子容易引发点蚀。一旦点蚀发生,可能在船体内部不易察觉的地方持续发展,当发现时,可能已经对船舶的安全航行构成威胁。
(二)缝隙腐蚀:隐蔽角落的“侵蚀黑手”
缝隙腐蚀通常发生在金属与金属或金属与非金属的连接处,如垫片、螺栓、铆接处等存在的缝隙。当含有氯离子的溶液进入这些缝隙后,由于缝隙内溶液的流动受到限制,氧气补充困难,形成了氧浓差电池。缝隙内缺氧区域成为阳极,发生金属溶解,而缝隙外富氧区域为阴极。
同时,氯离子在缝隙内不断积累,进一步加速了腐蚀过程。缝隙腐蚀的特点是腐蚀集中在缝隙内部及其周围,随着腐蚀产物的堆积,缝隙内的介质环境变得更加恶劣,腐蚀速率不断加快。在一些工业设备的法兰连接处,如果密封不良,含有氯离子的工艺流体就容易进入缝隙,引发缝隙腐蚀,导致设备泄漏等问题。
(三)应力腐蚀开裂:“内外夹击”下的金属崩溃
应力腐蚀开裂是氯离子腐蚀与拉应力共同作用的结果。金属在拉应力的作用下,内部晶体结构发生畸变,位错密度增加,使得金属表面的能量状态升高,更易发生腐蚀反应。当环境中存在氯离子时,氯离子会优先吸附在金属表面的缺陷或应力集中区域,破坏钝化膜,引发点蚀或缝隙腐蚀。
随着腐蚀的进行,腐蚀坑或裂纹尖端在拉应力的作用下不断扩展,最终导致金属材料突然断裂。这种腐蚀类型具有很强的破坏性,往往在没有明显预兆的情况下发生。例如在石油化工行业中,一些承受高压的管道,如果输送的介质中含有氯离子,同时管道又受到安装应力或内部压力产生的拉应力,就容易发生应力腐蚀开裂,一旦管道破裂,可能引发严重的安全事故。
三、影响氯离子腐蚀性的关键因素:腐蚀程度的“调控旋钮”
(一)氯离子浓度:腐蚀的“加速引擎”
氯离子浓度是影响其腐蚀性的重要因素之一。一般来说,溶液中氯离子浓度越高,金属腐蚀速率越快。当氯离子浓度增加时,更多的氯离子能够参与破坏金属表面的钝化膜,并且在腐蚀微电池中,高浓度的氯离子会增强阳极溶解反应的驱动力。
例如在海水环境中,海水中氯离子含量约为19000mg/L,远高于淡水,这使得海洋环境中的金属结构物更容易受到腐蚀。研究表明,对于碳钢在含氯离子的溶液中,当氯离子浓度从100mg/L增加到1000mg/L时,腐蚀速率可能会提高数倍。
在一些工业生产中,如氯碱工业、造纸工业等,生产过程中产生的废水中含有较高浓度的氯离子,如果未经处理直接排放,会对周边的金属基础设施造成严重腐蚀威胁。
(二)溶液pH值:酸碱环境的“腐蚀天平”
溶液的pH值对氯离子腐蚀性也有显著影响。在酸性环境下,氢离子(H⁺)浓度较高,会促进金属的阳极溶解反应,同时也有利于氯离子破坏钝化膜。
当pH值较低时,金属表面的腐蚀产物可能会以可溶盐的形式存在,无法形成有效的保护膜,从而加速腐蚀过程。例如在pH值为4-5的含氯离子溶液中,钢铁的腐蚀速率明显高于中性环境。而在碱性环境下,金属表面可能会形成一些氢氧化物沉淀,这些沉淀在一定程度上可以阻止氯离子与金属的接触,减缓腐蚀。
但当碱性过强时,某些金属如铝等可能会发生碱性腐蚀。对于大多数金属在含氯离子溶液中的腐蚀,中性至弱酸性环境下氯离子的腐蚀性表现得较为突出。
(三)温度:化学反应的“催化剂”
温度升高会加快化学反应速率,氯离子腐蚀也不例外。随着温度的上升,溶液中离子的扩散速度加快,金属表面的腐蚀反应动力学过程加速。一方面,温度升高使得金属原子的活性增强,更容易失去电子发生阳极氧化;另一方面,氯离子在高温下对钝化膜的破坏能力也增强。
例如在化工生产中,一些高温工艺过程中使用的设备,如果接触含有氯离子的介质,在高温环境下腐蚀速率会显著增加。研究数据显示,对于碳钢在含氯离子的水溶液中,温度每升高10℃,腐蚀速率可能会增加20%-30%。
但当温度升高到一定程度时,可能会使溶液中的溶解氧含量降低,在一定程度上又会影响阴极的吸氧腐蚀反应,从而对腐蚀速率产生复杂的影响。
四、氯离子腐蚀的防护策略:抵御腐蚀的“坚固盾牌”
(一)材料选择:从源头筑牢防线
选择合适的耐氯离子腐蚀材料是预防腐蚀的重要措施。对于一些对耐腐蚀性要求较高的环境,可选用不锈钢、镍基合金等材料。不同类型的不锈钢对氯离子腐蚀的抵抗能力有所差异,例如316L不锈钢中添加了钼(Mo)元素,增强了对氯离子的抗点蚀性能。
镍基合金如哈氏合金等,由于其合金成分的特性,在含氯离子的高温、高压以及强腐蚀环境下具有良好的耐蚀性。在海洋工程领域,一些关键结构件采用镍基合金制造,能够有效抵抗海水的腐蚀。
此外,还可以根据具体使用环境,对金属材料进行合金化处理,添加铬(Cr)、钼(Mo)、氮(N)等元素,优化材料的组织结构,提高其耐氯离子腐蚀性能。
氯离子在常温中性环境下对钛材的腐蚀性极低,钛材表面形成的氧化膜能有效抵御氯离子侵蚀。钛材在大多数含氯环境中表现出优异的耐腐蚀性,主要归因于以下机制:
钝化膜保护:钛在空气中自发形成致密的氧化膜(TiO₂),能有效阻隔氯离子与基体接触,尤其在湿氯气或中性氯化物溶液中稳定性极高。
化学惰性:钛与氯离子在酸碱中性条件下几乎不反应,仅在高活性环境(如高温、低含水量)下生成四氯化钛并引发腐蚀。
(二)涂层防护:给金属穿上“防护服”
涂层防护是一种广泛应用的防腐蚀方法。有机涂层如环氧树脂漆、聚氨酯漆等,能够在金属表面形成一层隔离层,阻止氯离子与金属直接接触。涂层的厚度、附着力以及完整性对防护效果至关重要。在涂装过程中,要确保金属表面处理干净,涂层均匀致密,避免出现针孔、气泡等缺陷。
对于一些恶劣的腐蚀环境,还可以采用热喷涂涂层,如喷涂锌、铝等金属涂层,利用这些金属的牺牲阳极保护作用,对基体金属进行防护。例如在海上石油平台的钢结构表面,采用热喷涂铝涂层结合有机封闭涂层的复合防护体系,能够有效延长钢结构的使用寿命。
(三)缓蚀剂应用:腐蚀反应的“抑制剂”
缓蚀剂是一种添加到腐蚀介质中能够降低金属腐蚀速率的物质。在含氯离子的溶液中,可使用一些缓蚀剂来抑制腐蚀。无机缓蚀剂如铬酸盐、亚硝酸盐等,通过在金属表面形成一层钝化膜来阻止腐蚀。但由于铬酸盐等具有毒性,其使用受到一定限制。
有机缓蚀剂如咪唑啉类、胺类等,通过吸附在金属表面,改变金属表面的电荷分布和腐蚀反应的活化能,从而抑制腐蚀过程。缓蚀剂的选择和使用浓度需要根据具体的腐蚀环境和金属材料进行优化,以达到最佳的防护效果。在一些工业循环冷却水系统中,添加适量的缓蚀剂可以有效控制水中氯离子对管道和设备的腐蚀。
在未来,随着材料科学、表面工程等领域的不断发展,相信会有更多先进的技术和方法应用于氯离子腐蚀防护,进一步提升金属材料在复杂腐蚀环境下的使用寿命。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414