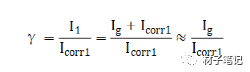概述
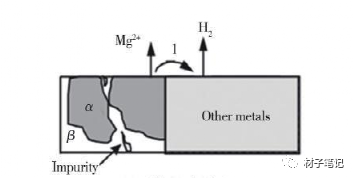
当两种金属或合金在介质中相互接触时,电位较负的金属或合金比它单独处于腐蚀介质中时腐蚀速度增大,而电位较正的金属或合金的腐蚀速度反而减小,得到一定程度的保护,这种腐蚀现象称为电偶腐蚀,又称为接触腐蚀或异金属腐蚀,参看图1的电偶腐蚀示意。在电偶腐蚀现象中,电位较负的阳极性金属腐蚀速度加大的效应,称为电偶腐蚀效应;而电位较正的阴极性金属腐蚀速度减小的效应,称为阴极保护效应。在实际的工程应用中,采用不同的金属、不同的合金、不同的金属与合金的组合是不可避免的,因而发生电偶腐蚀也是不可避免的,同时也是一种常见的局部腐蚀形态。例如,加固金属结构的铆钉与金属结构之间、镀层金属与基体金属之间都会发生电偶腐蚀。另外需要注意的是,电偶腐蚀不单单指两种金属的接触造成的腐蚀,某些金属(如碳钢)与某些非金属的电子导体(如石墨材料)相互接触时,也会产生电偶腐蚀。
电偶腐蚀的原理
两种或两种以上的金属、金属与非金属的电子导体、同一金属的不同部位,在腐蚀介质中互相接触时由于存在腐蚀电位的不同,将会构成宏观腐蚀电池,成为腐蚀电池的两个电极,电子可以在两个电极间直接转移,而这两个电极上进行的电极反应也将进行必要的调整,以满足电极界面电荷的平衡关系。
以金属在酸性溶液中的电偶腐蚀为例,当金属M1和M2在酸性溶液中没有相互接触时,阴极过程都是氢去极化过程,腐蚀金属电极上进行的相应电极反应为:
金属M1:
M1 → M1n+ + ne
2H+ +2e → H2
金属M2:
M2 → M2n+ + ne
2H+ +2e → H2
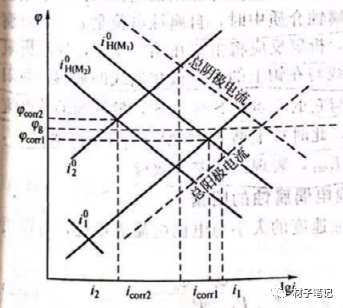
设金属M1其自腐蚀电位为φcorr1,自腐蚀电流为icorr1;金属M2的腐蚀电位为φcorr2,自腐蚀电流为icorr2。它们都处于活化极化控制,服从塔费尔关系,不妨设M1和M2两金属面积相等,M1的腐蚀电位比M2的腐蚀电位低,即φcorr1 << span="">φcorr2。当M1和M2在腐蚀介质中直接接触时,由于二者电极电位不相同,便构成一个宏观腐蚀电池,设这个宏观电池中溶液的同一个电位,金属M1电位由φcorr1向正方向移动,成为腐蚀电池的阳极,发生阳极极化,金属M2的电位由φcorr2向负方向移动,成为腐蚀电池的阴极,发生阴极极化。当这个极化达到稳态时,两条极化曲线的交点所对应的电位是金属的共同的混合电位φg, φg处于之间,M1和M2之间互相极化的电流称为电偶电流,用Ig表示。图2为金属M1和M2组成腐蚀电偶后的动力学极化示意。此处假设腐蚀电偶的阴极面积等于阳极面积。由图可见,金属M1的腐蚀速度从icorr1增加到i1,而金属M2的腐蚀速度从icorr2降甽到i2。也就是说,组成电偶的两金属由于电偶效应的结果,使电位较正的阴极性金属因阴极极化腐蚀速度减慢,从而得到一定程度的保护;而对于电位较负的阳极性金属,因阳极极化,反而会加快腐蚀的速度。
M1和M2两种金属偶接后,阳极性金属M1的腐蚀电流I1与未偶合时该金属的自腐蚀电流icorr1之比,称为电偶腐蚀效应系数,用γ表示。
式中,Icorr1表示M1未与M2偶接时的自腐蚀电流;I1表示M1与M2偶接后的腐蚀电流;Ig表示电偶电流。该公式表示,相接后阳极金属M1溶解速度比金属单独存在时的腐蚀速度增加的倍数。γ越大,则电偶腐蚀越严重。
宏观腐蚀电池对微观腐蚀电池的影响
电位较负的金属M1在与电位较正的金属M2构成电偶后,受到了M2对它的阳极极化作用,通过了一个大小为Ig的净的电偶电流,打破了它没有与M2偶接时的自腐蚀状态,同时在自腐蚀电位时建立的电荷平衡也被打破。同理,M2也由于与M1的偶接而打破了在自腐蚀电位时建立的电荷平衡。这说明宏观腐蚀电池的作用将使微观腐蚀电池的电流发生改变,这种效应称为差异效应。如果宏观电偶腐蚀电池使内部腐蚀微电池电流减少,则此效应为正差异效应;相反,如果引起内部腐蚀微电池电流增加,则称为负差异效应。
正差异效应可以通过锌在稀硫酸中和铂接触的实验来验证。首先,当锌单独存在时,收集腐蚀产生的氢气,在一定时间内收集的氢气的体积正比于锌的腐蚀速度,设其为V0。然后,将锌和铂在硫酸中用外部的导线连接,分别收集相同时间内锌和铂产生的氢气V1和 V2。V1相当于锌和铂组成电偶后受到铂阳极极化后腐蚀微电池的腐蚀速度。由于铂单独存在时在稀硫酸中不会产生析氢腐蚀,则V2相当于锌和铂接触后组成的宏观腐蚀电池的腐蚀速度。锌和铂接触后,总的腐蚀速度应等于微观腐蚀电池腐蚀速度V1与宏观腐蚀电池腐蚀速度V2之和。实验观察,虽然V1+V2大于V0,但V1却比V0小。这说明锌受到阳极极化后,它本身的腐蚀微电池电流减少了,所以产生了正差异效应。差异效应的实质是宏观腐蚀电池和金属内部微观腐蚀电池相互作用的结果,宏观电池的工作引起微电池工作的削弱正是正差异效应的现象。如果用铝来代替锌重复上述实验,发现不仅铝的总腐蚀速度增加,而且铝的微电池的腐蚀速度亦增加,这就是负差异效应的现象。
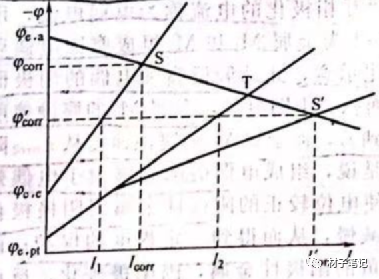
差异效应的现象,可用短路的多电极电池体系的图解方法进一步解释。将腐蚀着的金属看成双电极腐蚀电池,当锌和铂接触,即等于接入一个更强而组成一个三电极腐蚀电池,假定电极的面积比以及它们的阴极、阳极极化曲线可以确定的话,便可以给出体系差异效应的腐蚀极化曲线,如下图所示。在这个三电极体系中,铂可视为不腐蚀电极,对锌来说,除了未与铂接触时由于微电池作用而发生自溶解外,还因外加阳极电流而产生了阳极溶解,所以它的总腐蚀速度增加了。当锌单独处于腐蚀介质中时,自腐蚀电位是φcorr,自腐蚀电流是Icorr。当把铂接入后,由于铂的电位较正,析氢反应将主要在铂上发生,这是析氢的总的阴极化曲线应该是在锌表面析氢的极化曲线与在铂上的析氢极化曲线的加和,即阳极极化曲线与它的交点从S变为S’,锌腐蚀的总电流也变为Icorr’,此时锌上微观腐蚀电池的电流变为I1,小于原来的Icorr,表现出正差异效应。
影响电偶腐蚀速度的因素
①金属材料的电位差值
电偶腐蚀与相互接触的金属在溶液中的电位有关,因此构成了宏观腐蚀原电池,组成电偶的两个金属的电位差是电偶腐蚀的推动力。如果稳定电位起始电位差越大,则电偶腐蚀倾向也越大,即Ig越大,阳极腐蚀加速。
在电化学中使用标准电位序来比较不同金属材料间电位高低及差距,它是按金属元素标准电极电位的高低次序排列的次序表,是从热力学公式计算出来的,该电位是指金属在活度为1的该金属盐溶液中的平衡电位。而实际情况下,金属通常不是纯金属或者以合金形式存在,其表面状态也不同于理想的情况,如表面带有氧化膜等,并且腐蚀介质溶液成分复杂,因此标准电位序在实际使用中并不适合,在电偶腐蚀研究中常应用电偶序来判断不同金属材料接触后的电偶腐蚀倾向。
电偶序是指在具体使用腐蚀介质中,金属和合金稳定电位的排列次序表。表1为海水中金属与合金的电偶序。由表可见,如电位高的金属材料(表上部的金属或合金)与低电位金属材料(表下部的金属或合金)互相接触,则低电位的成为阳极,被加速腐蚀,且两者之间电位差越大(在电偶序表中相距越远),则低电位的金属腐蚀速度越快。
无论标准电位序还是电偶序都只能反映一个腐蚀倾向,不能表示出实际的腐蚀速度。有时某些金属在具体介质中接触后可能发生极性的转换,双方电位可以发生逆转。例如,铝和镁在中性氯化钠溶液中接触,开始时铝比镁电位正,镁为阳极发生溶解,之后由于镁的溶解而使介质变为碱性,这时电位发生逆转,铝变成了阳极,所以电动序与电偶序都有一定的局限性。金属的电偶序因介质条件不同而异,所以电偶序总是要规定在什么环境中才适用,实践中应用的不但有海水的电偶序,还有土壤中的电偶序以及某些化工介质中的电偶序等。
②极化作用
不论是使阳极极化率增大还是使阴极极化率增大,都有利于使电偶腐蚀电流降低。例如,在海水中不锈钢与碳钢的阴极反应都是受氧的扩散控制,当这两种金属偶接以后,不锈钢由于钝化使得阳极极化率比碳钢高得多,所以偶接后不锈钢能够强烈加速碳钢的腐蚀。再比如,在海水中不锈钢与铝组成的电偶对比铜与铝组成的电偶对腐蚀倾向小,这两对电偶的电位差值相差不多,阴极反应都是氧分子的去极化过程,但是因为不锈钢有良好的钝化膜,阴极反应只能在膜的薄弱处进行,阴极极化率高,阴极反应相对难以进行,而铜铝组成的电偶对的铜表面氧化物能被阴极还原,阴极反应容易进行,阴极极化率小,故而电偶腐蚀效应严重得多。
电偶体系的欧姆电阻也会对电偶电流产生影响,电阻越大,电偶腐蚀速度越小。实际中观察到,电偶腐蚀主要发生在两种不同金属或金属与非金属导体相互接触的边线附近,而在远离边缘的区域,其腐蚀程度要轻得多。这就是因为由于电流流动要克服电阻的作用,距离电偶的接合部位愈远,相应的腐蚀电流密度越小,所以溶液电阻大小影响电偶的“有效作用距离”,电阻越大则“有效作用距离”越小,因而阳极金属腐蚀电流呈不均匀的分布。例如,在蒸馏水中,腐蚀电流有效距离只有几厘米,使阳极金属在接合部附近形成深的腐蚀沟,而在海水中,电流的有效距离可达几十厘米,阳极电流的分布就比较均匀不会发生特别严重的阴阳极接触部位的腐蚀。
表1 常见金属在海水中电偶序
③阴阳极面积比
阴阳极面积变大,使得电偶腐蚀电流变大,但实际中更重要的因素是阴阳极之间的面积比。电偶腐蚀电池的阳极面积减小,阴极面积增大,将导致阳极金属腐蚀加剧,这是因为电偶腐蚀电池工作时阳极电流总是等于阴极电流,阳极面积愈小,则阳极上电流密度就愈大,即金属的腐蚀速度愈大。在局部腐蚀过程中,由于阳极电流和阴极电流的不平衡,使得金属表面一些局部区域具有较高的阳极溶解电流,面其余表面的区域则具有较大的阴极还原电流,阳极反应和阴极反应发生在不同的部位,因此腐蚀金属表面的阴阳极面积比对所观测到的局部腐蚀速率有较大的影响。阴阳极面积比影响局部腐蚀速度的一个典型的例子,就是铜板使用铁铆钉加固和铁板使用铜铆钉加固分别产生了不同的效果。铜的电位比铁正,所以铜板装上铁铆钉后,由于构成了大阴极小阳极的电偶腐蚀,使铁铆钉很快被腐蚀掉,然而铁板装上铜铆钉使铁板的腐蚀增加并不多。
在腐蚀过程中,尤其是实际的金属结构件中,若形成了大阴极/小阳极的情况,阳极区域将具有很高的阳极溶解速度,这往往导致强烈的局部腐蚀,并导致材料失效。例如,在钢铁材料表面上若镀覆有阴极性金属镀层,如果金属镀层存在针孔或金属镀层的腐蚀产生了针孔或镀层发生破损,使得在针孔或破损处裸露出金属基体,由于金属基体的电位较金属镀层低,在与腐蚀介质相接触时,针孔或破损处的金属基体作为阳极区发生了阳极溶解,而阴极去极化剂的反应发生在金属镀层表面,此时构成了典型的大阴极小阳极偶对,使局部腐蚀在针孔或破损处以很高的速度进行,形成镀层下的腐蚀坑。阴阳极面积比对局部腐蚀影响的现象不仅出现在不同金属偶接上,而且也出现在同种金属表面由于各种因素引起的电化学不均匀性上。如点腐蚀孔中的阳极区与孔外阴极区、缝隙腐蚀中的阳极区与缝隙外阴极区、金属表面磨损区的阳极区与未被磨损区的阴极区等,都能构成小阳极大阴极的电偶腐蚀,从而使金属的局部腐蚀加速。
防止电偶腐蚀的措施
1)组装构件应尽量选择在电偶序表中位置相近的金属。由于对于特定的使用介质不定有现成的电偶序,所以应该预先进行必要的电偶腐蚀实验。
2)对于不同金属构成的结构部件应该尽量避免形成大阴极小阳极的接触结角
3)采用绝缘材料或保护性阻挡涂层分隔电偶腐蚀的接触部位。不同金属部件之间绝缘,可以有效地防止电偶腐蚀。
4)采用电化学保护。即可以使用外加电源对整个设备实行阴极保护,使两种金属都变为阴极,也可以安装一块电极电位比两种金属更负的第三种金属作为牺性阳极。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414