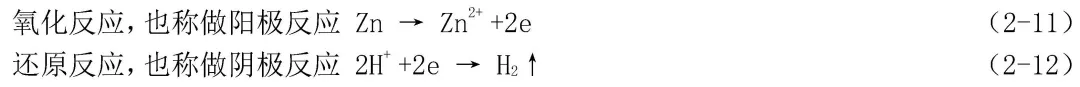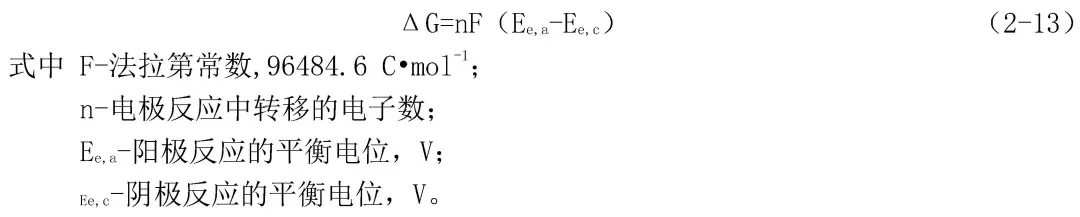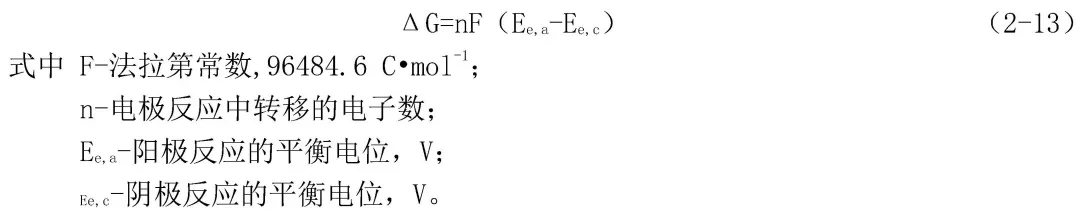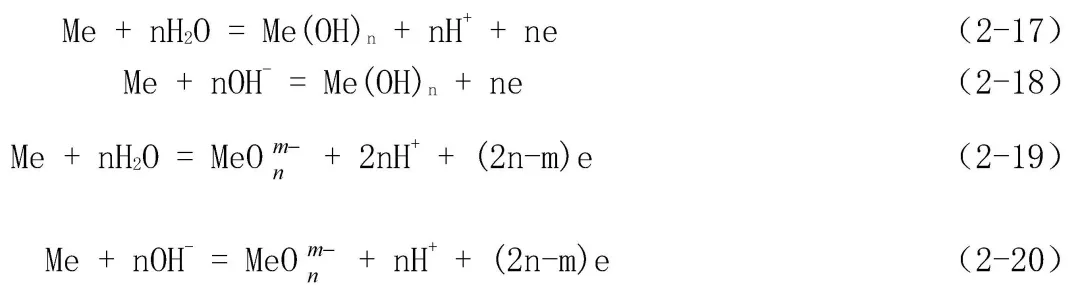第二章 腐蚀的基本原理
电化学腐蚀
电化学腐蚀是金属材料与电解质溶液互相接触时,在界面上发生有自由电子参加的广义氧化和还原反应,使接触面的金属变为离子而溶解或生成稳定化合物的过程,是以金属为阳极的腐蚀电池过程。金属在电解质溶液(包括大气腐蚀情况下的薄水膜)和熔盐中的腐蚀过程是电化学腐蚀过程,电解质溶液和熔盐的共同特征是它们都是离子导体,依靠带电荷离子的活动而导电。
2.3.1 电化学腐蚀过程的基本原理
本质上,金属电化学腐蚀过程与金属的化学腐蚀过程一样,都是氧化还原反应,即金属原子被氧化(失去价电子),而某一氧化剂被还原。但这两类腐蚀过程的氧化还原的进行方式又有重大区别。
在化学腐蚀过程的情况下,氧化还原过程只有在反应粒子(氧化剂的分子或原子和金属的原子)相互直接碰撞的过程中才能发生。所以,在氧化还原反应中的氧化过程和还原过程两者不仅必须在同时,而且必须在同一个碰撞点发生。
电化学腐蚀过程则不然,虽然氧化过程和还原过程是必须同时进行的,但氧化剂的粒子不必直接同被氧化的那个金属原子碰撞,而可以在金属表面上的其他部分得到电子。
这就是说,在电化学腐蚀过程中,整个腐蚀反应分成两个既是互相联系又是相对独立的半反应分别同时进行的。如锌在除氧的硫酸中腐蚀时两个半反应:
在这两个反应方程式所表示的腐蚀反应中,氧化剂是H+,作为去极化剂,在腐蚀反应中被还原成氢分子。
由于电化学腐蚀过程的这一基本特点-两个半反应在空间上的可分性,使得两个半反应可以各自在最有利于它们进行的地点进行,从而也使得整个腐蚀反应可以在阻力最小的条件下进行。
2.3.2 发生电化学腐蚀的热力学条件
一个腐蚀反应是否会发生,同任何其他过程一样,取决于这个反应进行时整个体系的自由能是否降低。如从反应体系的始态转变为反应体系的终态,自由能降低,则这个反应就能够自发地进行。对于一个电化学腐蚀反应来说,自由能变化ΔG可以用式(2-13)表示:
由式(2-11)看出,只有当时Ee,a-Ee,c>0 腐蚀反应才能发生。
如果一个电极反应(半反应)处于平衡,相应的电位叫做这个电极反应的平衡电位Ee,Ee与参与这个电极反应的物质活度之间的关系可以用能斯特(Nernst)方程式表达:
标准电极电位是当参加电极反应的物质处于标准状态下,即溶液中该种物质的离子活度为1、温度为298.15 K、气体分压为101325 Pa (1atm) 时,电极的平衡电极电位,用Eo表示。国际上规定标准氢电极电位为零,在没有特殊说明条件下,其他电极的电极电位都是以标准氢电极为基准。通常用金属的标准电极电位可以近似地判断它们的热力学稳定性。
E0可以在相关电化学手册中查找,根据能斯特方程式计算电化学腐蚀过程的平衡电位Ee,a和Ee,c,按式(2-11)判断这个电化学过程是否可能发生。
2.3.3 溶液的pH值对电化学腐蚀的影响
在水溶液中,常温下[H+][OH-]=10-14,这与电化学腐蚀过程有着密切的关系,在水溶液中的电化学腐蚀过程的阴极反应一般都是H+或O2的去极化过程,两个电极反应都涉及H+或OH-,反应式为:
溶液的pH值还会影响到阳极反应的形式和反应产物,如在pH值较高的溶液中,还可以进行如下阳极反应:
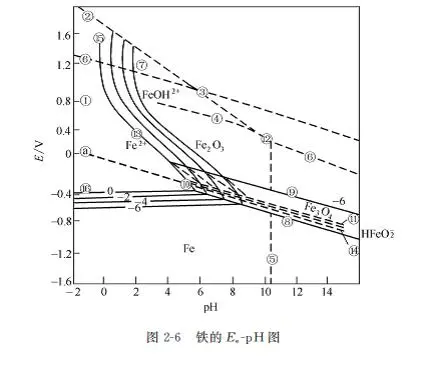
2.3.4 E-pH图(pourbAlx diagram)
在金属腐蚀过程中,电位是控制金属离子化过程的因素,pH值是控制膜稳定性的因素。应用这2个因素,以电位(相对于标准氢电极)为纵坐标、以pH值为横坐标的电化学相图,又称布拜图。据此,可从热力学上判断某种金属在给定的电位和pH值条件下是否会发生腐蚀及其平衡状态。它可以指出金属腐蚀的倾向,但并不能指示腐蚀速度。目前已将几乎全部元素的这种平衡图研究完成,近年来,这些平衡图已越来越多地在金属腐蚀、电化学以及其它有关领域里得到应用。
根据电化学反应的原理,可以将与金属在水溶液中的腐蚀过程有关的反应概括为3种类型:
① 化学价有变化(得到或失去电子,即还原与氧化),但没有H+或OH-参与的反应,这一类反应的平衡只与金属的电位E有关,而与溶液的pH值无关。如:
Me = Men+ + ne (2-21)
② 化学价没有变化,但有H+或OH-参与的反应,这一类反应的平衡只与溶液的pH值有关,而与金属的电位E无关。如:
③ 化学价有变化,而且有H+或OH-参与的反应,这一类反应的平衡既与金属的电位E有关,又与溶液的pH值有关。如:
Me + nOH- = Me(OH)n↓ + ne(2-24)
以电位为纵轴,溶液的pH值为横轴,将一种金属在水溶液中与腐蚀过程有关的反应的平衡值绘制平衡线,则在其他参与条件保持不变的情况下,可以得到3种类型的平衡线:
① 平行于横轴的水平线,平衡只与溶液pH值有关;
② 平行于纵轴的垂直线,平衡与只金属的电位E有关;
③ 倾斜线,平衡既与金属的电位E有关,又与溶液的pH值有关。
Fe的E-pH图,如图2-6。
利用E-pH图,可以根据金属的电位和溶液的pH值来判断:
① 腐蚀区:如果金属的电位E和溶液的pH值的观察点落在金属离子稳定的区域,腐蚀过程就可能发生。
如果发生腐蚀反应,是以O2为去极化剂,还是H+为去极化剂,在E-pH图中有两条倾斜的平行的虚线。上面一条是O2还原成为OH-的反应(Po2=101kPa)的平衡线,下面一条是H+还原为H2的反应(PH2=101kPa)的平衡线。如金属的电位和溶液的pH值的观测点落在下面那条虚线的下面,腐蚀反应就既能以O2为去极化剂,也能以H+为去极化剂。如果观测点位于这两条虚线之间,那么腐蚀过程只能以O2为去极化剂。
② 钝化区:如果金属的电位和溶液的pH值的观测点落在金属的氧化物或金属的氢氧化物稳定的区域,就有可能生成腐蚀产物膜或钝化膜。这是材料获得阳极保护的依据,在此区域内,金属是否遭受腐蚀,取决于所生成的固态膜是否具有保护性。
③ 稳定区(非腐蚀区):在该区域内,E和pH值的变化不会引起金属的腐蚀,即在热力学上,金属处于稳定状态。这些耐蚀性不同的区域的具体位置取决于选用的临界条件,随临界条件不同而不同,常用溶液中金属离子或金属配合离子的活度为10-6作为临界条件,这是材料获得阴极保护的依据,一般说来,只要将金属的电位降低到低于金属离子活度为10-6的平衡线,金属就能得到充分的阴极保护。
2.3.5 金属电化学腐蚀过程的基本动力学规律
金属电化学腐蚀的整个腐蚀反应过程,包括4大步骤:去极化剂到达金属表面的传质过程;阳极反应过程;与阳极反应过程同时进行的去极化剂还原的阴极反应过程;腐蚀产物离开金属表面或转化为其他化合物的过程,每一大步骤中都包括一系列中间步骤。在这4大步骤中,前3个步骤无论哪一个步骤进行困难都会影响整个腐蚀反应的速度,称为控制步骤,整个腐蚀反应的速度主要由控制步骤的进行速度控制。在研究腐蚀过程时,很重要的是要弄清这个腐蚀过程的速度控制步骤,知道了一个腐蚀过程的速度控制步骤,就可以设法对控制步骤施加影响,使它的进行更加困难,就易于使整个腐蚀过程的速度降低。
① 传质过程。影响去极化剂到达金属表面的传质过程速度的主要因素有:溶液与金属表面之间的相对运动速度、去极化剂在溶液中的含量、溶液的温度和黏度。一般来说,溶液与金属表面的相对运动速度越大、溶液中去极化剂的含量越高、溶液的温度越高和溶液的黏度越小传质过程就进行得越快。例如,钢铁在海水中的腐蚀过程是以溶解在海水中的O2 为去极化剂的,在静止的海水中O2 向钢铁表面的扩散过程是控制步骤,但如果海水与钢铁表面之间以很高的速度相对运动,O2的扩散过程就大为加速,以至于这个传质过程可以不再是整个腐蚀过程的控制步骤。所以静止条件下的腐蚀试验结果与溶液流动条件下的会有很大的不同。另外还要注意,影响传质过程速度的各因素中有些是互相影响的,特别对温度这个因素要加以注意,温度升高会使扩散过程容易进行,而且溶液的黏度一般也是随着温度的升高而降低,所以,一般温度升高,腐蚀速率会上升;但气体在溶液中的溶解度是随着温度的升高而降低,如果去极化剂是气体,而且进行腐蚀体系是敞开的,温度升高使溶液中溶解气体的含量降低,因此,腐蚀速率也相应下降。
② 阳极或阴极反应过程。这是一个涉及电子得失的过程。腐蚀过程中的阳极反应过程是金属原子失去价电子而成为金属离子或化合物的过程,金属的腐蚀破坏是它的直接结果,其速度与金属的电位有关。在金属的电位E等于阳极反应的平衡电位Ee,a时,阳极反应处于平衡,宏观的反应速度为零。只有当金属的电位E偏离平衡点位形成过电位,阳极或阴极反应的宏观速度才大于0。电极反应动力学规律为:
a.过电位是电极上有电流通过时的电极电位与其初始电位的差值,η=E-E平。过电位反映了极化作用的大小。过电位越大,极化作用越大。对于腐蚀原电池,极化增加原电池对外做功的能力大大下降,腐蚀速率下降。也就是说,极化有利于金属的电化学防护,但不利于原电池放电。用初始电位计算得到的腐蚀速率要比实际腐蚀速率大1-2个数量级,就是因为极化作用的影响。
b.η>0,电极反应按阳极反应方向进行;η<0,电极反应按阴极反应方向进行。
c.过电位的数值越大,在金属的表面状态没有改变的条件下(如,金属表面上没有生成钝化膜或其他腐蚀产物膜)阳极反应的速度就越大。所以,在金属表面状态不变的情况下,凡是能使金属的电位E提高或平衡电位Ee,a降低,从而使得阳极反应过电位增大的因素,都会加速金属的阳极溶解反应,反之亦然。如Fe在酸中腐蚀时的电位比Zn在酸中腐蚀的电位高,如果在酸中这两种金属发生“电接触”,那么Zn的电位将会升高而Fe的电位将会降低直至两者接近相同,故Zn的阳极溶解速度将因这种电接触而增大,Fe的阳极溶解速度则降低。又如,溶液中存在着能同金属离子络合的物质,就使金属阳极溶解反应的平衡电位降低,从而加速金属的阳极溶解速度。
d.由于电极反应发生于金属表面,是一种表面反应,故其他物质在金属表面上的吸附会影响阳极反应的速度。有的会加速金属的阳极溶解速度,如Cl-;有的物质吸附在金属表面上后,则使阳极反应减速,如某些缓蚀剂。许多有机胺在金属表面上的吸附,能降低H+还原的反应速度。
e.阳极钝化。阳极极化可以使金属表面形成完整的能阻碍金属离子穿过的表面膜,阳极溶解过程就会受到极大抑制。特别是一些金属,例如黑色金属,在一些介质中电位E提高到相当高的数值,金属的表面状态会发生变化,生成一种很薄,但金属离子很难穿过的氧化膜。此时阳极溶解速度可以降得很低,这种膜就称为钝化膜,生成钝化膜的过程叫做钝化过程。
f.阴极反应也是一种表面反应,金属表面的性质对于反应有很大影响。例如H+ 还原为H2的反应,在Pt、Pd上很容易进行,在Cu、Fe表面就难一些,而在Pb、Hg等金属表面上则就相当困难。
③ 腐蚀产物离开金属表面或转化为其他化合物的过程是电化学腐蚀反应已经完成以后的过程,但有时这一步骤进行的情况也会反过来影响前面3个步骤,从而影响整个腐蚀过程的速度。例如,如果腐蚀反应产物最终形成固体物质而覆盖在金属表面,就会使得前面的3个步骤进行困难,从而抑制腐蚀速度。或腐蚀产物形成疏松的沉积物,使金属表面局部腐蚀环境发生变化,引起垢下腐蚀。
2.3.6 腐蚀电池
腐蚀原电池的原理与一般原电池的原理一样,它只不过是将外电路短路的电池。
电化学腐蚀的特点是氧化过程和还原过程在空间上的可分,阳极反应和阴极反应的表面区域构成了腐蚀电池。腐蚀电池实质上是一个短路原电池,电流不对外作功,电子自耗于腐蚀电池内阴极还原反应中。腐蚀电池的构成以及阳极区和阴极区的分布情况对腐蚀破坏的形式有很大影响,腐蚀电池的形成可以使腐蚀过程以最有利于它进行的方式进行,所以它的形成都是使腐蚀加速,腐蚀破坏总是主要集中在阳极区,如果腐蚀电池是由大的阴极区和小的阳极区构成的,就会出现危险性较大的局部腐蚀的形式。
一个腐蚀电池必须包括阳极、阴极、电解质溶液和电路4个不可分割的部分。构成电池的3个必要条件为:
① 存在电位差,要有阴极、阳极存在;
② 有电解质溶液存在,溶液中有氧化剂(根本原因);
③ 在腐蚀电池的阴、阳极之间要有连续传递电子的回路。
腐蚀电池和一般丹尼尔电池的区别在于:
① 不是一种可逆电池;
② 不能将化学能转化为电能,氧化还原反应所释放的化学能全部以热能方式散发;
③ 只能导致金属材料破坏。
腐蚀电池的工作过程:
① 阳极过程:Me → Men+ + ne (2-25)
② 阴极过程:D + ne → Dne (2-26)
③ 电流流动:
金属中:电子从阳极到阴极;
溶液中:阳离子从阳极向阴极移动、阴离子从阴极向阳极移动;
金属/电解质界面电迁移,电子由低电位金属或区域传荷到电位高的金属或区域,再转移给氧化剂。
腐蚀电池的特点:
①阴、阳极区宏观可分或不可分,或交替发生;阴极、阳极反应相对独立,但又必须耦合,形成腐蚀电池;
②金属的腐蚀集中出现在阳极区,阴极区只起传递电子的作用;ia=ic,无净电荷积累;
③ 上述3个工作过程相互独立,又彼此联系;
④ 只要介质中存在氧化剂 (去极化剂),能获得电子使金属氧化,腐蚀就可发生;体系由不稳定到稳定,腐蚀过程是自发反应,并以最大限度的不可逆方式进行;
⑤ 腐蚀的二次产物对腐蚀影响很大;
⑥ 腐蚀电池不对外作功,是只导致金属腐蚀破坏的短路原电池。
腐蚀电池可分为宏观腐蚀电池、微观腐蚀电池和亚微观(10-100?)腐蚀电池。
要想使整个金属的物理和化学性质、金属各部位所接触介质的物理和化学性质完全相同,使金属表面各点的电极电位完全相同是不可能的。由于种种因素使得金属表面的物理和化学性能存在着差异,使金属表面上各部位的电位不相等,这些情况统称为电化学不均匀性,它是形成腐蚀电池的基本原因。金属表面的腐蚀电池都是微电池,金属表面由微阴极和微阳极组成的众多微电池是用目视难以分辨出电极的极性,但确实存在着氧化和还原反应过程的原电池。形成腐蚀微电池的主要原因有:
① 金属表面电化学不均匀性,使金属材料表面存在微小的电位高低不等的区域;
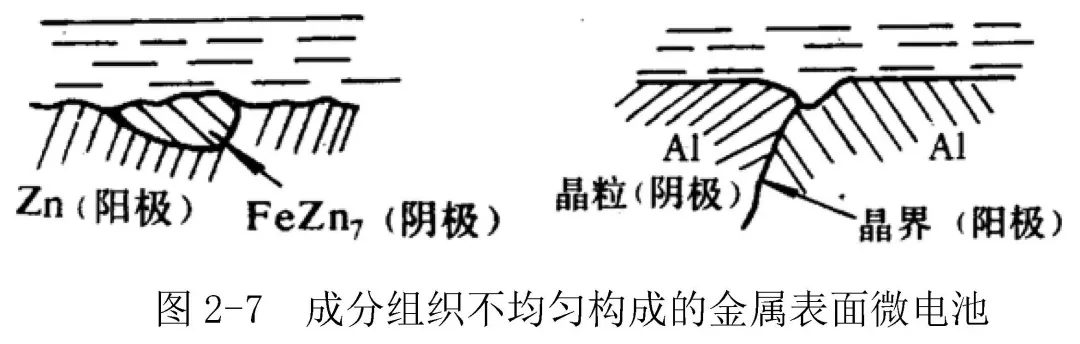
② 成分和组织不均匀引起的微电池;如:碳钢中的渗碳体Fe3C,工业纯锌中的铁杂质FeZn7,铸铁中的石墨等,晶粒-晶界腐蚀微电池,图2-7。
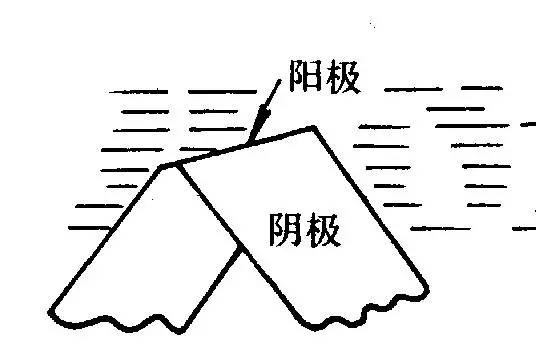
③ 金属表面物理状态的不均匀性构成微观电池。如应力分布不均匀或形变不均匀,导致腐蚀微电池,图2-8。
图2-8 金属表面物理状态的不均匀性构成微观电池
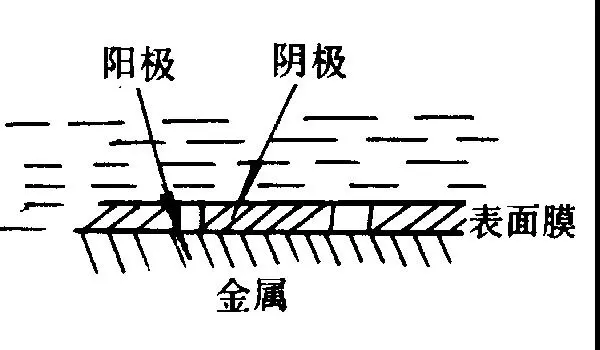
④ 金属表面膜不完整构成微观电池。金属表面形成的钝化膜或镀覆的涂层存在孔隙或发生破损,裸露出金属基体,金属基体电位较负,钝化膜或覆层的电位较正,金属基体与钝化膜或阴极性涂层构成微观腐蚀电池,孔隙或破损处作为阳极而受到腐蚀,图2-9。
图2-9 金属表面膜不完整构成微观电池
腐蚀体系的宏观差异,还可以构成腐蚀宏电池,如异种金属的接触、介质的浓度差、介质或金属的温度差、沉积物分布、金属构件的应力差等都可以构成腐蚀电池。
化学腐蚀与电化学腐蚀的区别见表2-1。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
相关文章

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414
点击排行
PPT新闻
“海洋金属”——钛合金在舰船的
点击数:7130
腐蚀与“海上丝绸之路”
点击数:5741