铝是一种活泼金属,极容易和空气中的氧气起化应生成氧化铝。氧化铝在铝制器皿表面结一层灰色致密的极薄的(约十万分之一厘米厚)薄膜,这层薄膜十分坚固,它能使里力的金属和外界完全隔开。从而保护内部的铝不再受空气中氧气的侵蚀。
铝和氧化铝薄膜都能和许多酸性或碱性物质起化学反应,一旦氧化铝薄膜被碱性溶液或酸性溶液溶解掉,则内部铝就要和碱性或酸性溶液起反应而渐渐被侵蚀掉。所以铝制器皿不能用碱性溶液或酸性溶液洗刷,也不能用铝制器皿盛放纯碱、洗衣粉或食醋等物质。
1、 铝的腐蚀形式:
(1)点腐蚀:点腐蚀又称为孔腐蚀,是在金属上产生针尖状、点状、孔状的一种为局部的腐蚀形态。点腐蚀是阳极反应的一种独特形式,是一种自催化过程,即点腐蚀孔内的腐蚀过程造成的条件,如有腐蚀介质(CL-、F-等)、促进反应的物质(CU2+、ZN2+等),既促进又足以维持腐蚀的继续进行。
(2)均匀腐蚀:铝在磷酸与氢氧化钠等溶液中,其上的氧化膜溶解,发生均匀腐蚀,溶解速度也是均匀的。溶液温度升高,溶液浓度增大,促进铝的腐蚀。
(3)缝隙腐蚀:缝隙腐蚀是一种局部腐蚀。金属部件在电解溶液中,由于金属与金属或金属与非金属之间形成缝隙,其宽度足以使介质浸入而又使介质处于一种停滞状态,使得缝隙内部腐蚀加剧的现象称为缝隙腐蚀。缝隙腐蚀特别容易发生在机械组件接合的地方,例如金属垫圈或是铆接处和铝门窗与灰浆填隙处。它是属于一种电池效应,但是缝隙一般需在特定程度大小的范围内才会发生,例如:有足够的宽度可使溶液进入,足够窄得使溶液可以停滞等,所以在应用或工程上必须要小心,避免发生足以产生缝隙腐蚀的环境。缝隙腐蚀的机构很类似穿孔腐蚀的情况,首先是均匀腐蚀,然后因氧浓淡电池会引起阳极反应(缺氧区)和阴极反应(富氧区),由于间隙内氧无法补充,因此阳极反应会继续在同一个位置进行,因此产生严重的腐蚀结果。
(4)晶间腐蚀:是在金属界处发生局部腐蚀的现象。就电化学的观点来看,由于材料的晶粒为阴极,而晶界一般为阳极,因此在均匀腐蚀的情况下,晶界处的腐蚀性仍稍大于晶粒处,如果在特殊情况下,材料的晶界抗蚀元素又相对减少,晶间腐蚀的现象就会发生。AL-CU-MG、AL-ZN-MG系铝合金有晶间腐蚀的倾向。
(5)应力腐蚀开裂(SCC):铝合金的SCC是在20世纪30年代初被发现的。金属在应力(拉应力或内应力)和腐蚀介质的联合作用下所发生的一种破坏,被称为SCC。SCC的特征是形成腐蚀一种机械裂缝,既可以沿着晶界发展,也可以穿过晶烂扩展。由于裂缝扩展是在金属内部,会使金属结构强度大大下降,严重时会发生突然破坏。材料受到局部应力或应力作用不平均时,受到高应力作用的区域会形成阳极,而受较低应力作用的区域则形成阴极,因此作用应力会使得腐蚀作用更为加速称谓为应呼电池。应力腐蚀发生在冷加工的材料时,高度冷加工的区域更具阳极性,另外在材料存在裂缝的情况下,也会造成应力腐蚀。
2、腐蚀的机理
所有的材料尤其是金属,都存在着腐蚀与防护的问题。钢铁的腐蚀原理与其它金属有许多共性,所以在讨论金属腐蚀原理及其防护时,往往以钢铁为主要研究对象。根据腐蚀因素、腐蚀环境和腐蚀表面状态、金属腐蚀的机理可以分为化学腐蚀,电化学腐蚀和多因素腐蚀。
(1)化学腐蚀:金属的化学腐蚀是金属在干燥气体(如氧、氯、硫化氢等)和非电解质溶液中进行化学反应的结果。化学反应引起引起腐蚀,在腐蚀过程中不产生电流。金属的化学腐蚀只在特定的情况下发生,不具普遍性。例如:金属的氧化M-O→MO。
(2)电化学腐蚀:金属的和介质发生电化学反应而引起的腐蚀,在腐蚀的过程中有阳极和阴极区,电流可以通过金属在一定的距离中流动,如金属在各种介质溶液(如海水、酸、碱、盐溶液、潮湿大气等)中的腐蚀。在一般情况下电化学腐蚀主要为微电池腐蚀和浓差电池腐蚀。
(3)化学或电化学加机械因素的腐蚀:这是多因素引起的腐蚀。由于各种因素的相互作用,往往产生非常激烈的腐蚀,一般包括应力腐蚀,腐蚀疲劳、空蚀腐蚀等。
电化学腐蚀是最重要的腐蚀因素,因为大多数的金属腐蚀的起因,都可说是一种电化学反应。这里所说的电化学反应是指在相同或不同金属物体中,由于各种因素使得某些部位产生了局部的阳极反应,让金属失去了一个或多个电子,变成金属阳离子,亦即发生阳极氧化作用;而在同时,另一地点也会产生阴极反应,获得多出的电子,使得阴极形成还原作用,而构成一个电池效应的现象。这种电池效应使得阳极金属造成消溶腐蚀,称之为电化学腐蚀。
两种不同金属就容易发生这种现象,这其中一种金属会较容易失去电子(阳极),而另一种金属则较容易获得电子(阴极),透过适当的通路,其结果是使得阳极金属陆续解离形成金属离子。这些金属离子,若不是被周围的电解质吸收,就是与非金属离子结合形成一层表面的沉积层,因此阳极金属逐渐失去(被腐蚀),反之,阴极金属则因此受到保护。
由此可知,电池效应发生的情况必须是,材料发生氧化电位(或还原电位)不同的两极,并且有适当介质的条件下,由于环境产生了足以形成电解池的条件下才足发发生。例如:两种不相似金属搭接在一起或金属两表面间有潮湿空气等。
不同的金属具有不同的电极电位(伽凡尼电位),所以当两种不同金属搭接在一起时,由于两者的电位差,就会产生电流,其原理正如水往低处流的情况一样。这种电池效应的结果,因电流的通过(从阳极流向阴极),使较高电位金属发后阳极消溶腐蚀。当电位差愈大,产生的电流愈强,腐蚀损耗率就愈大。
在电化学序位中,伽凡尼电位序位(CalVanic PotentialSeries)可以说明在不同环境下,各种金属阳极性或阴极性的趋势。在海水、淡水溶液或其他工业气氛中,伽凡尼电位序也可能会有差异,以海水中的伽凡尼电位序而言,依金属电位由大到小将金属顺序排列,依序为:钾(K)、钠(Na)、镁(Ma)、铝(Al)、锌(Zn)、镉(Cd)、铁(Fe)、钴(Co)、镍(Ni)、鍚(Sn)、铝(Pb)、铜(Gu)、银(Ag)、铂(Pt)、金(Au)。上述电位序中,电位序在前面的金属对电位序在其后的金属将形成阳极;相反的,电位序在后的金属对于电位序在前的金属成为阴极。这些金属例如:金、铂、银等具有化学惰性、而从另一方面来看由于电位序在前面的金属相对于电位序在其后的金属将形成阳极,由于腐蚀发生于阳极,因此就可以保护其后位金属避免腐蚀标准电极电位见表:
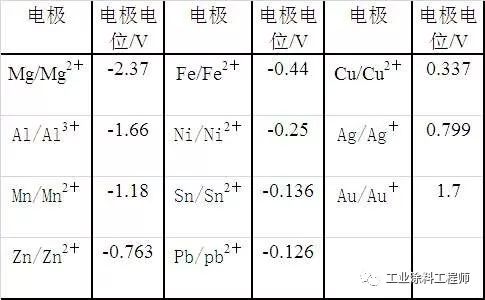
综上所述可以知道,电化学腐蚀主要由于材料本身产生了电池效应,电池效应是基于电池中有两种不同电极悬挂在一电解质内,阳极部分发生氧化作用而蚀去,阴极则大多产生氢离子的还原作用,而放出氢气,结果使材料形成腐蚀的现象。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62313558-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





