公路钢桥是目前现代社会应用广泛的桥梁之一,由于公路桥梁的受力状况和服役环境的不同,Q345q在国内应用极为广泛[1,2]。但是,钢铁材料在轧制过程中处于高温状态,暴露于空气中表面会形成一层氧化皮,氧化皮的组成和结构对钢材在贮存、运输和使用过程中的耐大气腐蚀性能起着重要作用[3,4]。因此,如何提高热轧带钢表面氧化皮的质量和耐大气腐蚀性能成为亟待解决的问题。
国内外研究者对氧化皮的结构及其腐蚀行为做了系统的研究。韩军科等[5]研究了耐候钢表面氧化皮结构及其对大气腐蚀行为的影响,发现相对于裸钢,氧化皮明显减缓了钢的初期腐蚀,氧化皮越致密,对基体的保护作用越强;但对于长期腐蚀而言,氧化皮的存在反而促进腐蚀,因为在腐蚀过程中,氧化皮表面逐渐生成锈层,部分未转化的氧化皮作为锈层中的杂质和缺陷加速钢的腐蚀。Dong等[6]研究了热轧带钢表面氧化皮在NaCl溶液中的电化学腐蚀行为,发现腐蚀初期氧化皮发生溶解被还原,导致电极活性和腐蚀速率增大,腐蚀后期有不溶性的腐蚀产物沉积于表面,导致电极电阻增大,从而减小腐蚀速率。Collazo等[7]研究了低碳钢表面氧化皮的电化学腐蚀行为,发现氧化皮的存在明显减小腐蚀速率。Chattopadhyay等[8]等通过拉曼光谱研究了热轧带钢的氧化皮组成结构,表明含有大量缺陷的氧化皮会加速腐蚀。张华民等[9,10]的研究工作表明,在含有Cl-的中性环境中,表面带有氧化皮会引起局部腐蚀,主要是因为Cl-的入侵破坏了氧化皮的完整性和致密性;并在稳态电位和静态挂片实验时发现,Cl-会在氧化皮缺陷处形成点蚀核,造成点蚀坑,导致碳钢与氧化皮之间形成电偶电池,从而在缺陷处产生严重的局部腐蚀。周贤良等[11]采用干湿周期浸润实验研究了不同氧化皮结构的510L热轧带钢在0.01 mol/L的NaHSO3溶液中腐蚀行为,表明在氧化皮连续致密的情况下,氧化皮越厚,对钢基体的耐蚀性影响越大。何爱花[12]对热轧钢板表面氧化膜对基体钢板腐蚀行为的影响进行了研究,表明氧化皮只起到物理屏蔽的作用,对金属的阳极反应和阴极反应不产生影响,只有在缺氧条件下氧化皮参与阴极还原过程,腐蚀性离子穿过氧化皮的孔隙导致基体溶解。
诸多工作表明,氧化皮的存在,对钢基体的腐蚀或多或少具有延缓作用。然而,对带氧化皮钢的腐蚀行为研究大多集中在Cl-等单一介质中,对热轧氧化皮的破坏机理、带氧化皮钢的腐蚀机理及锈层形成机理的研究更是鲜有报道,不能完全说明带氧化皮钢的腐蚀行为。钢服役过程中的腐蚀是在苛刻交替环境下发生的[13],我国西北地区桥梁钢的腐蚀主要受Cl-(冬季除雪剂)、SO2(工业大气)、湿度、温度等因素的影响,其干旱大气含盐环境独特[14]。因此,本论文选择除冰盐、NaHSO3、除冰盐+NaHSO3三种腐蚀介质模拟西北大气的几个典型腐蚀环境,着重研究了氧化皮在不同介质下的破坏机理和带氧化皮钢的腐蚀机理,有助于对热轧氧化皮钢腐蚀行为和机理的认识,希望从热轧源头改善氧化皮的保护性。
1 实验方法
1.1 实验材料
实验材料为某大型钢厂炼制的Q345q桥梁钢,经过控轧控冷后,轧制成8 mm厚的钢板,氧化后上下表面带有氧化皮。Q345q钢的化学成分见表1。

将上述钢板用线切割机切取以下两种规格:40 mm×40 mm×8 mm,数量9个,用于腐蚀增重测量和宏观腐蚀形貌观察;10 mm×10 mm×8 mm,3个用于氧化皮及锈层表面和截面微观腐蚀形貌的观察,3个用于XRD物相分析和电化学实验。切完试样后,保留40 mm×40 mm和10 mm×10 mm的工作面进行腐蚀实验,其余非工作面用环氧树脂包裹,待环氧树脂完全干燥后,将工作面先用丙酮除油,然后用无水乙醇和蒸馏水清洗用冷风吹干。
1.2 室内加速腐蚀实验
模拟西北大气几个典型腐蚀环境的腐蚀液为除冰盐溶液(根据GB19746-2005《金属和合金的腐蚀盐溶液周浸试验》配置,溶液pH=9±0.2)、0.01 mol/LNaHSO3溶液(根据TB/T2375-1993《铁路用耐候钢周期浸润腐蚀试验方法》配置,溶液pH=4.4±0.2)、除冰盐+0.01 mol/LNaHSO3溶液(溶液pH=4.8±0.2),所有成分如表2所示。本文通过干湿交替加速腐蚀实验模拟西北大气三个典型环境中的腐蚀过程,具体实验方法是:用分析天平称取初始质量(精度0.0001 g),每12 h在试样工作面滴加腐蚀液(一天两次),滴加的溶液量按40 μL/cm2计算,每2 d取出样品称重,取样时间:24、72、144、288、480 h,实验总共进行20 d。本实验在恒温恒湿试验箱中进行,温度30±2℃,相对湿度60±5RH。每次滴加溶液之前,用蒸馏水冲洗工作表面,避免盐分累积。每次称重前在真空干燥箱中进行干燥处理2 h,干燥温度50℃。
1.3 锈层物相与形貌观察
采用Rigaku Ultima IV X-射线衍射仪(XRD)对氧化皮原样及在三种介质中腐蚀不同时间的锈层进行分析,通过HighScore Plus3.0软件检索物相,每种物相的质量分数可以由各个物相的RIR(Reference intensity ratio)值确定,即采用参比强度法进行半定量分析。靶材为Cu靶,管电压为40 kV,扫描速率为4°/min,扫描范围为10°~80°。用数码相机和FEG-450冷场发射扫描电子显微镜(SEM)对氧化皮锈层表面宏观形貌、微观形貌及锈层截面形貌观察分析。
1.4 电化学实验
电化学实验采用的上海辰华CHI660e电化学工作站三电极系统,Pt电极为辅助电极,饱和甘汞电极(SCE)为参比电极,10 mm×10 mm试样的带锈面为工作电极,考虑到三种介质都含有SO32-离子,电解液采用0.1 mol/L的Na2SO4溶液,在恒温水浴锅中将温度维持在30±2℃。测量极化曲线的扫描速率为0.5 mV/s,测量范围为-1.5~1 V。
2 实验结果
2.1 带氧化皮试样的腐蚀动力学
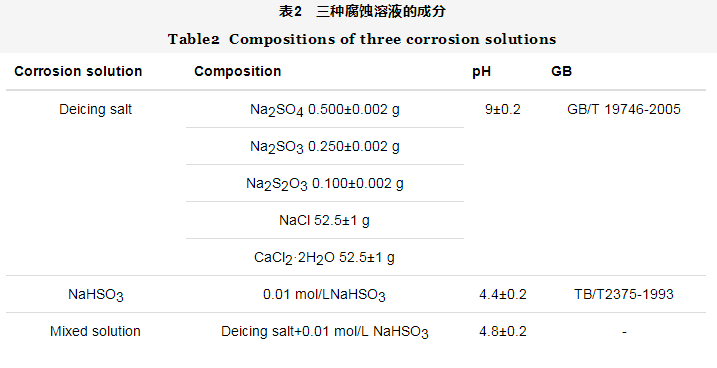
带氧化皮Q345q钢在模拟西北大气几个典型环境中的腐蚀动力学曲线如图1所示。图1a可见,在三种介质中的腐蚀增重都随时间的延长而增大,且增重大小顺序为:NaHSO3>混合溶液>除冰盐。图1b是腐蚀速率曲线,腐蚀初期,在除冰盐介质中的腐蚀速率最低,速率曲线几乎呈直线;在NaHSO3单独存在介质中的腐蚀速率明显大于在除冰盐介质中的。当NaHSO3+除冰盐同时存在时,腐蚀速率介于两者之间,这说明NaHSO3和除冰盐之间存在协同效应,但腐蚀速率并不是两者的简单加和。随着腐蚀时间进行至192 h,在除冰盐介质和NaHSO3+除冰盐介质中的腐蚀速率都呈现增大趋势,腐蚀介质对Q345q钢腐蚀速率的影响顺序为:NaHSO3>混合溶液>除冰盐。通常,钢的大气腐蚀规律符合幂函数规律[15,16,17]:
![]()
其中,ΔW为单位面积的腐蚀增重(mg·cm-2),t为腐蚀时间(h),A和n为与腐蚀特性有关的常数。n值的大小反映了腐蚀发展趋势,n>1,腐蚀过程加速,锈层不具保护性;n<1,腐蚀过程减速,锈层有保护性。有学者[18]提出了利用线性回归分析腐蚀数据的方法,通过取对数在腐蚀失重-腐蚀时间曲线上得到直线,这种方法不仅可以有效地研究腐蚀规律,而且对动力学的深入研究非常重要,因此(1)式写成对数的形式为:
![]()
为了验证钢在三种介质中的腐蚀动力学发展规律,利用该函数对腐蚀增重数据进行拟合,拟合结果如图2所示。从图中可看出,腐蚀过程被分为了两个阶段。在除冰盐介质中192 h以下,腐蚀处于“潜伏期”,腐蚀增重几乎没有变化,n<1说明腐蚀速率减缓,氧化皮对基体有一定的保护作用;192 h后腐蚀速率快速呈指数规律增大,表现为n值大于1,可能是因为氧化皮被破坏;在NaHSO3溶液中,48 h已发生腐蚀,在48 h~96 h之间时n<1,腐蚀速率有所降低;96 h后腐蚀速率呈线性规律增大,其可能原因为氧化皮逐渐被溶解。在除冰盐+NaHSO3溶液中,在48 h~144 h之间的n=0.9343<1,腐蚀速率几乎不变;144 h后腐蚀速率缓慢增大,且n值介于在两种单相介质中的之间,说明除冰盐和NaHSO3存在协同作用。
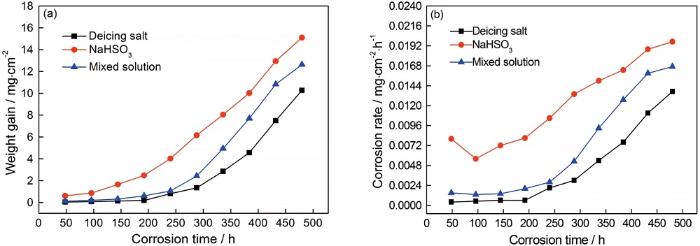
图1 带氧化皮Q345q钢在三种不同溶液中的腐蚀动力学曲线
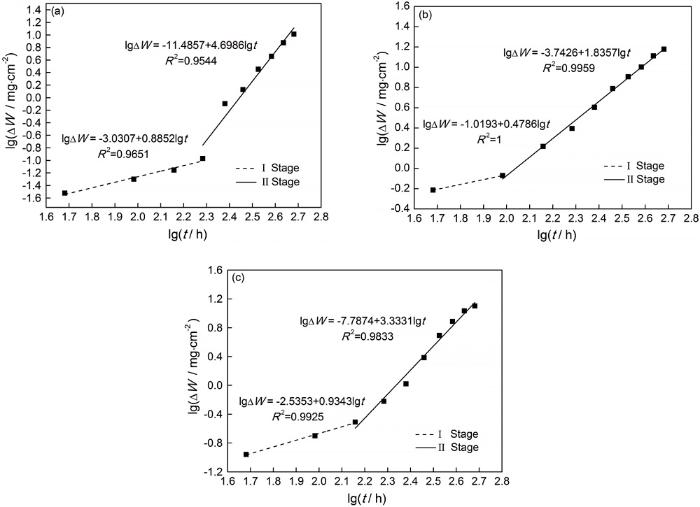
图2 腐蚀动力学双对数拟合曲线
2.2 氧化皮及锈层物相分析
图3为带氧化皮Q345q钢原始样及在三种西北典型大气环境模拟液中腐蚀不同时间的锈层XRD谱图。由图3a可知,Q345q钢经1069℃和776℃的开轧温度和终轧温度热轧后氧化皮的物相组成主要是Fe2O3和Fe3O4。
由图3b看出,在除冰盐介质中的腐蚀产物主要由β-FeOOH、γ-FeOOH、α-FeOOH、Fe2O3、Fe3O4、氯化物组成。从特征峰的强度看,β-FeOOH的物相峰(11.84°)随腐蚀时间的延长而增强,同时叠加了氯化物的峰,此氯化物为HFeCl4(H2O)6(JCPDS 78-1929),它是一种中间化合物,在干的阶段发生氯化物→β-FeOOH物相转变[19],它的特征峰强度(30.82°)有所减小,说明部分氯化物在整个过程中发生了转化;γ-FeOOH的特征峰(14.14°)在72 h后,随腐蚀时间的延长增加较少;α-FeOOH的特征峰(21.22°)在整个腐蚀过程中变化不明显,甚至在480 h后峰强仍然较低,说明只有少量γ-FeOOH和β-FeOOH转化成了α-FeOOH;Fe2O3(33.18°)和Fe3O4(35.43°)的特征峰随时间的延长逐渐减小,说明部分氧化皮发生了溶解或脱落。
由图3c可看出,NaHSO3溶液中的腐蚀产物主要由γ-FeOOH、α-FeOOH、Fe2O3、Fe3O4组成。γ-FeOOH(14.14°)和α-FeOOH(21.22°)的峰强随时间的延长增大,说明整个过程中发生了γ-FeOOH→α-FeOOH的转化,但转化不完全;Fe2O3(33.18°)和Fe3O4(35.43°)的特征峰强在24 h~144 h之间变化很小,直至288 h后强度逐渐减小,这说明在干湿循环的湿的阶段发生了γ-FeOOH的还原生成了Fe3O4[20],补偿了腐蚀前期部分脱落或溶解的氧化皮,腐蚀后期氧化皮的断裂强度已不能抵抗锈层内腐蚀应力发生了破裂和溶解。
图3 氧化皮原始样及带氧化皮试样在三种溶液中腐蚀不同时间的XRD谱图
由图3d看出,在除冰盐+ NaHSO3介质中的腐蚀产物的种类与除冰盐介质中的一致,但是Fe2O3(33.18°)和Fe3O4(35.43°)的特征峰强明显减小,说明Cl-和HSO3-之间存在协同效应加速了氧化皮的溶解:Fe3O4+8H++2e-→3Fe2++4H2O;氯化物HFeCl4(H2O)6(30.82°)的峰强先增大后减小,β-FeOOH的主峰上也叠加了此氯化物的峰,说明氯化物发生了不完全转化;γ-FeOOH和α-FeOOH的峰强与除冰盐介质中的变化一致。
表3为三种介质中腐蚀480 h的锈层物相的相对含量及α/γ*的值,用α/γ*来评价锈层的保护性[21,22,23],α/γ*表示α/(γ+β+Mgn),α、γ、β、Mgn分别为α-FeOOH、γ-FeOOH、β-FeOOH、Fe3O4。通过比较得出,腐蚀后期,在NaHSO3溶液中的锈层保护性高于在其他两种介质中的,当除冰盐溶液中加入NaHSO3溶液后,锈层保护性略好于除冰盐中的。
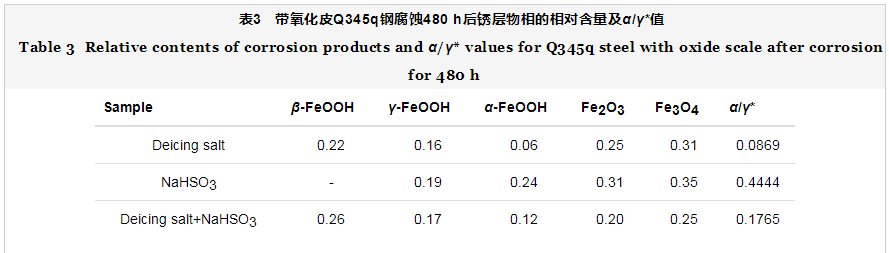
2.3 宏观腐蚀形貌
图4为带氧化皮试样在3种溶液中腐蚀不同时间的宏观形貌图。腐蚀初期(24 h),在除冰盐和混合介质中基本未腐蚀,而在NaHSO3溶液中已发生局部腐蚀。随着腐蚀时间进行至192 h,各组试样腐蚀加剧,在除冰盐介质中发生明显的局部腐蚀,局部氧化皮被破坏出现点蚀坑,混合溶液中既有局部点蚀坑,又伴随全面腐蚀,这是因为腐蚀性离子侵入氧化皮的缺陷处,使得氧化皮-基体之间形成电偶电池[24],加速基体腐蚀,但仍然有裸露氧化皮未被腐蚀;NaHSO3溶液中表现为全面腐蚀,锈层覆盖不均匀,边部出现橙红色的锈层。腐蚀中期(288 h),除冰盐溶液中点蚀坑增多,NaHSO3溶液中锈层覆盖逐渐均匀,混合溶液中的局部腐蚀逐渐转化为全面腐蚀。腐蚀后期(480 h),带氧化皮试样在NaHSO3溶液中被锈层均匀覆盖,表面局部出现鼓泡现象,这说明锈层内应力集中于该区域,锈层的断裂强度已不能承受内应力致使小部分鼓泡脱落,脱落的地方呈现红褐色。但是,在除冰盐溶液中仍然表现为局部腐蚀,说明氧化皮的致密处难以形成电偶电池;在混合溶液中,锈层结合了两种单相介质中的锈层颜色呈现黑褐色,锈层凹凸不平,疏松易脱落。
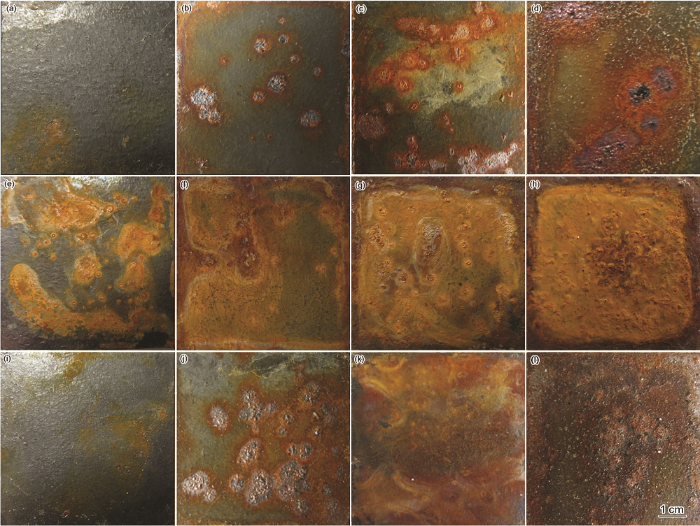
图4 带氧化皮Q345q钢在3种溶液中腐蚀不同时间的宏观形貌
综上所述,在除冰盐溶液和混合溶液中腐蚀192 h出现点蚀坑,腐蚀逐渐加剧,符合动力学曲线得到的规律,整个过程中除冰盐溶液中发生以点蚀为主的局部腐蚀,混合溶液中发生点蚀+全面腐蚀,而NaHSO3溶液中以全面腐蚀为主。
2.4 表面微观形貌分析
2.4.1 带氧化皮原始样表面及截面形貌
图5是带氧化皮原始样的微观形貌和截面形貌。由图可知,氧化皮形貌呈多孔状,而且多孔状结构不完整;截面形貌来看,氧化皮厚度不均匀,内部存在横向裂纹。

图5 带氧化皮Q345q钢的表面形貌和截面形貌
2.4.2 带氧化皮试样在不同介质中的微观腐蚀形貌
图6给出了带氧化皮试样在3种介质中腐蚀不同时间的微观形貌。由图可见,腐蚀初期(24 h),除冰盐和混合介质中氧化皮表面粗糙,局部存在鼓泡,且含有细小裂纹;NaHSO3介质中的锈层表面存在较大鼓泡且发生破裂,表面覆盖少量“花状”或“针叶状”的腐蚀产物γ-FeOOH[25,26],锈层中存在裂纹。腐蚀进行至192 h,在除冰盐和除冰盐+NaHSO3介质中,鼓泡局部发生破裂并出现点蚀坑,但是混合介质中的点蚀坑区域较大,这是因为发生点蚀的同时伴随全面腐蚀,在点蚀坑局部放大图(图6b和图6h右上图)上可看到“团簇状”的腐蚀产物,此腐蚀产物为β-FeOOH[26],由氯化物转化而来且稳定性最低;在NaHSO3介质中,“花状”腐蚀产物逐渐增多,大量鼓泡破裂致使锈层表面凹凸不平产生较大裂纹,这是由鼓泡的内应力大于氧化皮的强度引起的,局部锈层显得疏松多孔。腐蚀中期(288 h),除冰盐介质中的点蚀坑发生扩展,仍有未被破坏的氧化皮;NaHSO3介质中的“花状”腐蚀产物逐渐长大形成“枝状”,同时分布少量的颗粒状腐蚀产物α-FeOOH [25,27];混合介质中的“团簇状”腐蚀产物形核长大,点蚀的作用已将点蚀坑周围的氧化皮拱起。
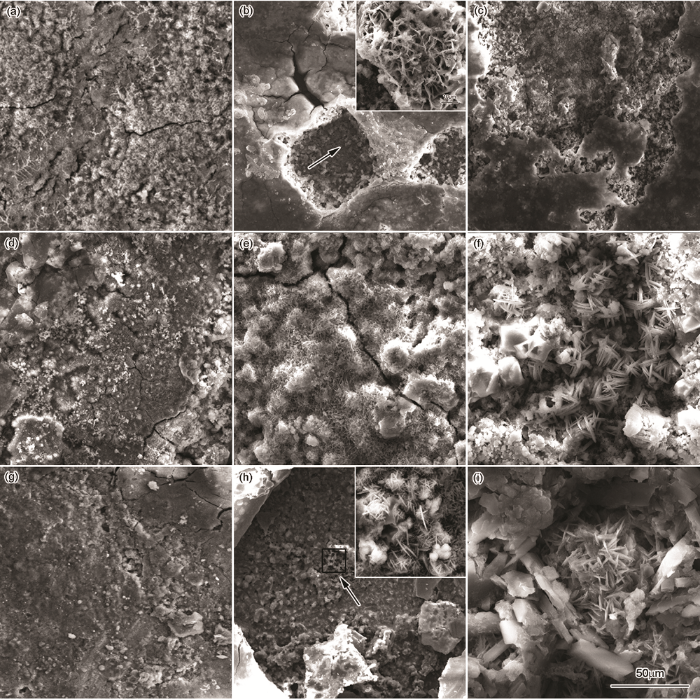
图6 带氧化皮Q345q钢在3种溶液中腐蚀不同时间的微观形貌
腐蚀480 h的锈层形貌如图7所示。除冰盐溶液中,“团絮状”的腐蚀产物在氧化皮脱落的地方聚集长大,并与氧化皮结合在一起,但与基体的黏着性不强,氧化皮和锈层均易脱落;在NaHSO3溶液中,“针状”腐蚀产物转化为细小颗粒状的腐蚀产物,锈层结构得到改善且致密性增加;在除冰盐+NaHSO3溶液中,“团絮状”锈层扩展分布,疏松易脱落。因此,在NaHSO3溶液中以全面腐蚀形成的锈层颗粒具有一定的保护性。

图7 带氧化皮Q345q钢在3种溶液中腐蚀480 h的微观形貌
2.4.3 锈层截面形貌分析
图8是带氧化皮钢样在3种溶液中腐蚀不同时间的截面形貌。从全貌来看,随着腐蚀时间的延长,锈层厚度有所增加。腐蚀初期(24 h),在除冰盐和混合溶液中,氧化皮表面基本未发生腐蚀,内层比外层致密;而在NaHSO3溶液中氧化皮表面覆盖一层不均匀的锈层。随着腐蚀进行至192 h,除冰盐和混合溶液中出现较深的裂纹,氧化皮变得粗糙,在局部放大图上(图9a和9c)看到局部锈层较深,甚至穿透氧化皮腐蚀到钢基体,这是因为在该部位发生了明显的点蚀,使得局部锈层深度较大,对比发现混合溶液中的点蚀深度更明显(图9c);在NaHSO3溶液中锈层逐渐覆盖氧化皮表面,氧化皮变得疏松不平整。腐蚀中期(288 h),除冰盐溶液中的点蚀区域增大,在图9b所示的局部放大图上看到钢基体处形成一层疏松的内锈层,同时部分锈层深入到未破坏的氧化皮中间,产生的内应力将氧化皮隆起;在NaHSO3溶液中,锈层几乎覆盖了整个氧化皮表面,并与基体紧密结合;在除冰盐+NaHSO3溶液中,点蚀部位腐蚀深度到达钢基体,同时伴随着全面腐蚀,在局部放大图上(图9d)仍可以看到未破坏的氧化皮。

图8 带氧化皮Q345q钢在3种溶液中腐蚀不同时间的截面形貌

图9 带氧化皮Q345q钢在除冰盐和混合溶液中腐蚀不同时间的截面局部放大形貌
在3种介质中腐蚀480 h的截面形貌如图10所示,除冰盐介质中由于Cl-的点蚀作用,致使锈层疏松多孔,与基体的粘着力差;NaHSO3溶液中的锈层逐渐变得致密,与基体紧密结合;而在除冰盐+NaHSO3介质中,虽然锈层较厚,但是内部存在横向裂纹和不完整的氧化皮,与基体结合处的内锈层致密性得到改善。
2.5 电化学分析
图11是带氧化皮钢在三种溶液中腐蚀不同时间后的极化曲线,其相应的电化学参数如表4所示。由图11可知,无论带氧化皮钢样表面是否有锈,其腐蚀过程同时受阳极和阴极反应控制,阴极过程表现为氧溶解极限扩散控制和腐蚀产物还原的电化学控制[28]。但是随着腐蚀时间的延长,氧极限扩散控制逐渐变为电化学活化控制,而阳极过程主要是电荷转移控制的电化学溶解。
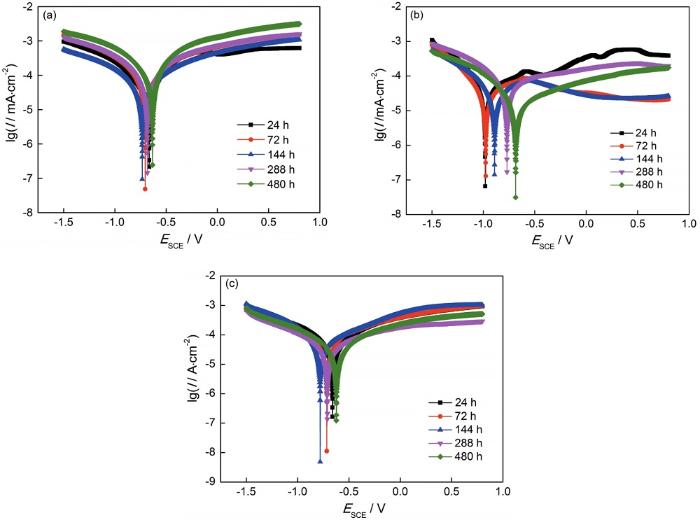
图11 带氧化皮Q345q钢在三种溶液中腐蚀不同时间后的极化曲线
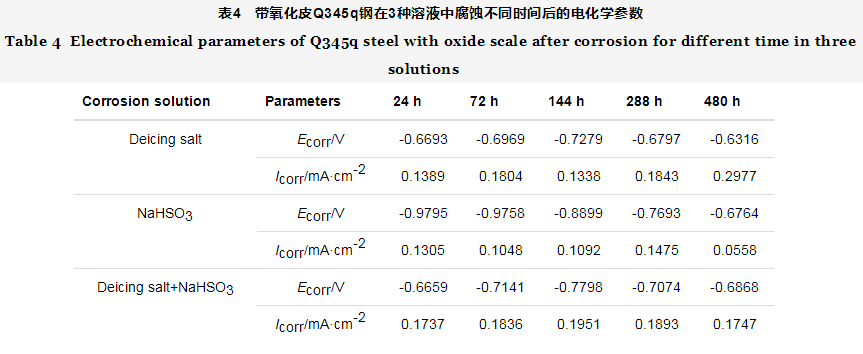
图11a显示,在除冰盐介质中自腐蚀电位随时间的延长先减小(24~144 h)后增大(144~480 h),说明发生腐蚀的倾向性先增大后减小,主要是因为盐离子侵入氧化皮表面缺陷处加速了腐蚀,后期的腐蚀过程中表面有腐蚀产物的累积,在一定程度上减缓了腐蚀。24~144 h阴极电流密度减小是因为在192 h之前带氧化皮钢腐蚀处于“潜伏期”(图1),表面含有大量未破坏的氧化皮,同时还覆盖少量的锈层和大量的腐蚀薄膜,阴极过程受到了一定的阻碍。在144~480 h腐蚀过程中,阳极电流密度增大,说明小阳极过程加快;阴极电流密度也增大,其主要原因是大阴极发生腐蚀产物的还原,同时腐蚀膜和不稳定锈层的脱落,加快了阴极过程。
观察图11b发现,在NaHSO3溶液中,自腐蚀电位随时间的延长而明显增大,表明锈层的耐蚀性随时间的延长有所提高,腐蚀初期(24~72 h),阴极Tafel曲线的斜率较大,主要以极限扩散为控制步骤;在144~480 h的腐蚀过程中氧极限扩散控制逐渐消失,阴极Tafel曲线的斜率减小,阴极过程主要是以γ-FeOOH还原为主的电荷传递控制,阴极电流密度增大,阴极过程加速;在72~144 h发生了钝化,是因为锈层在氧化皮表面覆盖抑制了阳极溶解过程;在144~480 h之间阳极电流密度先增大后减小,其原因是氧化皮破坏程度增大,钝化膜逐渐遭到了破坏,致使钢基体发生溶解,直到480 h生成了一层较厚的锈层,阳极电流密度降低。
从图11c看到,在除冰盐+NaHSO3溶液中,带锈试样的自腐蚀电位的变化与在除冰盐中的一致,但腐蚀时间对阴极腐蚀行为影响不大,而阳极电流密度减小说明锈层逐渐覆盖,阳极过程受阻。
从表4给出的极化曲线参数可知,除冰盐介质中锈层的自腐蚀电流密度先减小(24~144 h)后增大(144~480 h),说明192 h前腐蚀增重几乎不变,腐蚀速率减小,随着氧化皮的破坏和钢基体的腐蚀,腐蚀速率逐渐增大,与动力学规律吻合。在NaHSO3溶液中,自腐蚀电流密度在24~72 h减小,说明腐蚀速率减小;在72~288 h之间增大,腐蚀速率增大,这是因为氧化皮溶解过程加快;在480 h时又达到最小值,腐蚀速率减小,这是由基体被一层较厚的锈层覆盖所导致。在除冰盐+ NaHSO3溶液中,自腐蚀电流密度先增大后减小,相比较于除冰盐溶液,腐蚀速率在24~288 h增大,随着点蚀+全面腐蚀的同时进行,钢表面被腐蚀产物覆盖,腐蚀速率在480 h有所减小。因此,根据带氧化皮带锈钢的自腐蚀电流密度的变化可以判断腐蚀速率的变化,结果与动力学曲线相吻合。
本实验所用的Q345q钢,采用控轧控冷技术(TMCP),其表面形成了Fe2O3、Fe3O4两层结构的氧化皮,在轧制和控制冷却速度的过程中往往会产生缺陷,氧化皮在腐蚀环境中不稳定,在缺陷处优先发生局部腐蚀,氧化皮的致密处虽然在腐蚀初期有阻碍作用,但随着腐蚀的进行氧化皮会逐渐转化或溶解,转化不完整的氧化皮将会破坏锈层的稳定性。在不同的腐蚀环境下,氧化皮的腐蚀行为亦不同。因此,研究氧化皮在不同环境下的破坏机理和腐蚀机理很有必要。



锈层中Fe2+继续与γ-FeOOH反应生成Fe3O4,这样生成的Fe3O4补偿了溶解的氧化皮,在腐蚀初期和中期Fe3O4的峰强很少变化。当γ-FeOOH大部分转化为α-FeOOH时,γ-FeOOH不足以补偿Fe3O4的生成,使得在腐蚀后期Fe2O3和Fe3O4的含量降低,α-FeOOH含量增多,锈层的保护性有所增强。
在除冰盐+NaHSO3溶液中,NaHSO3溶液的加入使溶液的pH显酸性,氧化皮表面的Fe(OH)2、Fe(OH)3、Ca(OH)2、Fes[Fe(OH)2]被H+溶解生成相应的阳离子,大量的阳离子聚集在一起增大了溶液的导电性,阳离子移动的范围增大,不但发生Cl-为主的点蚀作用,而且还有大面积的全面腐蚀,故腐蚀速率比除冰盐单一介质的大,说明Cl-与HSO3-存在协同效应,加速了氧化皮的破坏和溶解。但是,Cl-的自催化效应没有完全消除,在整个腐蚀过程中产生中间腐蚀产物HFeCl4(H2O)6和β-FeOOH。研究表明[35],呈酸性的介质有利于β-FeOOH转化为α-FeOOH和Fe3O4,因此腐蚀后期生成的α-FeOOH是由两部分构成,加上氯化物和不稳定的β-FeOOH使锈层变得疏松,其锈层保护性介于在两种单相介质中的。
4 结论
(1) 带氧化皮Q345q钢在三种模拟西北典型大气环境中的腐蚀速率大小顺序为:NaHSO3>除冰盐+NaHSO3>除冰盐。在432 h后,在NaHSO3和混合介质中速率增大逐渐减缓。但是,在192 h以下,除冰盐和混合介质的n<1,说明氧化皮对基体具有一定的保护作用,除冰盐介质中主要以“大阴极小阳极”的点蚀为主,混合介质中以点蚀和全面腐蚀为主。当腐蚀时间大于192 h,除冰盐和混合介质的n>1,说明氧化皮逐渐遭到破坏,锈层不具保护性。而在NaHSO3介质中,从整体来看主要以全面腐蚀为主,92 h后虽然n值大于1,但小于其它两种介质中的,其锈层保护性较强。
(2) 在除冰盐和除冰盐+NaHSO3溶液中,腐蚀产物主要是β-FeOOH、γ-FeOOH、HFeCl4(H2O)6、Fe2O3、Fe3O4以及少量的α-FeOOH,NaHSO3溶液中的腐蚀产物主要是α-FeOOH、γ-FeOOH、Fe2O3、Fe3O4。Cl-与HSO3-的协同作用加速了氧化皮的溶解和破坏,不稳定的β-FeOOH和氯化物致使锈层致密性下降。
(3) 氧化皮/锈层的自腐蚀电流密度的变化反应腐蚀速率的变化。除冰盐溶液的锈层腐蚀电流密度先减小(24~144 h)后增大(144~288 h);NaHSO3溶液的锈层腐蚀电流密度在72 h后增大,480 h时达到最小值;除冰盐+NaHSO3溶液的锈层腐蚀电流密度先增大(24~288 h),480 h时有所减小。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62313558-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





