1. 摘要:
腐蚀电化学研究近些年进展相对较为缓慢。现有研究更多的是把腐蚀电化学作为腐蚀金属或涂层在典型环境中腐蚀失效过程的评价工具,关注一些唯象参数,如自腐蚀电流、极化电阻、电荷转移电阻和噪声电阻等,鲜有从电化学反应本身出发,深入研究腐蚀金属电极电化学反应动力学的报道,导致的后果是对腐蚀电化学反应难以深入认识,对电化学测试结果的分析容易流于形式。
腐蚀电化学反应本质是多反应耦合(包括至少两个电化学反应,以及后续化学反应)的非平衡反应,是电化学研究领域的难点,对腐蚀电化学反应历程和动力学的深入研究有助于明确反应机制、认识腐蚀机理和发展非平衡电化学,具有重要的科学意义。本报告从腐蚀电化学基本方程出发,明确基于混合电位理论的腐蚀动力学方程处理存在的若干简化,及其合理性,结合现代电化学发展,创新性地提出应用扫描电化学显微镜腐蚀金属电极探针产生 - 基底收集模式,定量分离全极化范围下(线性极化区、弱极化区和塔菲尔区)典型腐蚀金属电极的表观电流,明确阴阳极各自反应的准确电流,结合电荷转移和传质定律基础方程,建立 COMSOL 空间模型,解析获得精确的反应动力学参数。通过对典型腐蚀金属电极腐蚀电化学反应历程和动力学参数的确定,重新审视经典电化学阻抗谱、极化曲线和电化学噪声方法与数据,并指出其合理性与应用范围,最终发展非平衡电化学。
关键词:腐蚀电化学;非平衡;多反应耦合;动力学
2. 研究背景
对于多数金属腐蚀过程,腐蚀电化学反应是腐蚀过程中最重要,也是最为复杂的化学反应[1] 。腐蚀研究从早期的形貌观察、失(增)重法,逐渐演化用电化学方法监测腐蚀过程,明确腐蚀机制。对于腐蚀反应而言,因非平衡和多反应耦合特征,很多电化学技术应用受限,在腐蚀中最重要也是被广泛使用的技术通常有两种:极化曲线和电化学阻抗谱。而电化学噪声技术因数据解析困难,与腐蚀反应之间的物理化学图像建立困难而应用受限。实际上,极化曲线和电化学阻抗谱在腐蚀体系的数据重复性欠佳[2] ,解析获得的参数,如极化电阻(R p )和电荷转移电阻(R ct )等,与腐蚀电化学反应本征参数缺乏直接的联系。腐蚀电化学反应通常为氧化性物种(如 O 2 ,H + )被还原和金属被氧化形成离子过程,即:
阴极反应:O+ne - =R,阳极反应:M-ne - =M n+
对于阴极反应和阳极反应,我们先假设是基元电化学反应,则各自反应的Bulter-Volmer 表达式为[ 3] 。
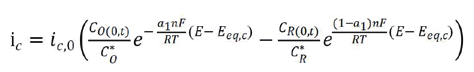 (1)
(1)
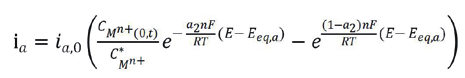 (2)
(2)
式中:下标中 a 和 c 代表阳极反应和阴极反应,下标 eq 代表平衡,O 表示氧化性物种,R 表示还原性物种,C (0,t) 表示 t 时刻表面浓度,上标 * 表示本体,i c,0 和 i a,0 分别为阴极反应和阳极反应的交换电流密度。显然,这两个独立的电流表达式表明各自反应的物种浓度及其空间分布对电流大小有显著影响。
对于腐蚀研究,对公式 1 和 2 做了如下重要假设:(1)腐蚀电极的自腐蚀电位与阴阳极反应的各自平衡电位差值较大,可以分别忽略阴极反应的阳极分支和阳极反应的阴极分支;(2)表面浓度与本体浓度近似相等,前提是动力学速率小且电位偏离各自平衡电位较小。此时,对于腐蚀发生的阴阳极反应分别简化为:
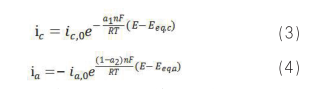
根据 i corr 和 E corr 的物理意义,可知:
![]() (5)
(5)
则腐蚀电极的表观电流与电位的关系为:
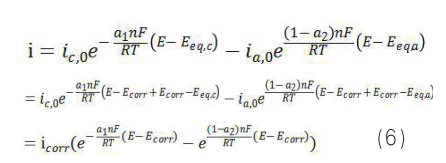


对于阳极反应的式 4,因为就是金属自身的溶解,一般不认为存在扩散控制。通过此时的处理,不能获得式 6 或者式 7 的腐蚀方程,i corr 和 E corr 的数值一般通过图解法获得[1] 。但是这个推导过程隐含了一个重要假设:即扩散层厚度一定,且浓度变化为线性关系。实际上扩散层内厚度与测试时间有关,且浓度区间也非简单线性,因此极限扩散电流也不是一定值。腐蚀研究一般通过电极电位与腐蚀电位的偏离程度来判断是否是扩散控制,实际上需要考虑动力学因素。
对 O+ne - =R 的电化学反应,其电化学动力学基本方程应该具有如下基本形式:
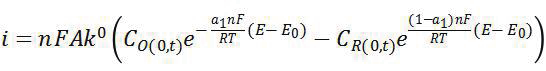
该式表明电化学反应的动力学基本参数是且仅是 k 0 ,a 和 E 0 ,不是 i 0 或者i corr (这两个参数实际上包含物种浓度信息)。而在溶液中的传质过程,在忽略电迁移和强制对流的前提下,可用 Fick第一和第二定律描述,即表明浓度梯度需要考虑,扩散系数是重要的参数。对于腐蚀而言,腐蚀电化学需要确定的参数应该是阴极反应和阳极反应各自的标准速率常数 k 0 ,传递系数 a 和标准电极电位 E 0 ,而不是简单默认 a 为 0.5,且用 i corr 作为腐蚀动力学参数。推导过程已经表明 i corr 与各自阴阳极反应的交换电流、反应物种的浓度梯度、传递系数、各自的平衡电位以及自腐蚀电位等有关。腐蚀电化学的核心基础方程对于深入认识腐蚀电化学行为特征具有重要作用,但是腐蚀电化学发展至今,需要再次审视腐蚀基本方程,并对其内在科学问题进一步深入研究,特别是有关腐蚀电化学反应机制及其动力学的研究。
3. 腐蚀电化学动力学研究现状
国内外有关腐蚀反应动力学的研究多集中于腐蚀速率演化,以及环境因素的影响,对于普遍应用的极化曲线[5.6.7.8.9.10.11.12] 、电化学阻抗谱[9,10,12,13.14.15,]和电化学噪声[15,16.17]等电化学技术中,更多的关注一些唯象参数,如极化曲线中的自腐蚀电位、自腐蚀电流、阴阳极 Tafel 斜率、临界点蚀温度等;电化学阻抗谱中的电荷转移电阻、膜电阻和双电层电容等,而电化学噪声技术则集中在时频转换分析,包括噪声电阻、离散小波变换、快速傅里叶变换等。我们课题组在浙江大学期间也开展了大量有关极化曲线、电化学阻抗谱和电化学噪声在腐蚀中的应用研究,如应用极化曲线和电化学阻抗谱评价稀土合金化镁合金[18.19] ,镁合金表面 Cu/Ni-P镀层[20]和稀土转化膜 + 微弧氧化膜[21]耐蚀性能及其随时间演化等。而对于电化学噪声,课题组自 2006 年发展小波变换时频分析技术区分局部类型与强度[22] ,2012 年应用散粒噪声理论研究锌合金在干湿循环下腐蚀行为[23] ,然后于2013 年提出基于混沌理论量化亚稳态孔蚀的特征参数最大 Lyapunov 指数[24] 。国外 McCafferty 于 2005 年的工作[25]阐述了极化曲线外推法在三种典型腐蚀体系(Fe 在盐酸、氯化钠溶液和 Ti 在沸腾硫酸溶液)获得腐蚀速率的可靠性问题,并与其它技术互为验证,提出了使用极化曲线外推法需要注意的内容,包括活化控制、反应可知、Tafel 区显著和均匀腐蚀等,但是实际上很多腐蚀体系或多或少不能满足其中一条或多条,如不是活化控制,局部腐蚀等。对于具有氧化膜的钛合金,Leygraf 报道了应用电化学阻抗谱研究钝化膜的稳定性,以及应用膜层分层结构(外层疏松和内层阻挡层)解释电化学阻抗谱图中的时间常数现象[26] ,Rajendran 也有类似工作 [27] 。Jiang 则考察极化曲线扫描速率对钛合金自腐蚀电流判定的影响,并认为充放电电流导致了显著的自腐蚀电流的偏差[28] ,而实际上,如果认可双电层电容是固定值,则充放电电流仅是扫描速率的函数。扫描速率影响的偏差核心仍是对钛合金表面状态的改变继而对反应动力学的影响。这些工作仍是局限于腐蚀表观参数,关注耐蚀性能的演化,并未从腐蚀电化学反应出发,深入研究反应动力学。
对于腐蚀研究,极化曲线通常容易存在 Tafel 区不明显,特别是阳极 Tafel分支,对于局部腐蚀严重金属材料或者涂层体系,极化曲线重复性较差[2] 。电化学阻抗谱在腐蚀体系的理论与应用最大进展仍是由曹楚南先生提出的基于状态变量原理的数学模型[29] , 并系统研究了典型腐蚀体系的电化学阻抗谱行为[30,31] 。曹先生基于电化学反应的数学模型有效克服了等效电路(仍是目前应用最广泛的电化学阻抗谱分析方法)的诸多不足,如时间常数的归属,感抗的解释与意义等,但是数学模型的建立与数据分析比较困难,导致数学模型的应用比较受限。电化学噪声技术的发展更多的是体现在在线监测方面,特别是现场腐蚀监测,作为基础研究,其最大的不足应该是各种特征参数,如噪声电阻、傅里叶变换结果功率谱密度(Powerspectral density)和小波变换结果能量分布谱图(Energy distributionplot)等,与腐蚀行为或者腐蚀动力学之间的相关性相对较弱[32,33] ,数据挖掘与解释陷入一定程度的困境。现在的腐蚀电化学更多的是作为一种腐蚀评价技术,关注腐蚀速率(Corrosion rate)或耐蚀性能(Corrosion resistance),鲜有从电化学反应本身出发探究腐蚀电化学反应动力学。
Kolotyrkin 早在上世纪六十年代就开始应用极化曲线技术评价阴离子对金属阳极溶解行为的影响[34.35] ,但是经典工作仍要到 1986 年,由 Bockris(国际著名电化学专家,著有《量子电化学》)报道的,利用旋转环盘电极,结合极化曲线,研究中性溶液中铁电极氧气还原的途径及其速率决定步骤,并比较裸铁(bare iron)和钝化铁(passive iron)表面氧还原的区别,探讨过氧化氢(H 2 O 2 )作为中间物种的反应途径,并最终提出一个包含化学吸附为速率决定步骤的氧还原路径[36] 。Bockris 的工作并没有详细阐述极化电流曲线中是否涉及 Fe 氧化的电流,也受限于旋转环盘电极结构导致的收集效率较低问题,以及并没有报道准确的动力学速率常数等,而是用多步反应的 Tafel 斜率替代。国内董俊华研究员应用稳态极化曲线和电化学阻抗谱研究硫脲对铁的缓蚀作用,并结合Tafel 斜率分析获得电化学参数[37] 。吴维?研究员结合 pH 影响腐蚀电位与腐蚀电流数据,并根据腐蚀反应方程推导了 A3 钢在乙酸中可能的腐蚀机理[38] 。这些工作非常具有代表性,但受限于实验条件与技术发展水平,具体的动力学参数很难在当时的环境下解析获得,所以后续工作也受到限制。
4. 课题组工作
现代电化学发展已经进入分子 / 原子阶段,原位微区技术不断出现与更新[39,40,41] 。如何结合现代电化学发展,从电化学反应出发,深入认识腐蚀反应动力学特征及其参数的准确表征,仍是具有重要意义的研究工作,也相对于传统腐蚀电化学研究方法,提供了认识反应机制的新可能。腐蚀电化学反应定量研究的首要前提是多耦合反应的定量分离,特别是在线性极化区和弱极化区的分离,因为通常电位扫描腐蚀电极获得的电流是表观电流,包含多个反应的电流叠加,其次是解析 Bulter-Volmer 和传质动力学方程。
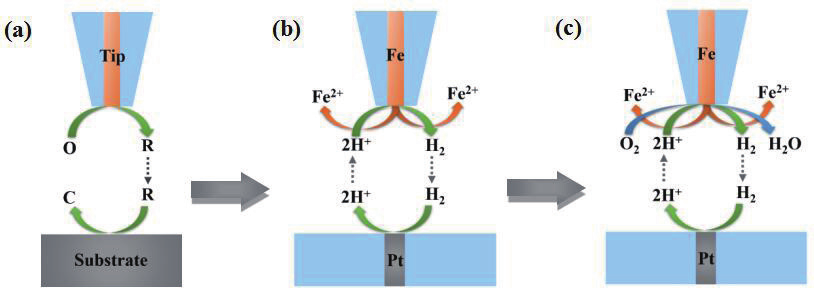
图1. SECM的TG/SC模式用于Fe腐蚀反应分离的示意图,其中(a)传统TG/SC模式;(b)改进后的TG/SC模式用于
除氧溶液中Fe腐蚀反应分离;(c)改进后TG/SC模式用于含氧溶液中腐蚀反应分离。
在传统 TG/SC 模式中(图 1a),探针在某一电位下发生O+ne - →R反应,控制基底电位将产生的 R 收集,并重新生成 O,然后扩散至探针电极上形成正反馈效应。图 1b 是改进后的产生 - 收集模式用于除氧酸性溶液中 Fe 腐蚀耦合反应的分离,在 Fe 电极表面发生腐蚀时有两个反应同时进行,即 2H + +2e -→ H 2 和 Fe → Fe 2+ +2e - ,因此测量得到的表观电流中包含 Fe 氧化和质子还原电流,通过设置Pt基底电极电位为某一值,使其表面只发生氢气氧化反应,则基底上 H 2 氧化电流与探针 H + 还原电流大小相等,从而实现 Fe 探针电极上两个反应分离。图 1c 是溶液中含氧条件下(自然状态)Fe 电极表面发生的腐蚀,此时除了 Fe 氧化和质子还原外还包含氧气还原过程:O 2 +4e - +4H + → 2H 2 O,同图2b 一样 Pt 基底电极上也只收集探针产生的 H 2 ,再结合除氧溶液中分离得到的Fe 氧化电流,可进一步将自然条件下 Fe腐蚀时表面上发生的三个电化学反应分离。

图2. 典型(a)Fe探针超微电极(b)Pt基底超微电极的扫描电镜图
图 2 为 Fe 探针电极和 Pt 基底电极的光学扫描电镜图。从图中可以看出 Fe电极和 Pt 电极在抛光后呈圆盘状,通过测量得到 Fe 电极半径为 50μm,玻璃与金属丝半径比值(RG)为 3.7,Pt的半径为 62.5μm,RG 为 10.8,在玻璃管密封前后 Fe 和 Pt 的直径都没有变化。Fe 探针电极是在激光拉制仪(p-2000)上制备,而 Pt 基底电极是商业PC-10 拉制仪上制备,从中可以看出,这两种方法制备得到的电极较好的保存了金属丝原来的表面结构和尺寸。实验中探针电极逼近基底电极时所采用的氧化还原电对为实验室自制的三乙醇胺铁(Fe(III)-TEA),由于 Fe 的电极电势较负(E 0 Fe 2+ /Fe =-0.447 vs NHE),若采用二茂铁甲醇(E 0 =0.44 vs NHE)或氯化六胺合钌(E 0 =0.05 vs NHE)这些常用的氧化还原电对,在逼近过程中 Fe 会发生反应,导致 Fe 表面在测试前发生明显的变化。实验中将 Fe 探针电极逼近至 Pt 基底电极 33μm 处。在探针和基底之间的距离确定后,将电解池中溶液换为 5mM HClO 4 +0.1M NaClO 4 ,并除氧 15min,对 Fe 探针电极进行线性扫描伏安法(LSV)测试。图 3 为 Fe 探针电极和基底电极电流随 Fe 电极电位变化的产生 / 收集曲线。从图 3a 和 b 中可以看出,随着探针电位的正移,析氢反应逐渐减弱,Fe氧化开始发生,直至-0.4V vs NHE 时,基底电极上氢气氧化电流趋向于 0,表明探针上析氢反应基本消失,Fe探针电极上开始以Fe的氧化为主。通过阴极极化区探针和基底电流,确定探针电极的收集效率为 91.5%。
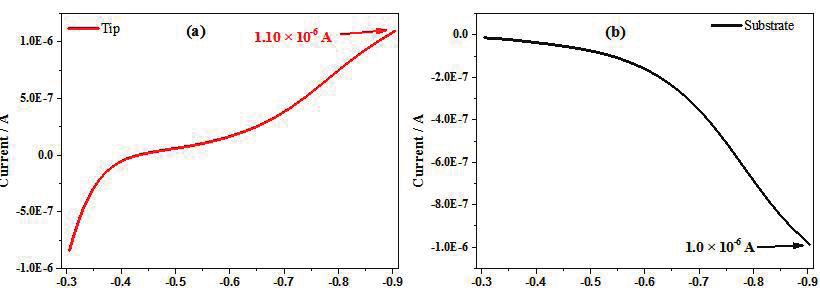
图3. 在5 mM HClO 4 + 0.1 M NaClO 4 除氧溶液中,50μm Fe探针电极在62.5 μm Pt基底电极上的线性循环伏
安曲线,其中(a)探针电流(b)基底电流。探针电位扫描区间为从-0.9V 至 -0.3 V vs NHE,基底氧化
氢气恒定电位为+0.3 V vs NHE,扫速为5 mV·s -1
图 4a 中红线为图 3 中探针电流,黑线为对基底电流收集效率校正并取绝对值后的电流值,蓝线为探针电流与校正后基底电流的差值即 Fe 的氧化电流。
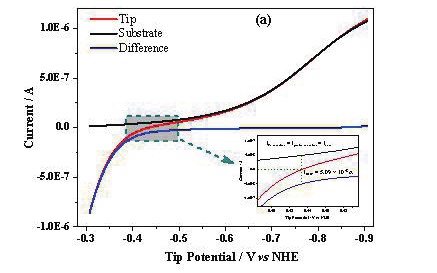
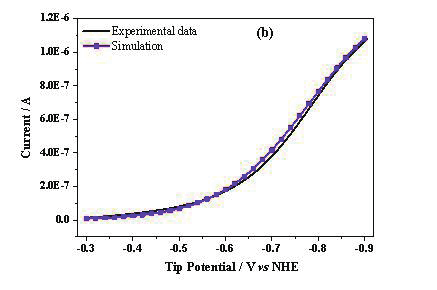
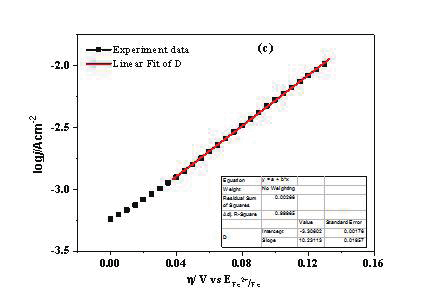
图4.(a)对图3中的数据进行进一步的处理,探针电流、基底电流和两者电流差与探针电位之间的关系。红线代表探针电流,黑线代表91.5%的收集效率校正后并取绝对值的基底电流,蓝线是这两者的差值。插图是探针电流为0时的局部放大图。(b)Fe电极表面的质子还原电流与COMSOL的模拟曲线。(c)Fe氧化电流为j,则logj与Fe氧化过电势η之间的关系(黑线),以及线性拟合(红线)之间的关系。
从图 5a 中可以看出在电位区间为 -0.55至 -0.9V vs NHE 时,探针电流与校正后的基底电流重合,表明 Fe 探针上主要是质子的还原。在 -0.31 至 -0.36 Vvs NHE 时,基底电流为 0,则 Fe 电极上主要发生的是 Fe 的氧化。当探针电流为 0 时,Fe 氧化电流与质子还原电流大小相同为腐蚀电流,大小为 5.09×10 -8 A(电流归一化后,自腐蚀电流密度为 6.48×10 -4 A/cm 2 ),此时电位为Fe 的腐蚀电位,为 -0.433 V vs NHE。
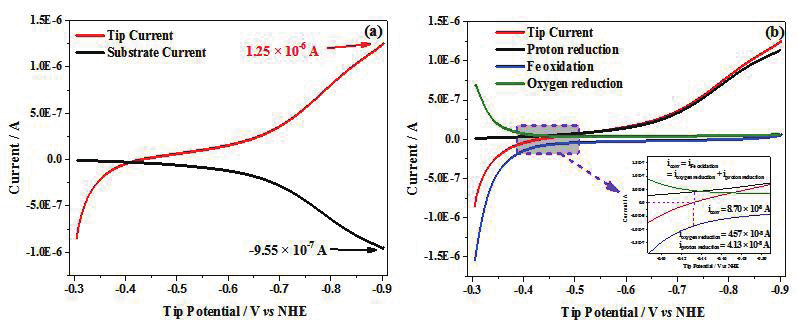
图5. (a)酸性有氧体系中放入Fe电极表观电流(红线)和基底Pt收集电流(黑线);(b)有氧酸性环境下,
根据收集效率计算得到的Fe的析氢电流(黑线)、氧的还原电流(绿线)和Fe溶解电流(蓝线)。
通过对质子还原电流和 Fe 氧化电流进行 COMSOL 模拟和线性拟合,可以分别得到 Fe 腐蚀时析氢反应和 Fe 氧化反应的标准速率常数 k 0 和传递系数 α 分别为 9.2×10 -6 cm/s 和 0.27(图 4b),2.5×10 -6 cm/s 和 0.7(图 4c) [42] 。
Fe 发生腐蚀时通常有氧气参与,因此课题组又进一步研究了在含氧酸性溶液中 Fe 的腐蚀行为[43] 。图 5a 中探针电流上包含有质子还原电流、氧还原电流和 Fe 氧化电流,而基底电极只发生氢气的氧化反应,因此通过对基底电流进行收集效率校正后可得到探针上质子还原电流,结合除氧条件下 Fe 氧化电流,可得到探针电极上的氧还原电流。从图8b 中反常吸氧还原曲线(随电位负移,O 2 还原电流下降)表明酸性溶液体系O 2 还原与质子还原存在竞争关系,且与电位密切相关。图 8b 中插图为有氧体系中自腐蚀电位的放大部分,亦即自腐蚀电流和自腐蚀电位真正的物理化学图像。表观电流为 0 时,各自对应的 Fe溶解电流,质子还原电流以及 O 2 还原电流均有准确数值,腐蚀所关注的电流大小是且应该就是 Fe 的溶解电流大小。
此外,在腐蚀电位附近,氧还原电流和质子还原电流相差较小,表明在自腐蚀电位附近,氧还原反应与质子还原反应同等重要,不能忽略。
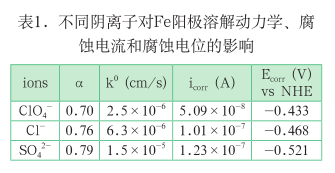
表 1 为改变溶液的阴离子分别为ClO 4 - ,Cl - 和 SO 4 2- 时,对应的 Fe 阳极溶解的传递系数,表观速率常数、自腐蚀电流和自腐蚀电位数据。结果清晰表明传递系数均显著偏离 0.5,阴离子显著改变表观速率常数,自腐蚀电流 SO 4 2-溶液中最大,ClO 4 - 溶液中最小,这些结果表明阳极溶解动力学过程不简单是金属失去电子的过程,阴离子的吸附作用等对金属离子从金属晶格中溶出具有重要影响,这一部分的理论分析正在结合第一性原理展开。
而对于 Cu 的阳极溶解与阴极还原反应的定量研究则涉及溶解过程的一价铜离子等。图 6a 和 b 分别为探针电流和基底电流随探针电位的变化,当探针开始扫描时,探针电极上只发生质子还原反应,同样基底电极上也只发生氢气氧化反应,据此可得到基底电极对探针产生氢气的收集效率为 83%。当探针电位在 -0.184 至 0.206V 之间时,探针电流和基底电流都趋向于 0,表明探针上既不发生质子还原也不发生Cu氧化反应。
当电位高于 0.206V 时,探针上开始发生 Cu 氧化反应,而基底电流大小先增大后减小,在 0.452V 时达到最大值,此时基底电流为探针产生的 Cu + 发生氧化反应的电流,通过收集效率校正后,发现基底电流仅占到探针电流的4.9%,表明 Cu 氧化主要发生的是双电子过程(生成 Cu 2+ 占到 95.1%),单电子过程只占到很小的比例。通过对图 6 中得到的 Cu 表面质子还原电流进行 COMSOL多物理场模拟,可得到 Cu 表面析氢反应标准速率常数 k 0 H 和传递系数 αH 分别 为 1.28×10 -4 cm/s 和 0.29。Cu 氧化为 Cu 2+ 的标准速率常数 k 0 Cu2+ /Cu 和αCu 2+ /Cu 分 别 为 1.31×10 -4 cm/s 和0.76,而对于 Cu 氧化为中间态 Cu + ,Cu + 的标准速率常数 k 0 Cu+ /Cu 和 αCu + /Cu 分别为 5.69×10 -4 cm/s 和 0.42。
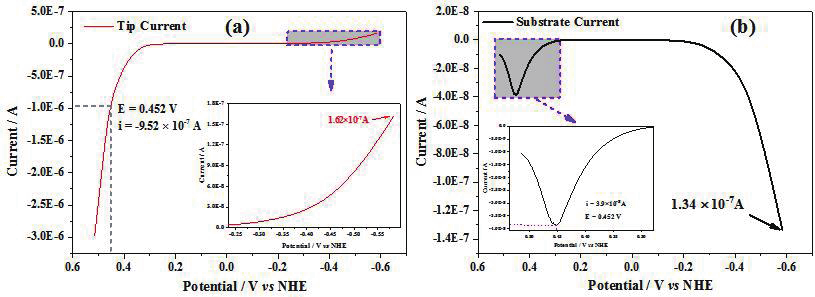
图6?在除氧5mM?HClO 4 +0.1M?NaClO 4 溶液中,Cu探针电极线性伏安曲线,其中(a)Cu探针电流和(b)Pt基底电流随探针电位的变化。图(a)中插图为质子还原电流随探针电位变化,图(b)中插图为Cu探针电极产生中间物在基底上氧化电流。
为了进一步研究含氧溶液中 Cu 腐蚀动力学,分别在自然条件和氧饱和条件下对 Cu 电极进行线性极化曲线测量。图 7a 和 b 为自然条件下探针电流和基底电流随探针电位的变化,图 7c和 d 为氧饱和条件下探针电流和基底电流随探针电位的变化。当 Cu 探针电极上电流为 0 时,自然条件下酸性溶液中 Cu 腐蚀电位(E corr )为 0.20V。从图 7a 和 c 可以看出,在阴极极化区,随着氧浓度的增加,相同电位下质子还原电流减小,表明部分质子可能参与了氧还原反应过程。在阳极极化区(图 7b 和 d),随着氧浓度增加,Cu氧化电流逐渐增大,说明氧气存在可以促进 Cu 氧化。在 0.250V 至 0.516V 电位区间,基底电极上也能检测到探针产生的 Cu + ,按照收集效率校正后,在自然条件和氧饱和条件下,Cu 氧化为Cu + 的电流占总 Cu 氧化电流比值分别为1.3% 和 0.24%,与除氧条件下 4.9%相比,明显降低。可能原因有两个:一是溶液中氧气与产生的 Cu + 发生反应,即 Cu + +H + +1/2O 2 → 1/2H 2 O 2 +Cu 2+ ;二 是 氧 气 在 Cu 表 面 失 去 电 子 形 成(Cu)-(HO x )ads, 吸 附 的 (HOx) ads 可以 与 Cu + 反 应, 即 Cu(I)ads+(HOx)ads → Cu(II)+H 2 O(or H 2 O 2 )。
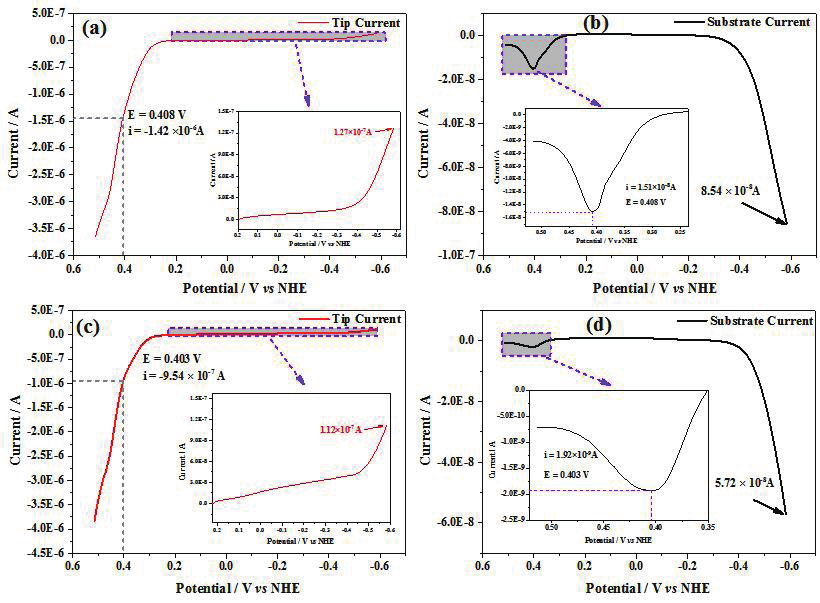
图7 在5mM HClO 4 +0.1M NaClO 4 溶液中不同氧浓度下Cu探针电极线性伏安曲线,其中在自然条件(a)Cu探针电流和(b)Pt基底电流随探针电位变化,在氧饱和条件下(c)Cu探针电流和(d)Pt基底电流随探针电位变化。图(a)和(c)中插图为质子还原电流随探针电位变化,图(b)和(d)为Cu氧化中间物氧化电流随探针电位变化。
5. 结论
腐蚀反应是涉及异相电荷转移和均相化学反应的耦合反应,且异相电化学反应包含阳极溶解反应和阴极还原反应,其动力学研究需要从电化学 - 化学反应本身出发,揭示腐蚀与防护研究中的腐蚀电化学的反应历程与机制,继而推动和促进腐蚀与防护研究,发展非平衡电化学。
致谢
国家自然科学基金(51771174,51131005,51171172 和 50801056)、国 家 重 点 研 发 计 划 子 任 务(2017YFB0702302)、浙江省自然科学基金杰出青年项目(LR16E010001)和自然环境腐蚀平台资助。
参考文献
[1] 曹楚南,腐蚀电化学原理,第三版,北京,化学工业出版社,2008
[2] L.R. Chang, F.H. Cao, J.S. Cai, W.J. Liu, J.J.Zheng, J.Q. Zhang, C.N. Cao, Polarization Behaviorof Magnesium Alloy AZ91D with Micro-Arc OxidationCoating in NaCl Solution. Acta Physico-ChimicaSinica, 28 (2012) 127-136.
[3] A.J. Bard, L.R. Faulkner, Electrochemicalmethods: Fundamentals and Applications, 2nd edition,New York, John Wiley & Sons. INC. 2000
[4] N. Perez, Electrochemistry and Corrosion Science,Boston, Kluwer Academic Publishers, 2004
[5] J.H. Liu, G. Rong, S. Cen, S.M. Li, H.B. Shi,K. Zhao, M. Yu, Dissolution Behavior of IntermetallicParticles in AA2297-T87 during Anodizing in Adipic-Sulfuric Acid, Journal of the Electrochemical Society.165 ((2018) C980-C990.
[6] X. Wu, Y.T. Sun, Y.Y. Liu, Y.Y. Yang,J. Li, Y.M. Jiang, The Critical Pitting ChlorideConcentration of Various Stainless Steels Measuredby an Electrochemical Method, Journal of theElectrochemical Society. 165 ((2018) C939-C949.
[7] X. Qiu, Microstructure, hardness and corrosionresistance of Al2CoCrCuFeNiTix high-entropy alloycoatings prepared by rapid solidification, Journal ofAlloys and Compounds. 735 (2018) 359-364.
[8] R.L. Liu, J.R. Scully, G. Williams, N. Birbilis,Reducing the corrosion rate of magnesium viamicroalloying additions of group 14 and 15 elements,Electrochimica Acta. 260 (2018) 184-195.
[9] Y.J. Qiang, S.T. Zhang, B.C. Tan, S.J. Chen,Evaluation of Ginkgo leaf extract as an eco-friendlycorrosion inhibitor of X70 steel in HCl solution,Corrosion Science. 133 (2018) 6-16.
[10] C.Q. Li, D.K. Xu, X.B. Chen, B.J. Wang,R.Z. Wu, E.H. Han, N. Birbilis, Composition andmicrostructure dependent corrosion behaviour of Mg-Lialloys, Electrochimica Acta. 260 (2018) 55-64.
[11] L.H. Yang, Y.X. Wan, Z.L. Qin, Q.J. Xu,Y.L. Min, Fabrication and corrosion resistance of agraphene-tin oxide composite film on aluminium alloy6061, Corrosion Science. 130 (2018) 85-94.
[12] Y.J. Qiang, S.T. Zhang, L. Guo, X.W. Zheng,B. Xiang, S.J. Chen, Experimental and theoreticalstudies of four allyl imidazolium-based ionic liquids asgreen inhibitors for copper corrosion in sulfuric acid,Corrosion Science. 119 (2017) 68-78.
[13] Y.B. Zhao, H.P. Liu, C.Y. Li, Y. Chen, S.Q.Li, R.C. Zeng, Z.L. Wang, Corrosion resistance andadhesion strength of a spin-assisted layer-by-layerassembled coating on AZ31 magnesium alloy, AppliedSurface Science. 434 (2018) 787-795.
[14] D.K. Xu, J. Xia, E.Z. Zhou, D.W. Zhang,H.B. Li, C.G. Yang, Q. Li, H. Lin, X.G. Li, K.Yang, Accelerated corrosion of 2205 duplex stainlesssteel caused by marine aerobic Pseudomonas aeruginosabiofilm, Bioelectrochemistry. 113 (2017) 1-8.
[15] A. Ehsani, M.G. Mahjani, M. Hosseini, R.Safari, R. Moshrefi, H.M. Shiri, Evaluation ofThymus vulgaris plant extract as an eco-friendlycorrosion inhibitor for stainless steel 304 in acidicsolution by means of electrochemical impedancespectroscopy, electrochemical noise analysis and densityfunctional theory, Journal of Colloid and InterfaceScience. 490 (2017) 444-451.
[16] M. Sakairi, R. Sasaki, A. Kaneko, Y. Seki,D. Nagasawa, Evaluation of metal cation effects ongalvanic corrosion behavior of the A5052 aluminumalloy in low chloride ion containing solutions byelectrochemical noise impedance, Electrochimica Acta.131 (2014) 123-129.
[17] F. Safizadeh, E. Ghali, Monitoring passivationof Cu-Sb and Cu-Pb anodes during electrorefiningemploying electrochemical noise analyses,Electrochimica Acta. 56 (2010) 93-101.
[18] W. Liu, F. Cao, L. Zhong, L. Zheng, B. Jia,Z. Zhang, J. Zhang, Influence of rare earth elementCe and La addition on corrosion behavior of AZ91magnesium alloy, Materials and Corrosion-WerkstoffeUnd Korrosion. 60 (2009) 795-803.
[19] W. Liu, F. Cao, A. Chen, L. Chang, J.Zhang, C. Cao, Corrosion behaviour of AM60magnesium alloys containing Ce or La underthin electrolyte layers. Part 1: Microstructuralcharacterization and electrochemical behaviour,Corrosion Science. 52 (2010) 627-638.
[20] S. Zhang, F. Cao, L. Chang, J. Zheng, Z.Zhang, J. Zhang, C. Cao, Electrodeposition of highcorrosion resistance Cu/Ni–P coating on AZ91Dmagnesium alloy, Applied Surface Science. 257 (2011)9213-9220.
[21] J.S. Cai, F.H. Cao, L.R. Chang, J.J. Zheng,J.Q. Zhang, C.N. Cao, The preparation andcorrosion behaviors of MAO coating on AZ91D withrare earth conversion precursor film, Applied SurfaceScience. 257 (2011) 3804-3811.
[22] F.H. Cao, Z. Zhang, J.X. Su, Y.Y. Shi, J.Q.Zhang, Electrochemical noise analysis of LY12-T3in EXCO solution by discrete wavelet transformtechnique, Electrochimica Acta. 51 (2006) 1359-1364.
[23] A.N. Chen, F.H. Cao, W.J. Liu, L.Y. Zheng,Z. Zhang, J.Q. Zhang, C.N. Cao, Shot noiseanalysis on corrosion behavior of zinc alloy (ZnAl4Cu1)under dry-wet cycles, Transactions of NonferrousMetals Society of China. 22 (2012) 228-240.
[24] A.N. Chen, F.H. Cao, X.N. Liao, W.J. Liu,L.Y. Zheng, J.Q. Zhang, C.A. Cao, Study ofpitting corrosion on mild steel during wet-dry cyclesby electrochemical noise analysis based on chaostheory, Corrosion Science. 66 (2013) 183-195.
[25] E. McCafferty, Validation of corrosion ratesmeasured by the Tafel extrapolation method, CorrosionScience. 47 (2005) 3202-3215.
[26] J. Pan, D. Thierry, C. Leygraf, Electrochemicalimpedance spectroscopy study of the passive oxide filmon titanium for implant application, ElectrochimicaActa. 41 (1996) 1143-1153.
[27] S. Tamilselvi, V. Raman, N. Rajendran,Corrosion behaviour of Ti-6Al-7Nb and Ti-6Al-4V ELI alloys in the simulated body fluid solution byelectrochemical impedance spectroscopy, ElectrochimicaActa. 52 (2006) 839-846.
[28] X.L. Zhang, Z.H. Jiang, Z.P. Yao, Y. Song,Z.D. Wu, Effects of scan rate on the potentiodynamicpolarization curve obtained to determine the Tafelslopes and corrosion current density, CorrosionScience. 51 (2009) 581-587.
[29] 曹楚南,张鉴清,电化学阻抗谱导论,北京,科学出版社,2002 年 7 月[30] C.N. Cao, On the impedance plane displays forirreversible electrode reactions based on the stabilityconditions of the steady-state—I. One state variablebesides electrode potential, Electrochimica Acta. 35(1990) 831-836.
[31] C.N. Cao, On the impedance plane displays forirreversible electrode reactions based on the stabilityconditions of the steady-state—II. Two state variablesbesides electrode potential, Electrochimica Acta. 35(1990) 837-844.
[32] Y.Y. Shi, Z. Zhang, F.H. Cao, J.Q. Zhang,Dimensional analysis applied to pitting corrosionmeasurements, Electrochimica Acta. 53 (2008) 2688-2698.
[33] Y. Xia, P. Liu, J.Q. Zhang, F.H. Cao,Corrosion Behavior of Weathering Steel Under ThinElectrolyte Layer at Different Relative Humidity,Journal of Materials Engineering and Performance. 27(2018) 202-218.
[34] Y.M. Kolotyrkin, Effect of anions on thekinetics of the dissolution of metals, Russian ChemicalReviews. 31 (1962) 160-167.
[35] J.M. Kolotyrkin, Effects of Anions on theDissolution Kinetics of Metals, Journal of theElectrochemical Society. 108 (1961) 209-216.
[36] V. Jovancicevic, J.O. Bockris, The Mechanismof Oxygen Reduction on Iron in Neutral Solutions,Journal of the Electrochemical Society. 133 (1986)1797-1807.
[37] 董俊华 , 宋光铃 , 林海潮 , 曹楚南 , 硫酸中硫脲影响铁腐蚀行为的机制 , 中国腐蚀与防护学报 . 16 (1996) 53-58.
[38] 高延敏 , 王绍明 , 徐永祥 , 吴维– , 文山 , A3 钢在乙酸中的腐蚀行为和机理 , 腐蚀与防护 . 27 (2006) 11-13.
[39] A.J. Bard, F.R.F. Fan, D.T. Pierce, P.R.Unwin, D.O. Wipf, F.M. Zhou, Chemical Imagingof Surfaces with the Scanning ElectrochemicalMicroscope. Science. 254 (1991) 68-74.
[40] D. Polcari, P. Dauphin-Ducharme, J. Mauzeroll,Scanning Electrochemical Microscopy: A ComprehensiveReview of Experimental Parameters from 1989 to 2015.Chemical Reviews. 116 (2016) 13234-13278.
[41] C.G. Zoski, Review-Advances in ScanningElectrochemical Microscopy (SECM)。 Journal of theElectrochemical Society. 163 (2016) H3088-H3100.
[42] Q.H. Zhang, Z.N. Ye, Z.J. Zhu, X.Y. Liu,J.Q. Zhang, F.H. Cao, Separation and kinetic studyof iron corrosion in acidic solution via a modifiedtip generation/substrate collection mode by SECM,Corrosion Science. 139 (2018) 403-409.
[43] Q.H. Zhang, P. Liu, Z.J. Zhu, Z.N. Ye,J.Q. Zhang, F.H. Cao, X.G. Li, Quantitativeanalysis of the polarization behavior of iron in anaerated acidic solution using SECM, ElectrochemistryCommunications. 93 (2018) 143-147.
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





