前言
对于多数金属腐蚀过程,腐蚀电化学反应是腐蚀过程中重要,也是最为复杂的化学反应。腐蚀研究从早期的形貌观察、失(增)重法,逐渐进化用电化学方法监测腐蚀过程,明确腐蚀机制。对于腐蚀反应而言,因非平衡和多反应耦合特征,很多电化学技术应用受限,在腐蚀中最重要也是被广泛使用的技术通常有两种:极化曲线和电化学阻抗谱。电化学噪声技术因数据解析困难,与腐蚀反应之间的物理化学图像建立困难而应用受限。实际上,极化曲线和电化学阻抗谱在腐蚀体系的重复性欠佳,解析获得的参数,如 Rp 和 Rct 等,与腐蚀电化学反应本征参数缺乏直接的联系。腐蚀电化学反应通常为氧化性物种(如 O 2 ,H + )被还原和金属被氧化形成离子过程,即:
阴极反应:O+ne=R
阳极反应:M-ne=M n+
对这两者的耦合反应,其基本方程被简化为:
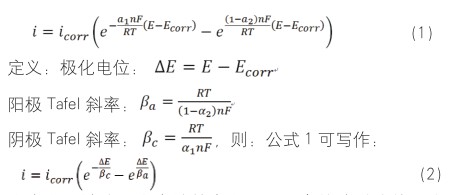
这个方程被称之为腐蚀基本方程,具有简洁对称美。式中 icorr 和 Ecorr 为自腐蚀电流和自腐蚀电位,其物理意义为没有外加极化电位时,阴极反应和阳极反应耦合电流大小相等时的电流及其对应的电位,F 为法拉第常数,R 为气体常数,T 为温度,a1 为阴极反应的传递系数,a2 为阳极反应的传递系数,βa 为阳极 Tafel 斜率,βc 为阴极 Tafel 斜率。特别注意 a1 与 a2 并不相等,因这两个传递系数分别对应两个不同的电化学反应。已有文献报道传递系数介于 0.1 至 0.9,这可能是腐蚀测试中 Tafel 斜率高达几百 mV/dec 的原因。该基本方程只是形式上与 Bulter-Volmer 方程具有相似性,但是实质是两个反应耦合后的动力学方程,而 Bulter-Volmer 则表达的是一个电化学反应的氧化和还原两个方向。这个方程是极化曲线和电化学阻抗谱的基本公式,很多后续推导都是建立在这个方程的基础上,但实际上这个方程是建立在多步假设的基础上得到的。对于阴极反应和阳极反应,我们先假设是基元电化学反应,则各自反应的 Bulter-Volmer 表达式为:
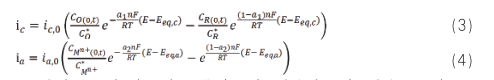
式中:下标中 a 和 c 代表阳极反应和阴极反应,下标 eq代表平衡,O 表示氧化性物种,R 表示还原性物种,(0,t)表示 t 时刻表面浓度,上标 * 表示本体,ic,0 和 ia,0 分别为阴极反应和阳极反应的交换电流密度。显然,这两个独立的电流表达式中表明各自反应的物种浓度及其空间分布对电流大小有显著影响。对于腐蚀研究,对公式 3 和 4 做了如下重要假设:(1)腐蚀电极的自腐蚀电位与阴阳极反应的各自平衡电位差值较大,可以分别忽略阴极反应的阳极分支和阳极反应的阴极分支;(2)表面浓度与本体浓度近似相等,前提是动力学速率小且电位偏离各自平衡电位较小。此时,对于腐蚀发生的阴阳极反应分别简化为:

此式即是式 1 所示的腐蚀电化学基本方程。从推导过程可知:(1) 腐蚀基本方程忽略了空间浓度对动力学的影响,而是默认了表面浓度与本体浓度相同;(2) 阳极反应与阴极反应动力学对腐蚀反应的影响不够重视,而是以 icorr 参数为主,鲜有各自反应动力学的报道。实际上方程 3 和 4 的前提中有关电位的要求是互相冲突的。对于浓度项、或者扩散控制下的腐蚀电化学研究,传统腐蚀基于菲克第一定律和稳态传质过程,并假设扩散层的浓度处于线性,则:

对于阳极反应的式 6,因为就是金属自身的溶解,一般不认为不存在扩散控制。通过此时的处理,不能获得式 1 或者式 2 的腐蚀方程,icorr 的解析一般通过图解法获得。但是在这个推导过程隐含了一个重要假设:即扩散层厚度是一定的。实际上扩散层内厚度与测试时间有关,且浓度区间也非线性,因此极限扩散电流也不是一定值。
实际上对于 O+ne=R 的电化学反应,其电化学动力学基本方程应该具有如下形式:
![]()
该式表明电化学反应的动力学基本参数是且仅是 k 0 ,a 和E 0 。而在溶液中的传质过程,在忽略电迁移和强制对流的前提下,均可用菲克第一和第二定律描述,即表明浓度梯度需要考虑,扩散系数是重要的参数。对于腐蚀而言,腐蚀电化学需要确定的参数应该是阴极反应和阳极反应各自的标准速率常数 k 0 ,传递系数 a 和标注电极电位 E 0 ,而不是简单默认 a 为0.5,且用 icorr 则为腐蚀动力学参数。推导过程已经表明 icorr与各自阴阳极反应的交换电流、反应物种的浓度梯度、传递系数、各自的平衡电位以及自腐蚀电位等有关。接下来,我们以课题组前期以及正在开展的工作来说明空间浓度分布以及动力学参数对腐蚀电化学的影响。
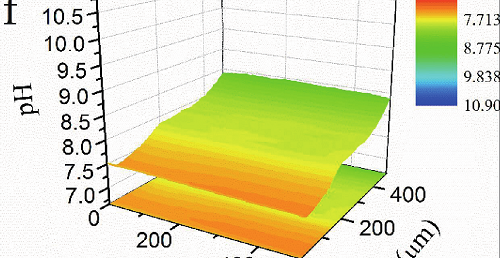
图1 双管Pt-Pt/IrOx复合超微电极示意图,其中Pt用于电流响应,控制距离,Pt/IrOx用于电位模式,实现pH测量。
1、空间pH分布研究
无论在酸性溶液还是中性以及碱性溶液中,通常腐蚀阴极过程的反应为质子(水合质子)和 / 或氧气的还原反应,典型的阴极反应表达式如下:

图2 (a)316L不锈钢表面不同距离处进行电位面扫描示意图,(b)不同距离
下,不锈钢表面的pH梯度变化以及随时间演化。
显然,对于 μ 腐蚀的阴极过程,无论是 H + 还原还是 O 2 还原,都会显著影响微区的 pH 值,局部的 pH 值反过来又会显著影响这些阴极过程。课题组制备了Pt/IrOx全固态pH微传感器,以及 Pt-Pt/IrOx 电流 / 电位符合型传感器,其中 Pt 丝直径为 10或者 25 微米。研究结果表明所制备的 Pt/IrOx 微传感器对 pH 从1.0 到 13.0 范围内都具有良好的线性响应,空气中储存 110 天后仍具有良好线性,对 pH 变化响应时间短。我们应用 Pt-Pt/IrOx 电流 / 电位符合型传感器中的 Pt 作为 SECM 的电流反馈模式控制距离,Pt/IrOx 电极的电位模式实现横向和径向的 pH 分布研究,具体示意图如图 1 所示,研究结果如图 2 和 3 所示。
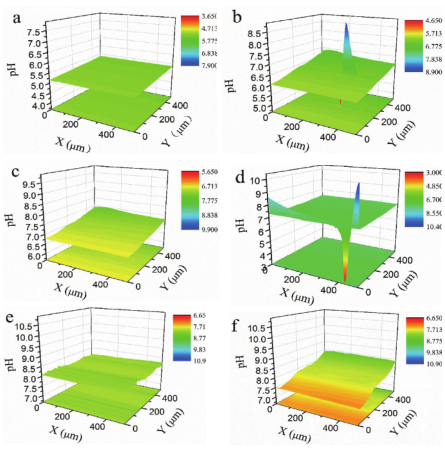
图3 本体溶液pH为2的不锈钢表面不同时间的pH扫描图谱。(a)1小时,(b)5小时,(c)8小时,(d)20小时,(e)32小时和(f)48
小时。探针与基底距离:12μm,扫描速率:40μm.s1。
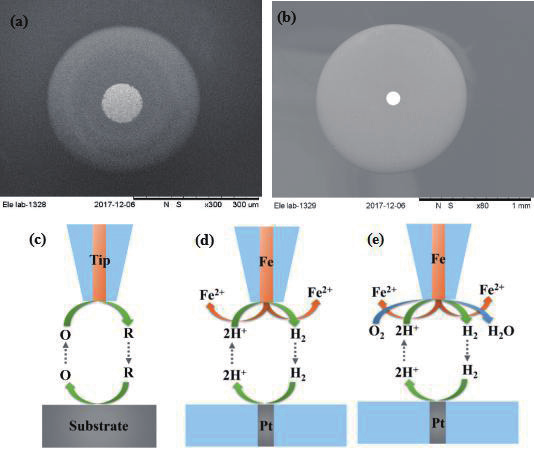
图4 (a)25微米Fe超微电极;(b)100微米Pt超微电极;(c)一般的产生-收集模(此时有反馈效应);(d)Fe在酸性体
系中的阳极溶解和质子还原反应分离;(e)Fe在酸性含氧体系中阳极溶解、质子还原和氧还原的分离。
图 2 的结果清楚显示即使本体溶液的 pH 值为 2,且随时间几乎不变的情况下,在距离电极表面 12 至 20 微米的空间范围内,仍存在明显的质子浓度梯度,且随时间演化后不锈钢表面的 12 微米距离处 pH 可高达 10。显然这与我们在推导腐蚀方程中假设本体浓度与界面处浓度差异不大有很大不同,即表明忽略浓度梯度得到的腐蚀方程对于腐蚀的深入认识存在较大误差。图 3 则是距离不锈钢表面 12 微米处横向的 pH 分布结果。图所示结果表明在不锈钢表面的 pH 与本体 pH 比较,有很大程度的碱化,与图 2 所示结果一致。同时,图 3 中还出现了局部 pH 的显著波动,表明对于不锈钢腐蚀而言,在微观尺度上不均匀,存在局部阳极区域和阴极区域。局部的酸化或者碱化与阴极析氢有关,也与 Fe阳极溶解和溶解出的 Fe 2+ 水合有关。无论是横向还是径向,pH 分布结果均表明对于不锈钢腐蚀忽略浓度梯度,继而进行数据分析存在较大误差。
2、腐蚀动力学研究
腐蚀反应包含至少两个电化学反应。极化曲线研究腐蚀速率时通常扫描电位至 Tafel 区,再根据 Tafel 公式拟合获得 icorr 和 Ecorr,问题在于很多金属腐蚀电极的并不存在良好线性的 Tafel区,根本原因在于腐蚀反应的复杂性,以及前言中提到的腐蚀动力学方程简化在很多实际体系中并不能有效成立。课题组的思路是通过扫描电化学显微镜的探针产生 - 基地收集模式,分离金属腐蚀电极在整个扫描电位区间(包括 Tafel极化、弱极化和线性极化)的阳极和阴极反应,继而实现阳极反应和阴极反应的动力学分析。如图 4 所示,我们制备了 25 微米的纯 Fe 和 100 微米的 Pt 超微电极,并给出了探针产生 - 基底收集的示意图,以及如何分离 Fe 溶解中的阳极反应和阴极反应示意图。
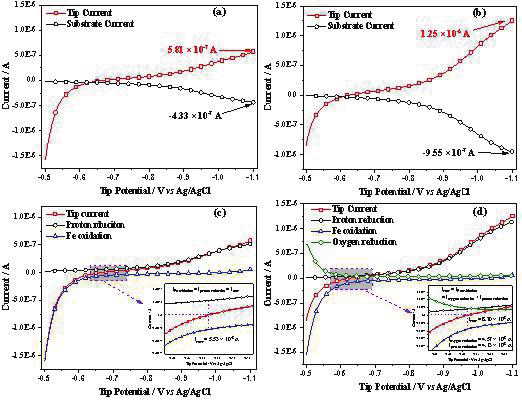
图5 (a)酸性无氧体系中的Fe电极表观电流(红线)和基底Pt收集电流(黑线),(b)酸性有氧体系中的Fe电极表观电流(红线)和基底Pt收集电流(黑线);
(c)酸性无氧环境下,收集效率计算得到的Fe的析氢电流(黑线)和Fe溶解电流(蓝线);(d)有氧酸性环境下,根据收集效率计算得到的Fe的析氢电流(黑
线)、氧的还原电流(绿线)和Fe溶解电流(蓝线)。
根据图 4 所示的超微电极,以及产生 - 收集示意图,应用 Fe 超微电极作为扫描电化学显微镜的探针,Pt 超微电极作为基底(应用 100 微米电极作为收集电极的主要目的是降低背景电流),通过 Z 轴的逼近曲线功能,以及 X 轴和 Y 轴的线扫描功能,实现 Fe 与 Pt 超微电极距离 30 微米。Fe 电极上电位扫描响应的表观电流如图 5a 和 b 中红色曲线所示,基底电极收集的H 2 氧化电流黑色曲线所示。通过收集效率矫正后,即可获得 Fe 电极的析氢电流随电位变化曲线(图 5c 和 d 中的黑线),同时可以获得 Fe 的氧化电流曲线。对于 Fe 的阳极反应和析氢反应:
Fe-2e=Fe 2+ (16)
2H + +2e=H 2 (17)
应用 COMSOL 多物理场模型,构建界面处的 Bulter-Volmer方程,以及溶液中的扩散方程,模拟分析可得动力学速率常数分别为 2.5×10 -6 和 9.2×10 -6 cm/s,传递系数分别为 0.70和 0.27,结果表明动力学速率都很低,且传递系数都远偏离0.5,更不相等。图5的插图则表明在有氧和无氧酸性溶液体系,自腐蚀电位附近的放大部分,亦即自腐蚀电流和自腐蚀电位真正的物理化学图像。表观电流为 0 时,各自对应的 Fe 溶解电流,质子还原电流以及 O 2 还原电流均有准确数值,腐蚀所关注的电流大小是且应该就是 Fe 的溶解电流大小。对于图 5d中所示的反常吸氧还原曲线(随电位负移,O 2 还原电流下降)表明酸性溶液体系 O 2 还原与质子还原的存在竞争关系,且与电位密切相关。鉴于 O 2 还原涉及质子参与的 4 电子过程,电化学动力学复杂,其研究仍在进行中。
展望
腐蚀反应是涉及异相电荷转移和均相化学反应的耦合反应,且异相电化学反应包含阳极溶解反应和阴极还原反应,其动力学的研究需要从电化学 - 化学反应本身出发。腐蚀电化学基本方程是多步假设后的简洁表达式,对于实际体系需要辩证对待。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





