摘要
将具有(111)择优取向的岛状奥氏体相嵌入连续铁素体的2205双相不锈钢(2205 DSS)工作面浸泡在铜绿假单胞菌(P. aeruginosa)中进行电化学测试,研究浸泡时间对2205 DSS 微生物腐蚀行为的影响。开路电位(OCP)、线性极化电阻(LPR)以及电化学阻抗谱(EIS)表明,在7 d浸泡期的无菌溶液中测得的EOCP、极化电阻(Rp)和电荷转移电阻(Rct)均比在有菌溶液中的大,表明铜绿假单胞菌加速了2205 DSS的腐蚀。动电位极化曲线表明,2205 DSS在无菌和有菌溶液中的维钝电流密度(ip)都随着浸泡时间的延长而不断增大,且在浸泡1 d、3 d、7 d的每个时间点有菌溶液的ip均比无菌环境的大,进一步证明铜绿假单胞菌加速了2205 DSS的腐蚀进程。扫描电子显微镜(SEM)结果表明,在有菌溶液中随着浸泡时间的延长表面粘附的细菌量逐渐增多,浸泡3 d后样品表面的细菌聚集成一个个小团簇,浸泡7 d菌落进一步聚集形成细菌生物膜。对腐蚀后样品表面局部腐蚀形貌的观察发现,细菌生物膜的形成加速了表面局部腐蚀的发生,导致严重的局部腐蚀。X射线光电子能谱(XPS)结果表明,在存在铜绿假单胞菌的条件下2205 DSS表面形成溶于水的CrO3,使MIC点蚀发生。
关键词: 金属材料 ; 双相不锈钢 ; 微生物腐蚀 ; 铜绿假单胞菌 ; 生物膜
双相不锈钢(Duplex Stainless Steel,DSS)具有良好的机械性能和优异的耐氯离子腐蚀性能,广泛应用在海洋工程领域[1,2,3]。但是,海洋环境中的微生物等腐蚀性活性介质使双相不锈钢发生局部腐蚀[4,5,6,7,8]。由微生物腐蚀引起的失效,已成为海洋工程材料领域的重要问题[9,10,11]。铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa)系革兰氏阴性杆菌,是海洋中常见的腐蚀性细菌。铜绿假单胞菌能使2205 DSS表面产生可溶性铬化合物CrO3,从而加速表面钝化膜的溶解,显著降低2205 DSS的耐腐蚀性[12,13,14]。铜绿假单胞菌的生物催化对2205 DSS钝化膜产生长期的破坏作用,7 d或14 d的连续电化学腐蚀研究已有报道[15]。但是,针对7 d内每个时间节点详细的电化学腐蚀研究,如动电位极化曲线测定以及表面细菌生物膜的形成对点蚀的影响,尚未有深入的报道。此外,由于轧制方向不同,2205 DSS的金相组织往往表现出不同形态。现有报道中的2205 DSS,其金相组织分布特征为长条带状奥氏体相嵌入连续的铁素体基体[16]。本文模拟海洋环境,将具有岛状奥氏体相嵌入连续铁素体的2205 DSS工作面浸泡在铜绿假单胞菌液中,采用电化学测试并结合表面分析技术研究浸泡时间对2205 DSS腐蚀行为的影响。
1 实验方法
1.1 实验用材料
本文实验用材料为2205双相不锈钢(2205 DSS),其化学成分(质量分数,%)列于表1。用线切割方法将2205 DSS加工成尺寸为10 mm×10 mm×5 mm的样品。将部分样品用环氧树脂封样并预留出10 mm×10 mm的工作面积用于电化学测试。将所有样品依次采用150、400、600、800、1000和1200粒度的碳化硅砂纸打磨(金相样品另用水溶性金刚石研磨膏作抛光处理)、丙酮除油、去离子水冲洗,再用无水乙醇超声清洗30 min,干燥后备用。
表1 2205 DSS的化学成分(质量分数,%)
1.2 培养基和细菌
实验用细菌为铜绿假单胞菌(1A00099),取自中国海洋微生物菌种保藏管理中心(MCCC)。使用2216 E培养基用于模拟营养海水环境,培养基的组分(g·L-1)为:19.45 NaCl,5.98 MgCl2,3.24 Na2SO4,1.8 CaCl,0.55 KCl,0.16 Na2CO3,0.08 KBr,0.034 SrCl2,0.08 SrBr2,0.022 H3BO3,0.004 NaSiO3,0.0024 NaF,0.0016 NH4NO3,0.008 NaH2PO4,5.0蛋白胨,1.0酵母提取物和0.1柠檬酸铁。使用前将培养基在121℃、高压灭菌15 min。配制菌液的初始浓度为106 CFU/mL。
1.3 电化学测试
测试前,将样品在75%乙醇溶液中灭菌30 min,随后暴露在紫外光下灭菌30 min。在电化学工作站(Zahner Zennium,Germany)进行测试,采用三电极体系,参比电极为饱和甘汞电极(SCE),对电极为铂片,工作电极为2205 DSS。对样品进行连续7 d的开路电位(OCP)、线性极化电阻(LPR)和交流阻抗谱(EIS)测试,和1 d,3 d 和7 d的动电位极化曲线测试。为了保证体系的稳定,每次测量OCP 1 h后依次进行电化学阻抗谱(EIS)和极化曲线测试。LPR测试电位为-5 mV至+5 mV(vs. OCP),扫描速率为0.125 mV/s。EIS测试振幅为5 mV,测试频率范围为0.01 Hz~100 kHz。动电位极化扫描速率为0.5 mV/s,扫描范围为-200 mV(vs. OCP)至1.6 V。电解液为37℃的无菌和菌液浓度为106 CFU/mL的2216E培养基。为保证结果的可重复性,每次实验使用三个平行试样。
1.4 表面分析
用光学显微镜(徕卡DM500)观察样品的金相组织。观察前对抛光的样品进行电解侵蚀:使用可编程直流电源(艾德克斯 IT-6123),设置电压6 V,电流1 A,电解液是浓度为20 %的NaOH溶液,侵蚀时间为10 s。
用扫描电子显微镜(SEM,Carl Zeiss)观察样品的表面形貌。对表面具有铜绿假单胞菌的样品(极化测试后的样品)用无菌水漂洗3次,使用2.5%戊二醛在4℃固定4 h,之后依次用50%,60%,70%,80%,90%,95%和100%的酒精脱水,喷Pt后进行SEM观察。对部分极化测试后的样品,根据GB / T4334.4-2000[17],采用硝酸-氢氟酸溶液去除样品表面生物膜和腐蚀产物,然后采用SEM观察样品表面形貌。用3D激光共聚焦扫描显微镜(LSM,KEYENCE VK-X200)测量局部腐蚀坑深度,对样品表面6个典型腐蚀坑的深度进行扫描测量,得到平均腐蚀坑深度柱状图,使用Excel进行双样本方差分析和F-检验以确定统计学显著性。P<0.05表示有显著的统计学意义。
用X射线光电子能谱仪(XPS,ULVAC-PHI 1800) 分析表面元素的化学态。使用单色X射线源(15 kV和350 W的Al kα电极),能量58.70 eV、步长0.125 eV记录0~1400 eV范围内的光谱的通过能量和高分辨率光谱。C 1s峰值为284.8 eV,用于校正峰位偏移。
2 结果和讨论
2.1 金相组织和XRD谱
已报道的2205 DSS的工作面金相组织如图1a所示[16],本文采用的2205 DSS工作面的金相组织如图1b所示。图中亮白色的组织为奥氏体,灰白色组织为铁素体,两相各占50%左右。图1a中2205 DSS的金相组织分布特征为长条带状分布的奥氏体相嵌入连续的铁素体中,而本文采用的2205 DSS工作面具有岛状奥氏体相嵌入连续的铁素体的特点(图1b)。对两种组织形态的2205 DSS的XRD谱进行分析,结果如图2所示。已报道的2205 DSS工作面的奥氏体的择优取向为(220)晶面,而本文的择优取向为(111)晶面。由于轧制方向不同,奥氏体的择优取向不同,因而表现为不同形态的奥氏体分布。

图1 已报道的[16]和本文使用的2205 DSS的金相组织
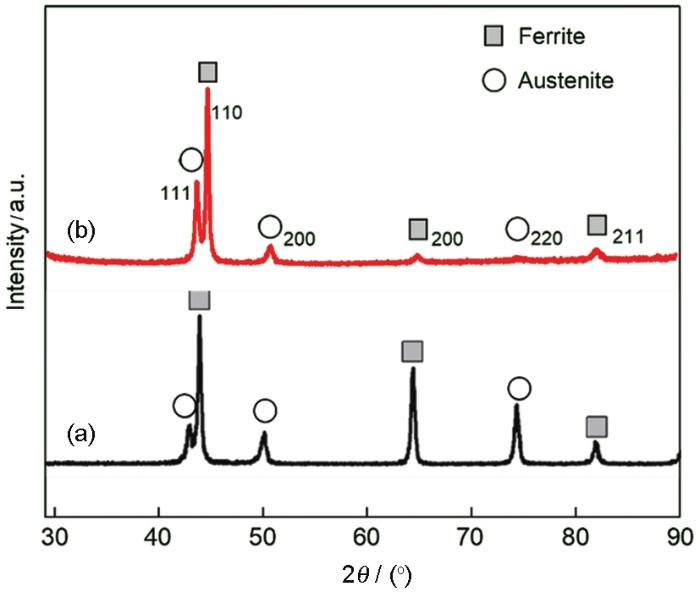
图2 已报道的[16]和本文使用的2205 DSS工作面的XRD谱
2.2 OCP和LPR
图3给出了在无菌和有菌电解液中对2205 DSS进行连续7 d电化学测试的OCP和LPR结果。从OCP结果可以看出,在无菌环境中样品的开路电位EOCP在1 d内由0.034 V急降至-0.324 V,随后稳定在-0.360 V左右;而在有菌环境中样品EOCP由0.024 V迅速下降至-0.356 V,随后趋于平稳(-0.381 V)。LPR结果表明,无论是在无菌环境还是在有菌环境中,样品的线性极化电阻值Rp在1 d内均显著降低,随后表现得相对平稳,其中无菌环境中样品的Rp稳定在24 kΩ·cm2,大于有菌环境的14 kΩ·cm2。OCP和LPR结果表明,无论无菌环境还是有菌环境,2205 DSS在浸泡1 d内腐蚀速度均迅速增加,之后趋于平稳,但是在整个7 d浸泡期有菌环境中样品的腐蚀更严重。其原因可能是,在浸泡早期即1 d 内样品表面钝化膜的完整性迅速遭到腐蚀性介质的破坏,因而腐蚀进程加快。但是之后钝化膜的破坏与修复渐趋平衡,表现为腐蚀趋于平缓。与无菌环境比较,铜绿假单胞菌的存在对钝化膜的破坏更严重,因而整体腐蚀更快。
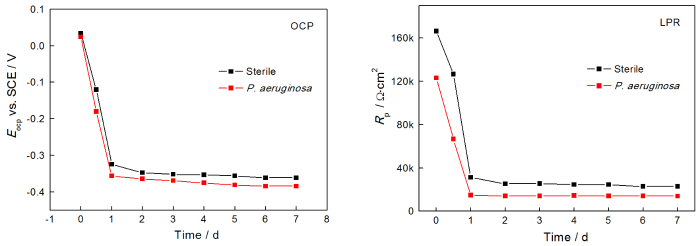
图3 在无菌和有菌溶液中对2205 DSS 连续7 d测试的OCP和LPR结果
2.3 EIS
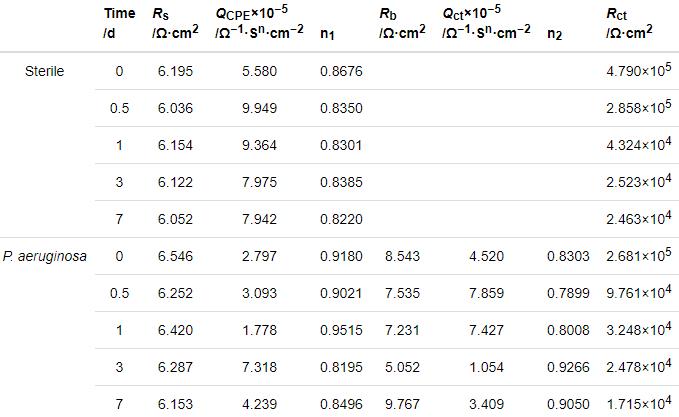
图4给出了2205 DSS在无菌和含铜绿假单胞菌的溶液中连续测试7 d的EIS谱图。从图4可以看出,无论是在无菌还是有菌的条件下,能奎斯特图中的阻抗弧半径在前24 h均随着时间的延长而急剧减小,随后1 d至7 d减小趋势大幅度减缓。由波德图可知,较低频率下的阻抗模值在前24 h急剧减小,随后1 d至7 d趋于平缓,变化规律与能奎斯特图相同。使用ZsimpWin拟合软件拟合EIS测试结果,采用的等效电路如图5所示,其中Rs为溶液电阻,Rct为电荷转移电阻,Rb为试样表面上形成的钝化膜/生物膜的电阻,电极和溶液之间的双电层电容非纯电容,因此用常相位角元件Q表示。拟合参数列于表2。溶液电阻和钝化膜电阻非常低并且随时间波动很小,因此Rct的变化是影响样品耐腐蚀性能的主要因素。从表2可以看出,在无菌环境中2205 DSS的Rct在24 h内由4.790×105 Ω·cm2迅速下降至4.324×104 Ω·cm2,在随后几天下降速度大幅度降低,7 d时降至2.463×104 Ω·cm2。在有菌环境中2205 DSS的Rct在24 h内由 2.681×105 Ω·cm2急剧下降至3.248×104 Ω·cm2,随后几天的下降速度也趋于平缓,7 d时降至1.715×104 Ω·cm2。EIS结果表明,2205 DSS在第1 d内腐蚀进程急剧加快,随后趋于平缓,但是随着时间的延长腐蚀仍然在不断进展。此外,在整个浸泡期的每个时间点有菌环境中的电阻值均小于无菌环境,说明铜绿假单胞菌的生命活动对钝化膜完整性的破坏更严重,从而导致样品的电阻值减小,腐蚀程度加深。
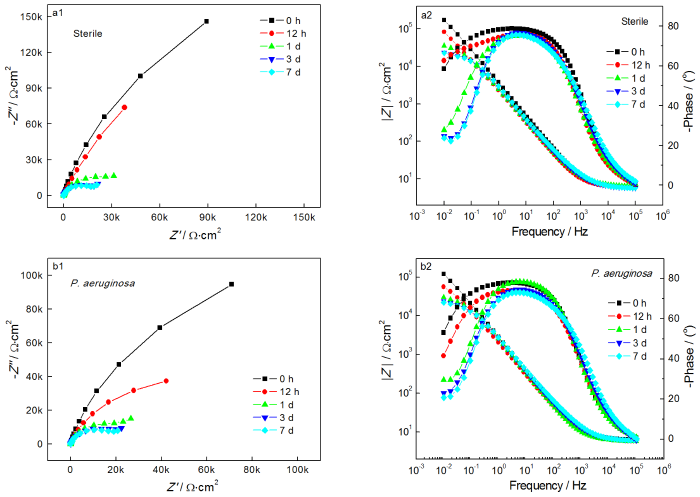
图4 2205 DSS在无菌溶液和有菌溶液中的能奎斯特图和波德图
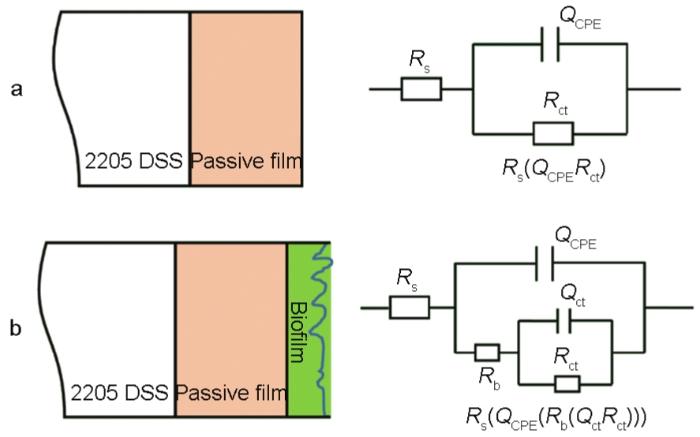
图5 用于拟合2205 DSS在无菌溶液和有菌溶液中阻抗谱的物理模型和相应的等效电路
表2 2205 DSS在无菌溶液和有菌溶液中的阻抗谱的拟合参数
2.4 动电位极化曲线
2205 DSS在无菌和有菌溶液中浸泡1 d,3 d和7 d的动电位极化曲线,如图6所示。对极化曲线进行拟合,相应的拟合参数列于表3。从图6可以看出,浸泡1 d,3 d和7 d后,与在无菌溶液中的测试结果相比,样品在有菌溶液中的极化曲线均明显右移。从表3可知,浸泡1 d后样品在有菌溶液中的ip(2.269 μA·cm-2) 明显大于无菌溶液中(1.490 μA·cm-2),且有菌溶液的维钝区间ΔE(1.7883 V)略小于无菌溶液的ΔE(1.8031 V),说明浸泡1 d后2205 DSS在有菌环境下的腐蚀比无菌环境更为严重。浸泡3 d后有菌溶液中样品的ip为2.917 μA·cm-2,明显大于无菌溶液中样品的ip(1.754 μA·cm-2),说明浸泡3 d后铜绿假单胞菌加速了2205 DSS的腐蚀。浸泡7 d后样品在有菌环境的自腐蚀电位(Ecorr)、击破电位(Epit)电位都略小于无菌环境,有菌溶液的ip(3.515 μA·cm-2)大于无菌溶液中ip(2.004 μA·cm-2),说明在浸泡7 d后2205 DSS样品在有菌溶液中的腐蚀更严重。浸泡1 d,3 d和7 d后的极化曲线进一步表明,铜绿假单胞菌的存在使表面钝化膜的破坏更严重,从而使样品的腐蚀程度更严重。
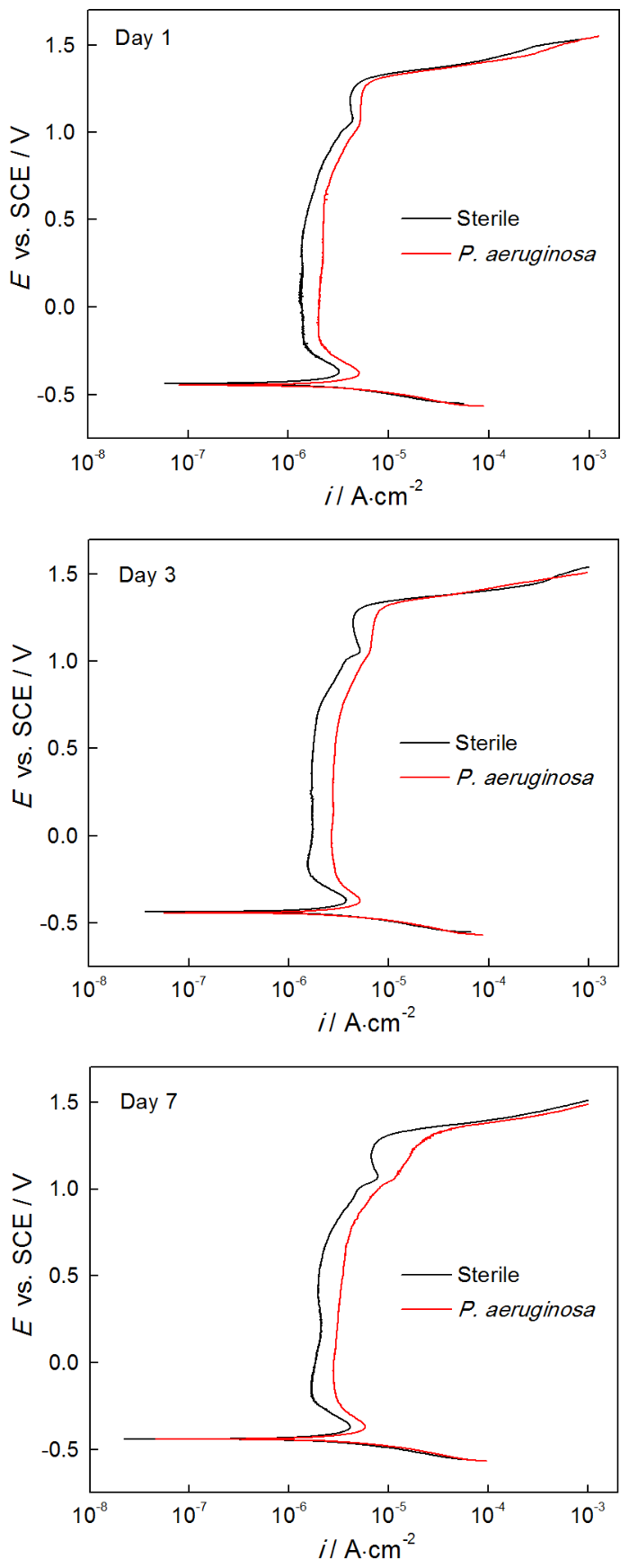
图6 2205 DSS在无菌和有菌溶液中浸泡1 d、3 d和7 d的动电位极化曲线
表3 2205 DSS动电位极化曲线的相关拟合参数
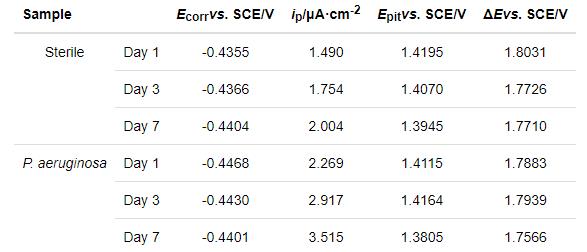
对2205 DSS不同工作面的电化学腐蚀结果作比较,将实验结果与文献[16]中的动电位极化曲线比较。可以发现,在无菌条件浸泡1 d时,文献中样品的维钝电流密度ip为0.74 μA·cm-2略小于本研究的ip (1.490 μA·cm-2);在有菌条件下,文献中的ip为2.86 μA·cm-2略大于本研究的ip(2.269 μA·cm-2)。但是,文献中样品在无菌条件浸泡1 d的击破电位为1.505 V (vs. SHE),有菌条件为1.112 V (vs. SHE),转换为相对于饱和甘汞电极电位,文献中样品在无菌条件浸泡1 d的击破电位为1.264 V (vs. SCE),有菌条件为0.871 V (vs. SCE),显著小于本文的击破电位(表3),说明本文用的工作面(即奥氏体的择优取向为(111)晶面)比文献报道的(即奥氏体的择优取向为(220)晶面)耐点蚀性能更佳。
2205 DSS样品在无菌溶液和有菌溶液中浸泡不同时间的动电位极化曲线,如图7所示。从图7可以看出,无菌环境中样品的极化曲线随着浸泡时间的增加而右移,其中1 d 时ip为1.490 μA·cm-2,3 d时ip为1.754 μA·cm-2,7 d时ip为2.004 μA·cm-2(表3)。由此可知,ip随浸泡时间延长而增大,说明在无菌环境下2205 DSS的腐蚀不断加剧。此外,从表3还可以看出,自腐蚀电位Ecorr,击破电位Epit和维钝区间ΔE随时间延长而减小,说明样品在无菌环境中随浸泡时间的延长更易腐蚀且耐点蚀性能下降。从图7还可以看出,2205 DSS在有菌环境下极化曲线随腐蚀时间延长右移,相应地样品在1 d 时ip为2.269 μA·cm-2,3 d时ip为2.917 μA·cm-2,7 d时ip为3.515 μA·cm-2(表3),由此可知维钝电流密度随时间的增加而不断增大。此外,由表3还可以发现,有菌环境下样品的击破电位Epit和维钝区间ΔE呈现随时间延长而减小的趋势,说明有菌环境下2205 DSS随浸泡时间增加而腐蚀不断加剧。
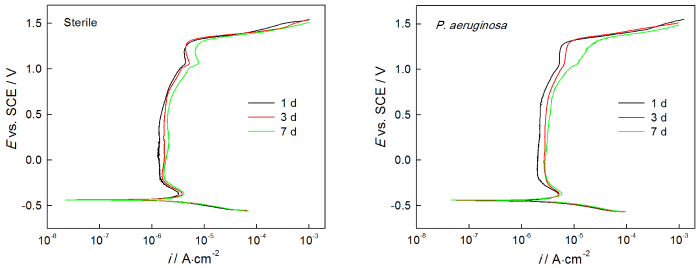
图7 2205 DSS在无菌溶液和有菌溶液中的动电位极化曲线
动电位极化曲线的结果说明,无论在无菌环境还是在有菌环境,2205 DSS的腐蚀均随着时间的延长而加剧,而在有菌环境下腐蚀加剧的程度更高。
2.5 极化后样品表面的分析
在动电位极化曲线测试结束后,对2205 DSS表面形貌进行观察,结果如图8所示。从图8可见,在无菌溶液中分别浸泡1 d,3 d和7 d后并极化的样品其表面形貌没有显著的差别,而在含铜绿假单胞菌的溶液中极化后样品表面粘附杆状铜绿假单胞菌。且随浸泡时间的延长,表面粘附的细菌量逐渐增多,浸泡3 d后样品表面的细菌发生聚集形成一个个小团簇,浸泡7 d后表面菌落簇的面积与厚度较3 d进一步增加,菌落聚集形成细菌生物膜。以上结果说明,在有菌溶液中2205 DSS表面易发生细菌粘附,且随浸泡时间的延长而聚集长大。细菌生物膜是金属产生MIC的主要因素,铜绿假单胞菌为好氧菌,消耗氧气,导致生物膜下方形成厌氧环境,从而阻碍了2205 DSS钝化膜的再钝化[18,19]。生物膜厚度是评估材料MIC的重要指标[20],可解释为什么在浸泡7d内2205 DSS在有铜绿假单胞菌的条件下腐蚀都随着时间的延长而加剧,且腐蚀速度高于无菌环境。

图8 动电位极化后2205 DSS样品表面的SEM形貌
去除2205 DSS样品表面生物膜和腐蚀产物后,用SEM观察无菌和有菌溶液中浸泡7 d并极化后的样品表面形貌(图9)。从图9可见,与无菌环境相比,有菌环境中样品表面形成的局部腐蚀面积和深度更大。用激光共聚焦扫描显微镜观测无菌和有菌溶液中浸泡7 d并极化后样品表面的局部腐蚀形貌及腐蚀坑深度,结果如图10所示。从图10(d)中可见,在无菌条件下浸泡7 d后样品的平均腐蚀坑深度为1.96 μm,明显小于有菌条件的坑深4.09 μm,进一步证明铜绿假单胞菌生物膜加速了2205 DSS的局部腐蚀。

图9 2205 DSS在无菌环境和有菌溶液浸泡7 d除去腐蚀产物和生物膜后表面的SEM形貌
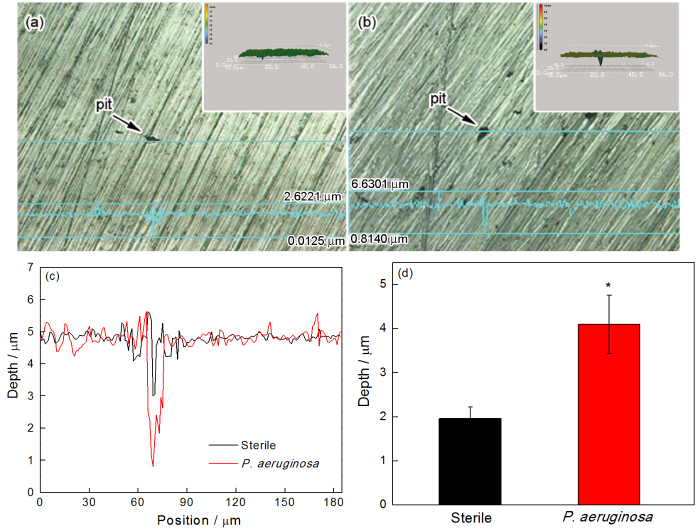
图10 2205 DSS在无菌环境和有菌溶液下浸泡7 d除去膜后的局部腐蚀形貌和局部腐蚀深度分析和平均腐蚀深度比较 (*P < 0.05 与无菌环境比较)
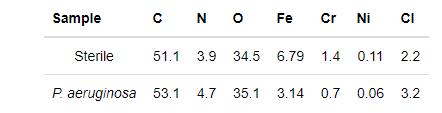
图11a给出了样品在无菌和有菌溶液中浸泡7 d后表面的XPS宽谱结果,表4列出了相应的样品表面的元素含量。从图11和表4可见,2205 DSS在铜绿假单胞菌溶液中Fe和Cr的相对含量均低于无菌溶液的,表明铜绿假单胞菌生物膜消耗了样品表面的Fe和Cr,而铁的氧化物以及铬的氧化物是钝化膜的主要成分,可见Fe和Cr的消耗不利于钝化膜的形成[20]。图11b和c分别给出了在无菌溶液和有菌溶液中浸泡7 d后2205 DSS表面的高分辨XPS Cr 2p谱。无菌溶液中样品的XPS的Cr 2p谱可拟合为Cr的四个特征峰,分别对应于Cr 2p 1/2谱中Cr(583.5 eV),Cr(OH)3(586.1 eV),Cr 2p 3/2谱的Cr(574.5 eV),Cr2O3(576.4 eV),而有菌溶液中样品的Cr 2p谱可拟合为Cr的五个特征峰,分别对应于Cr 2p 1/2谱中Cr(583.5 eV),Cr(OH)3(586.4 eV),Cr 2p 3/2谱中的Cr(574.4 eV),Cr2O3(576.4 eV)和CrO3(578.3 eV)[21,22],显然有菌溶液中2205 DSS在Cr 2p 3/2谱中有新的产物CrO3形成。
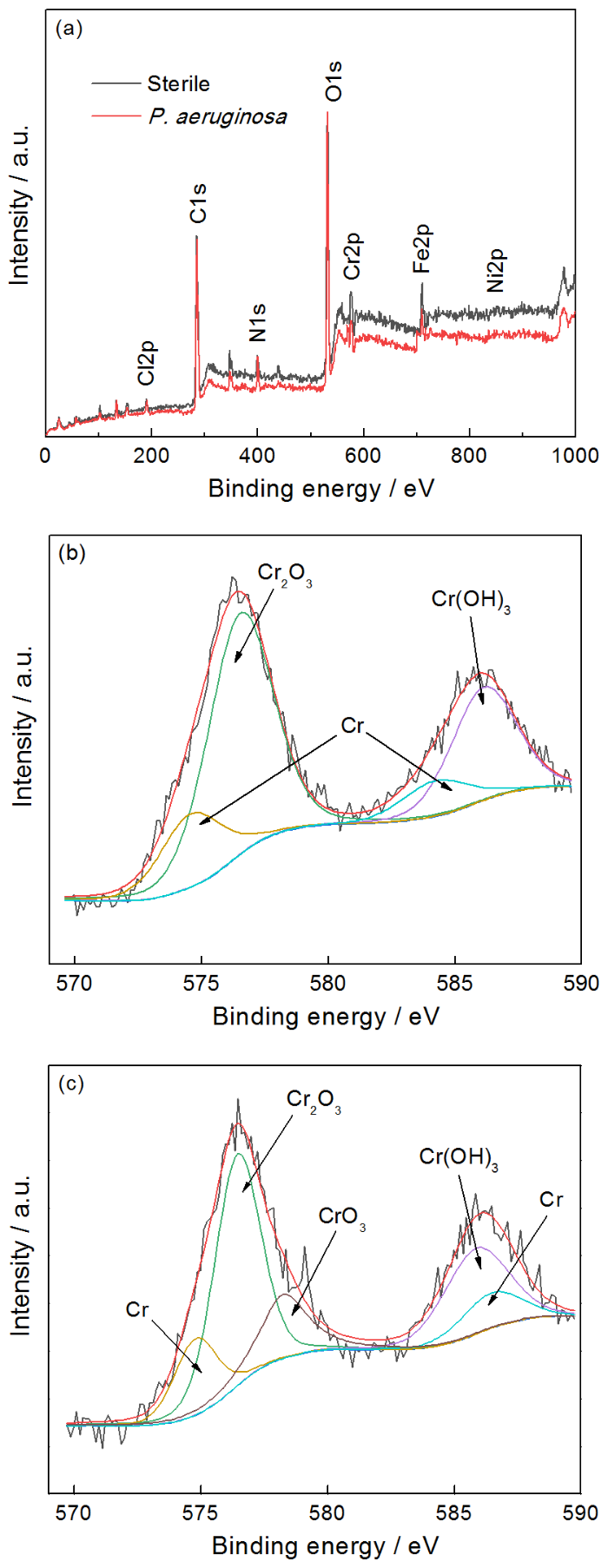
图11 2205 DSS在无菌环境和有菌环境下浸泡7 d后表面的XPS宽谱和高分辨XPS Cr 2p光谱
表4 2205 DSS在无菌和有菌环境下浸泡7 d后表面元素含量(原子分数,%)
XPS测试结果表明,与样品在无菌溶液中浸泡相比,2205 DSS在铜绿假单胞菌溶液中浸泡后表面形成CrO3。其原因是,铜绿假单胞菌的分泌物如绿脓菌素(PYO)可加速金属基体与铜绿假单胞菌间的电子转移,从而催化Cr氧化形成易溶于水的CrO3,进而加速表面钝化膜的溶解并加剧与生物膜接触的材料的局部腐蚀[23,24,25,26,27]。此外,2205 DSS在含铜绿假单胞菌溶液中随着浸泡时间的延长,表面粘附的细菌量逐渐增多,菌落簇的面积与厚度不断增加,最后聚集形成细菌生物膜,导致其耐腐蚀性能不断降低。
3 结论
具有(111)择优取向的岛状奥氏体相嵌入连续的铁素体基体的2205 DSS,在含铜绿假单胞菌溶液中的腐蚀速率显著比在无菌环境中的高。无论样品表面粘附少量细菌还是菌落聚集长大形成团簇或细菌生物膜,都加剧了2205 DSS的腐蚀,且粘附细菌数量的增加使腐蚀更趋严重。铜绿假单胞菌使样品表面形成溶于水的CrO3,破坏了2205 DSS钝化膜的完整性,使其耐局部腐蚀性能下降,腐蚀加剧。
参考文献
[1] SongZ, FengH, HuS. Development of Chinese duplex stainless steel in recent years [J]. Journal of Iron and Steel Research, International, 2017, 24: 121
[2] HanD, JiangY M, ShiC, et al. Effect of temperature, chloride ion and pH on the crevice corrosion behavior of SAF 2205 duplex stainless steel in chloride solutions [J]. Journal of Materials Science, 2011, 47(2): 1018
[3] WangL X, LiH B, LiG P, et al. Microstructural Evolution and Flow Behavior of 2205 and 2507 Duplex Stainless Steel during Double Pass Hot Compressive Deformation [J]. Chinese Journal of materials Research, 2016, 32(12): 888
[3] 王立新, 李花兵, 李国平等. 2205和2507双相不锈钢双道次热压缩条件下的微观组织演变及变形行为 [J]. 材料研究学报, 2016, 32(12): 888)
[4] AntonyP J, Singh RamanR K, MohanramR, et al. Influence of thermal aging on sulfate-reducing bacteria (SRB)-influenced corrosion behaviour of 2205 duplex stainless steel [J]. Corrosion Science, 2008, 50(7): 1858
[5] MoradiM, SongZ, YangL, et al. Effect of marine Pseudoalteromonas sp. on the microstructure and corrosion behaviour of 2205 duplex stainless steel [J]. Corrosion Science, 2014, 84: 103
[6] LiuW. Rapid MIC attack on 2205 duplex stainless steel pipe in a yacht [J]. Engineering Failure Analysis, 2014, 42: 109
[7] XuF L, DuanJ Z, LinC G, et al. Influence of Marine Aerobic Biofilms on Corrosion of 316L Stainless Steel [J]. Journal of Iron and Steel Research, International, 2015, 22(8): 715
[8] GabrielA A, UgayM C C F, SiringanM A T, et al. Atmospheric pressure plasma jet inactivation of Pseudomonas aeruginosa biofilms on stainless steel surfaces [J]. Innovative Food Science & Emerging Technologies, 2016, 36: 311
[9] ZhaoX D, WuP, JiangJ, et al. Study of effect of sulfate-reducing bacteria on corrosion interface between Q235 steel and sea mud [J]. Chinese Journal of Materials Research, 2007, 21(3): 230
[9] 赵晓栋, 吴 鹏, 姜 江等. 硫酸盐还原菌对海泥中Q235钢腐蚀界面的影响 [J]. 材料研究学报, 2007, 21(3): 230)
[10] BasheerR, GangaG, ChandranR K, et al. Effect of W-TiO2 composite to control microbiologically influenced corrosion on galvanized steel [J]. Appl Microbiol Biotechnol, 2013, 97(12): 5615
[11] MachucaL L, BaileyS I, GubnerR, et al. Effect of oxygen and biofilms on crevice corrosion of UNS S31803 and UNS N08825 in natural seawater [J]. Corrosion Science, 2013, 67: 242
[12] ZhaoY, ZhouE, LiuY, et al. Comparison of different electrochemical techniques for continuous monitoring of the microbiologically influenced corrosion of 2205 duplex stainless steel by marine Pseudomonas aeruginosa biofilm [J]. Corrosion Science, 2017, 126: 142
[13] XuD, XiaJ, ZhouE, et al. Accelerated corrosion of 2205 duplex stainless steel caused by marine aerobic Pseudomonas aeruginosa biofilm [J]. Bioelectrochemistry, 2017, 113: 1
[14] ZhaoY, ZhouE, XuD, et al. Laboratory investigation of microbiologically influenced corrosion of 2205 duplex stainless steel by marine Pseudomonas aeruginosa biofilm using electrochemical noise [J]. Corrosion Science, 2018, 143: 281
[15] XuD, ZhouE, ZhaoY, et al. Enhanced resistance of 2205 Cu-bearing duplex stainless steel towards microbiologically influenced corrosion by marine aerobic Pseudomonas aeruginosa biofilms [J]. Journal of Materials Science & Technology, 2017, 34(8): 1325
[16] LiP, ZhaoY, LiuY, et al. Effect of Cu Addition to 2205 Duplex Stainless Steel on the Resistance against Pitting Corrosion by the Pseudomonas aeruginosa Biofilm [J]. Journal of Materials Science & Technology, 2017, 33(7): 723
[17] Chinese National Standards,Method of nitric-hydrofluoric acids test for stainless steel,GB/T4334. 4–2000. [M]
[18] AbdulkareemE H, MemarzadehK, AllakerR P, et al. Anti-biofilm activity of zinc oxide and hydroxyapatite nanoparticles as dental implant coating materials [J]. J Dent, 2015, 43(12): 1462
[19] ZhouH, WeirM D, AntonucciJ M, et al. Evaluation of three-dimensional biofilms on antibacterial bonding agents containing novel quaternary ammonium methacrylates [J]. International Journal of Oral Science, 2014, 6(2): 77
[20] LiH, YangC, ZhouE, et al. Microbiologically influenced corrosion behavior of S32654 super austenitic stainless steel in the presence of marine Pseudomonas aeruginosa biofilm [J]. Journal of Materials Science & Technology, 2017, 33(12): 1596
[21] YuanS J, PehkonenS O. Microbiologically influenced corrosion of 304 stainless steel by aerobic Pseudomonas NCIMB 2021 bacteria: AFM and XPS study [J]. Colloids and Surfaces B: Biointerfaces 2007, 59: 87
[22] ZhouE, LiH, YangC, et al. Accelerated corrosion of 2304 duplex stainless steel by marine Pseudomonas aeruginosa biofilm [J]. International Biodeterioration & Biodegradation, 2018, 127: 1
[23] XiaJ, XuD K, NanL, et al. Study on Mechanisms of Microbiologically Influenced Corrision of Metal from the Perspective of Bioelectrochemistry and Bio-energetics [J]. Chinese Journal of Materials Research, 2016, 30 (3): 161
[23] 夏 进, 徐大可, 南 黎等. 从生物能量学和生物电化学角度研究金属微生物腐蚀的机理 [J]. 材料研究学报, 2016, 30 (3): 161)
[24] ChenG, ClaytonC R. The Influence of Sulfate-Reducing Bacteria on the Passivity of Type 317L Austenitic Stainless Steel [J]. Journal of The Electrochemical Society, 1998, 145(6): 1914
[25] LiH, ZhouE, ZhangD, et al. Microbiologically Influenced Corrosion of 2707 Hyper-Duplex Stainless Steel by Marine Pseudomonas aeruginosa Biofilm [J]. scientific reports, 2016, 6: 20190
[26] YongX Y, FengJ, ChenY L, et al. Enhancement of bioelectricity generation by cofactor manipulation in microbial fuel cell [J]. Biosens Bioelectron, 2014, 56: 19
[27] YongX Y, ShiD Y, ChenY L, et al. Enhancement of bioelectricity generation by manipulation of the electron shuttles synthesis pathway in microbial fuel cells [J]. Bioresour Technol, 2014, 152: 220
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





