0 引言
镁及镁合金具有良好的生物相容性、可降解性与力学性能,作为生物可降解骨植入材料得到了广泛关注[ 1]。但镁活泼的化学性质限制了其在这一领域的应用。微弧氧化是一种减缓镁腐蚀的有效方法[ 2]。微弧氧化层的存在使镁合金在生理环境中的耐蚀性得到明显的提高。然而,一方面由于作为微弧氧化层的主要成分MgO不能诱导羟基磷灰石形成,导致微弧氧化层具有较低的生物活性[ 3],另一方面,微弧氧化层多孔的结构难以对镁提供持续的防护[ 4]。
为提升镁的耐蚀性能与生物性能,并保持体系的可降解性,采用阴极电沉积的方法在微弧氧化的镁表面构建钙磷生物涂层。一方面,利用钙磷涂层促进微弧氧化镁的生物活性,另一方面, 利用钙磷涂层对微弧氧化层进行封孔,增加体系的耐蚀性能[5]。钙磷涂层的成分与人骨组织中的无机成分羟基磷灰石( Hydroxyapatite,HA) 相近,可以诱导HA的再沉积,有助于骨组织的修复和再生[6]。羟基磷灰石尽管生物相容性良好, 但在体液中溶解度很低,不利于降解。除了HA外,其他钙磷组分被认为是HA在体液中的前驱体。尤其是二水合磷酸氢钙( Calcium hydrogen phosphate dihydrate, DCPD),在体液中的溶解度很高,其溶解转化后会促进HA的形成[7]。 Shi等[8] 尝试在微弧氧化AZ80 镁合金表面制备DCPD涂层,该涂层体系有效地诱导了HA在镁合金表面的沉积。尽管在浸泡后表面出现了一些裂纹,但氢气析出量的测试表明体系腐蚀性能并没有出现明显的降低。钙磷相的转化过程对促进骨愈合, 保持植入材料的降解具有重要作用[9]。
目前,镁表面复合涂层体系的报道多集中在涂层的腐蚀性能上[10]。有关钙磷涂层在微弧氧化层表面的沉积过程及涂层之间协同作用的报道较少。此外,由于制备方法、工艺参数以及电解液选择存在差别,各研究所报道的涂层的腐蚀性能也不尽相同[11-12]。文中主要研究涂层在模拟体液( SBF) 和细胞培养液中的生物性能。详细地讨论了钙磷相在微弧氧化层表面的形成过程,以及钙磷层及微弧氧化层之间的协同作用对体系性能的影响。
1 试验
1.1 涂层制备
选择商业用纯镁(纯度99.9%)为研究材料, 试样尺寸为15 mm× 15 mm× 3 mm。采用400~2500 号SiC砂纸对试样进行打磨,然后用乙醇清洗2 min。利用直流单向脉冲电源对镁片进行微弧氧化(MAO)处理。镁片为阳极,不锈钢板为阴极,电参数为恒电压模式400 V,频率100 Hz,占空比10%。电解液组成为20 g Na3PO4 + 1 g KOH。处理时间10 min。之后,对微弧氧化镁进行阴极电沉积。石墨板为阳极,沉积电解液为0.0835 mol/L Ca(NO3)2 +0.05 mol/L KH2PO4 的混合溶液,溶液pH值调整至4.6。在初始电流密度为4.2 mA/cm 2,温度为47℃,沉积电压为3.5 V的条件下沉积60 min。
1.2 结构表征及电化学性能测试
采用XRD、SEM、EDS和激光共聚焦显微镜(CLSM)对涂层组织结构和形貌进行观察分析。采用Gamry R3000 电化学工作站对涂层的电化学性能进行评价(包括动电位极化曲线和电化学阻抗谱测试)。测试介质为模拟体液( SBF),成分见参考文献[13],测试温度为(37±0.5)℃。测试前将试样浸泡在SBF中30 min,使试样表面状态达到稳定。动电位极化曲线的测试从开路电位以下0.2 V开始,终止电流密度为2 mA/cm 2,扫描速率为0.5 mV/s。采用Corrview软件对测得的极化曲线进行拟合。电化学阻抗谱(EIS)测量频率范围为10 5~10-2 Hz。输入信号为开路电位上下扰动10 mV。采用Zsimpwin软件对阻抗谱进行拟合。
1.3 生物性能测试
对涂层生物性能的评价包括骨形成能力和细胞黏附能力。骨形成能力试验时,将涂层分别浸泡到SBF和组织液中,观察涂层的组织结构变化及HA沉积状况。细胞黏附试验时,将涂层浸泡到细胞培养液中,在涂层表面植入50 000 个髋关节组织细胞,细胞中添加染色剂,采用光学显微镜观察细胞的增殖状况。
2 结果与讨论
2.1 涂层结构特征
涂层的物相组成如图1 所示。微弧氧化层的相组成是Mg3(PO4)2 和MgO。钙磷涂覆后,涂层的主要成份是二水合磷酸氢钙(DCPD)。
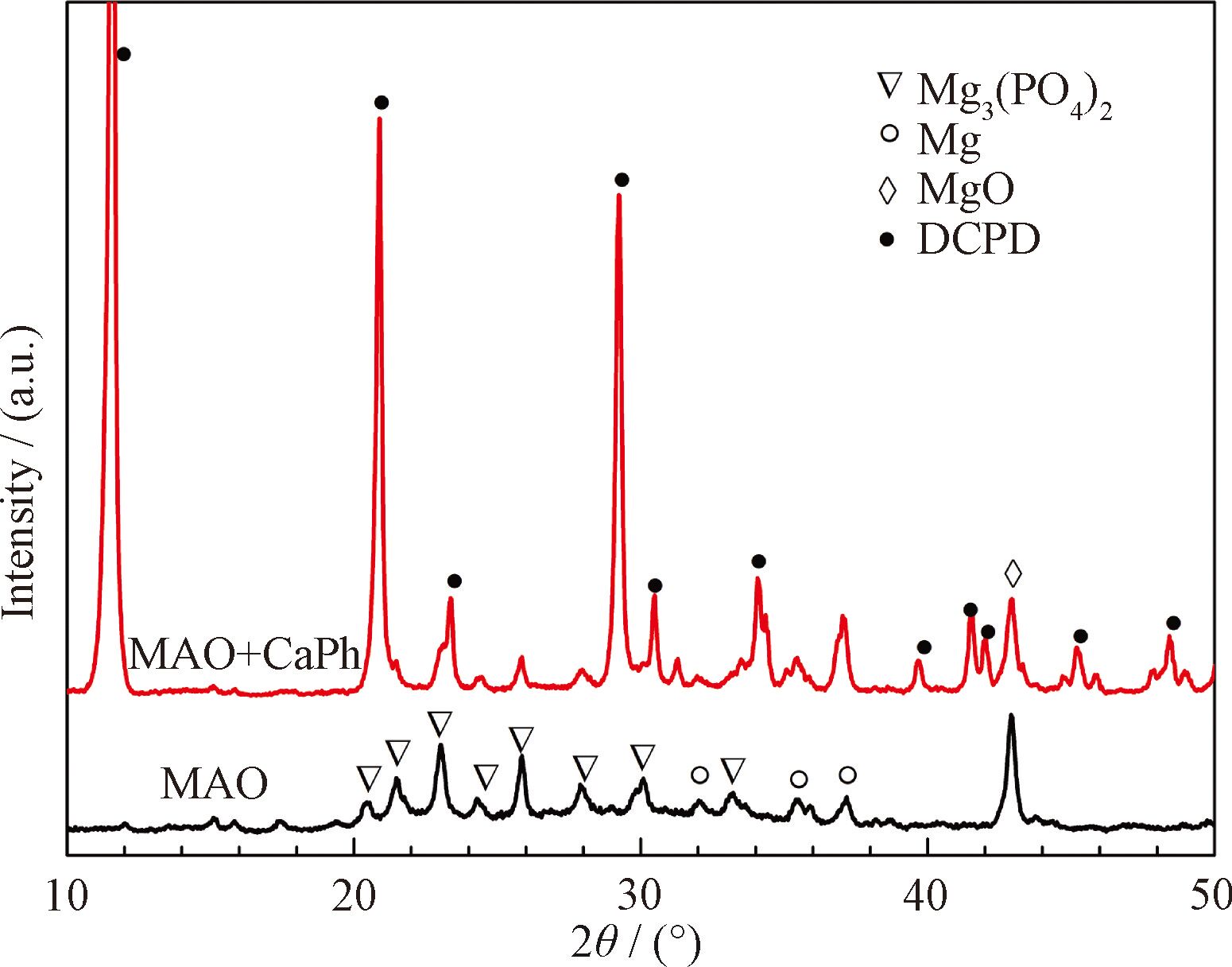
图1 钙磷涂覆前后微弧氧化镁的XRD图谱
涂层的表面和截面形貌如图2 所示。微弧氧化层表面呈现出多孔结构,微孔不均匀地分布在试样表面(图2(a))。在表面可以观察到少量的裂纹,这是由于在陶瓷层成膜过程中电解液的冷却作用导致的[14]。
微弧氧化层的截面形貌(图2(c))呈现明显的双层结构,约为1~2 μm的内部致密层均匀地形成在镁基体表面,外部多孔层存在着大量的微孔和放电通道(Discharge channels),其厚度约为25 μm。
钙磷涂层形貌为片状结构(图2( b)),其尺寸大约在几十微米,呈现出典型的DCPD形貌特征[15]。
涂层的横截面显示钙磷层的厚度约为15 μm( 图2( d)),其中,微弧氧化外层的微孔几乎完全被钙磷相填充,钙磷层和微弧氧化层交错结合在一起,表现出良好的界面结合状况。
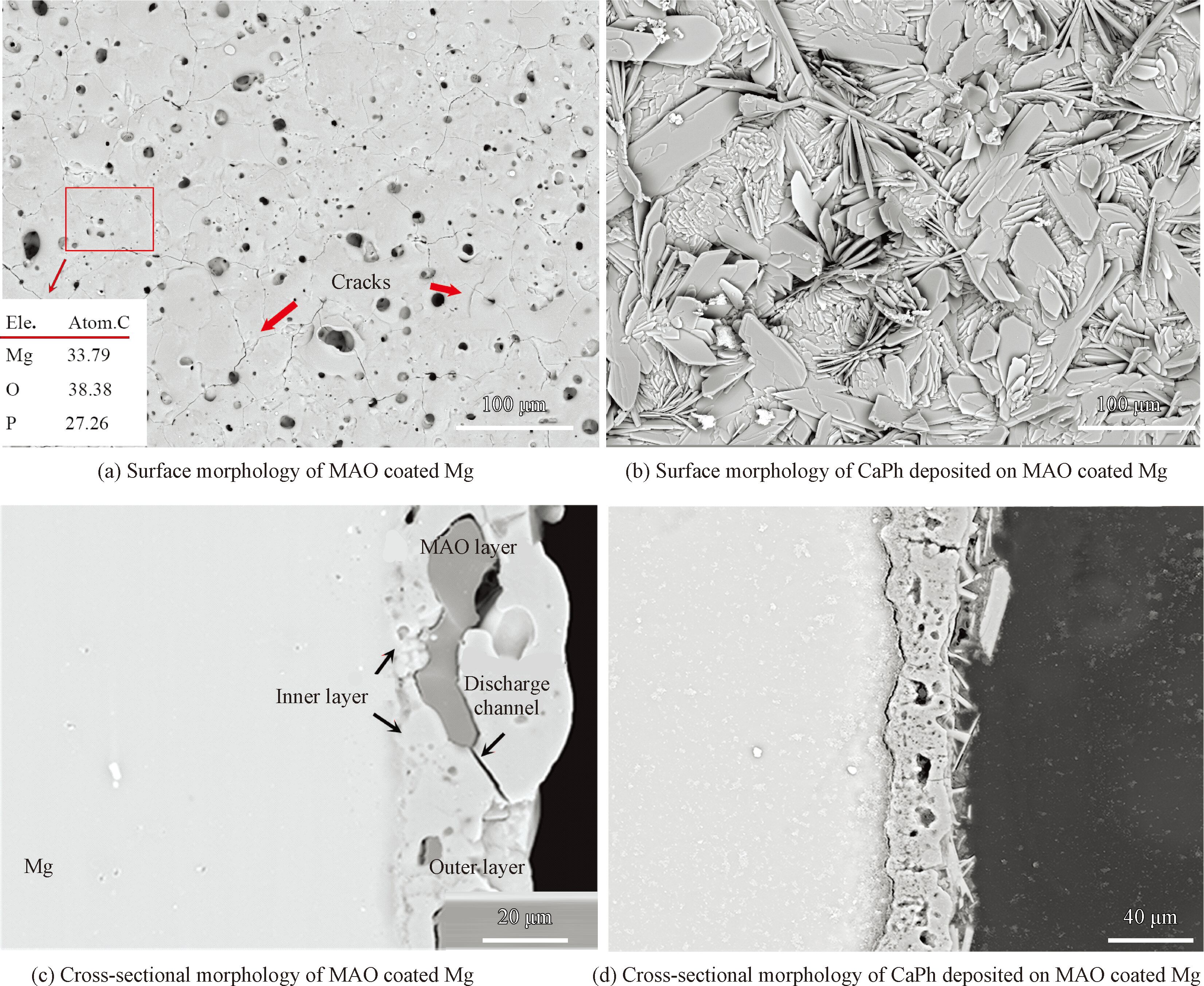
图2 钙磷涂覆前后微弧氧化镁的表面和截面形貌
2.2 DCPD在微弧氧化层上的沉积机制
由于涂层中不存在HA或磷酸八钙(Octacalcium phosphate, OCP) 等含有PO 3- 4 基团的化合物,沉积过程中电解液中的H2PO- 4 只需一步水解,即可与Ca2+相结合生成DCPD,形成过程并不复杂,如反应式(1)~(3)所示:
为了便于讨论DCPD在微弧氧化镁表面的形核规律,观察了不同沉积时间(5 和30 s) 下DCPD的形核位置及分布规律,如图3 所示。同时,采用EDS扫描Ca元素的分布图(Elemental mapping)。值得注意的是, 在电场的作用下,DCPD在微弧氧化层表面的形核长大并不是随机发生的。沉积开始时,形核的位置主要集中在微弧氧化层表面的微孔处(图3( a)),对应的钙元素分布图中可见微孔附近Ca的分布较多(图3( c))。随沉积时间的增加,微弧氧化层表面的Ca分布越来越多(图3(d)),意味着DCPD不断聚集长大(图3(b))。由于微弧氧化层的结构特点,其微孔结构可分为通孔和半封闭孔,此外,高压下形成的微弧氧化层中还存在大量的放电通道(图2(c))。这些通孔和放电通道为电沉积过程提供了离子交换通道。沉积开始时, DCPD在电场力作用下优先在通孔位置沉积。与此同时,微弧氧化层的MgO在弱酸性的电解液中会发生部分溶解,其反应如方程式(4)所示:
(4)
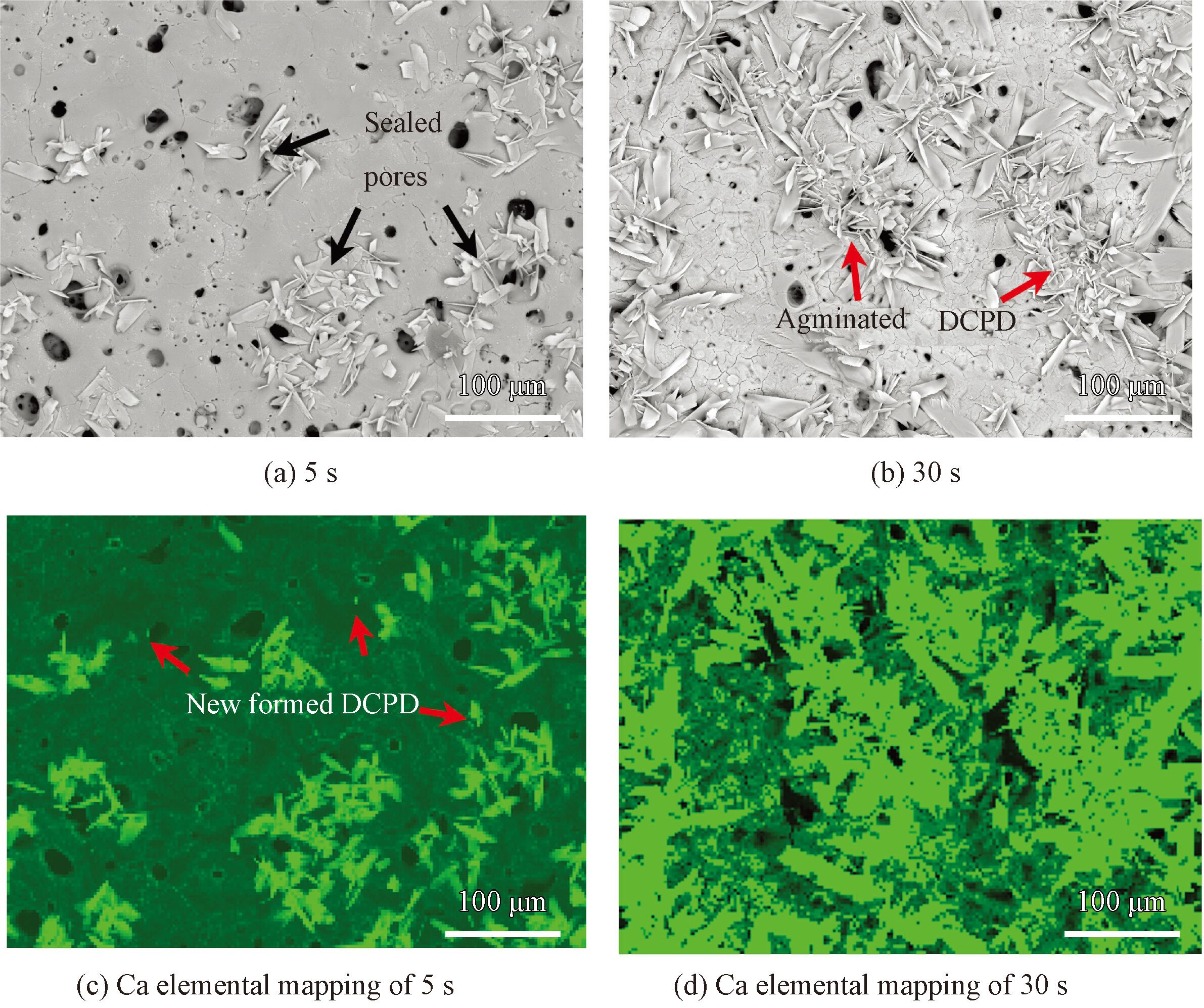
图3 沉积不同时间下DCPD的SEM形貌与对应的元素分布图
微弧氧化层的溶解使涂层中的半封闭孔暴露在电解液中,成为通孔。这为离子的交换提供了更多的通道,使DCPD持续沉积并覆盖整个表面。最终在微弧氧化层表面形成一层均匀的DCPD。
2.3 涂层的电化学腐蚀行为
钙磷涂覆前后微弧氧化镁的电化学阻抗谱及相应的等效电路如图4( a)~4( d) 所示[16]。 Bode图表明,微弧氧化试样在0~48 h内呈现出3 个时间常数(图4(a)),分别分布在高频(10 3~10 4 Hz)、中频(1~10 2 Hz)和低频(10-2~1 Hz)区域。 3 个时间常数分别涉及微弧氧化外层、内层和基体与涂层之间的双电层在体系中的电化学响应。钙磷涂覆后,阻抗谱图仍呈现出3 个时间常数(图4( c)),但其所代表的物理意义发生了变化。高频的时间常数代表钙磷层和微弧氧化外层相结合的电化学响应,中频和低频分别代表微弧氧化内层和双电层的电化学响应。
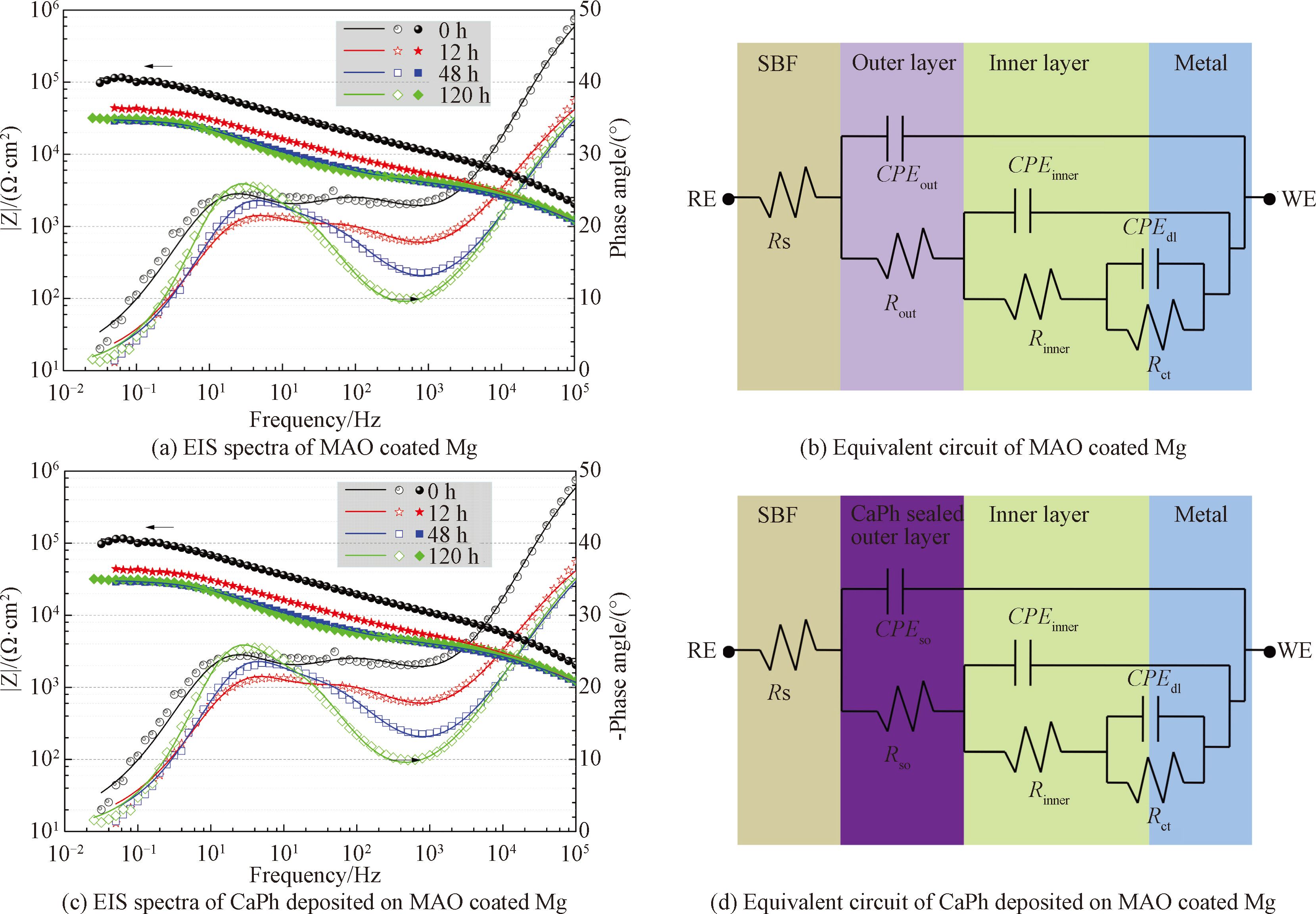
图4 复合涂层在SBF中的电化学阻抗谱和相应的等效电路[16]
在图4(b)和4( d)的等效电路中,R 与 CPE 分别代表各自元件对应的极化电阻值与常相位元件值。其中,Rs 为溶液电阻,Rout、 CPEout、Rinner 与 CPEinner 分别表示微弧氧化外层和内层的极化电阻值与电容值。 Rso 与 CPEso 分别表示钙磷涂覆后微弧氧化外层的极化电阻值与电容值。 Rct 与 CPEdl 分别表示镁基体和微弧氧化层之间的电荷转移电阻和双电层电容。
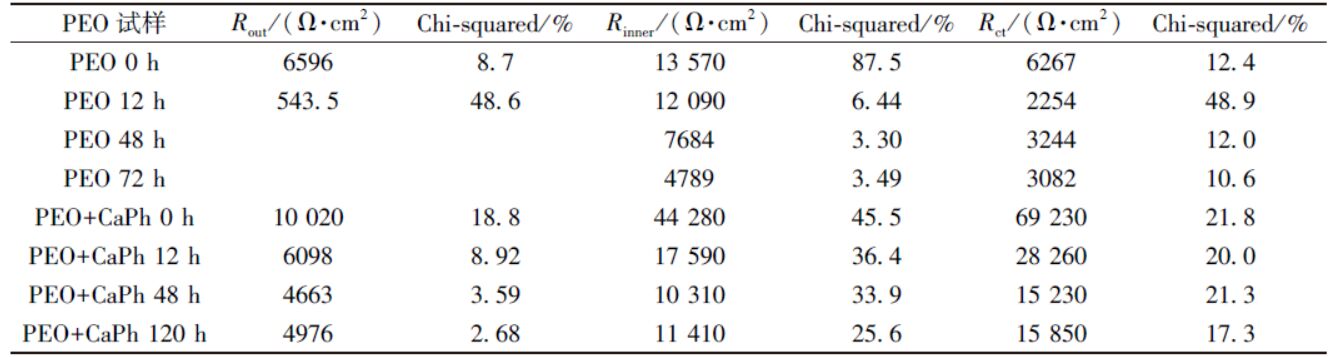
低频的阻抗模值可以反应体系的耐蚀性能。通常镁及镁合金的阻抗模值仅为10 3 Ω·cm 2 左右,在SBF浸泡过程中阻抗模值通常迅速降低[17]。微弧氧化试样浸泡初期(0 h)低频阻抗模值为3×10 4 Ω·cm 2。在6 h内下降到10 4 Ω·cm 2左右,但在随后的浸泡过程中基本保持稳定。对于大多数的生物植入材料而言,在植入初期耐蚀性能下降最为明显。此后,腐蚀产物和HA的沉积会阻止腐蚀介质与基体的接触,阻抗模值会在一定的时间范围内保持不变。钙磷涂覆后,试样的低频阻抗模值达到了10 5 Ω·cm 2,表明体系的耐蚀性能得到进一步提升。阻抗模值在0~12 h内下降到4×10 4 Ω·cm 2,之后几乎保持不变,表现出了稳定的耐蚀性能。拟合后各元件的总电阻值(钙磷层、微弧氧化层和双电层拟合后电阻值的总和)如图5 所示,其变化趋势与低频阻抗模值变化趋势相同,在浸泡初期总电阻值快速下降, 而后基本保持不变,进一步说明了复合涂层在SBF中耐蚀性能较为稳定。拟合后各元件极化电阻值及相应误差如表1 所示。各元件所对应阻抗均呈现出缓慢下降的趋势,拟合误差较低, 说明采用的等效电路与试样的阻抗谱图匹配良好。
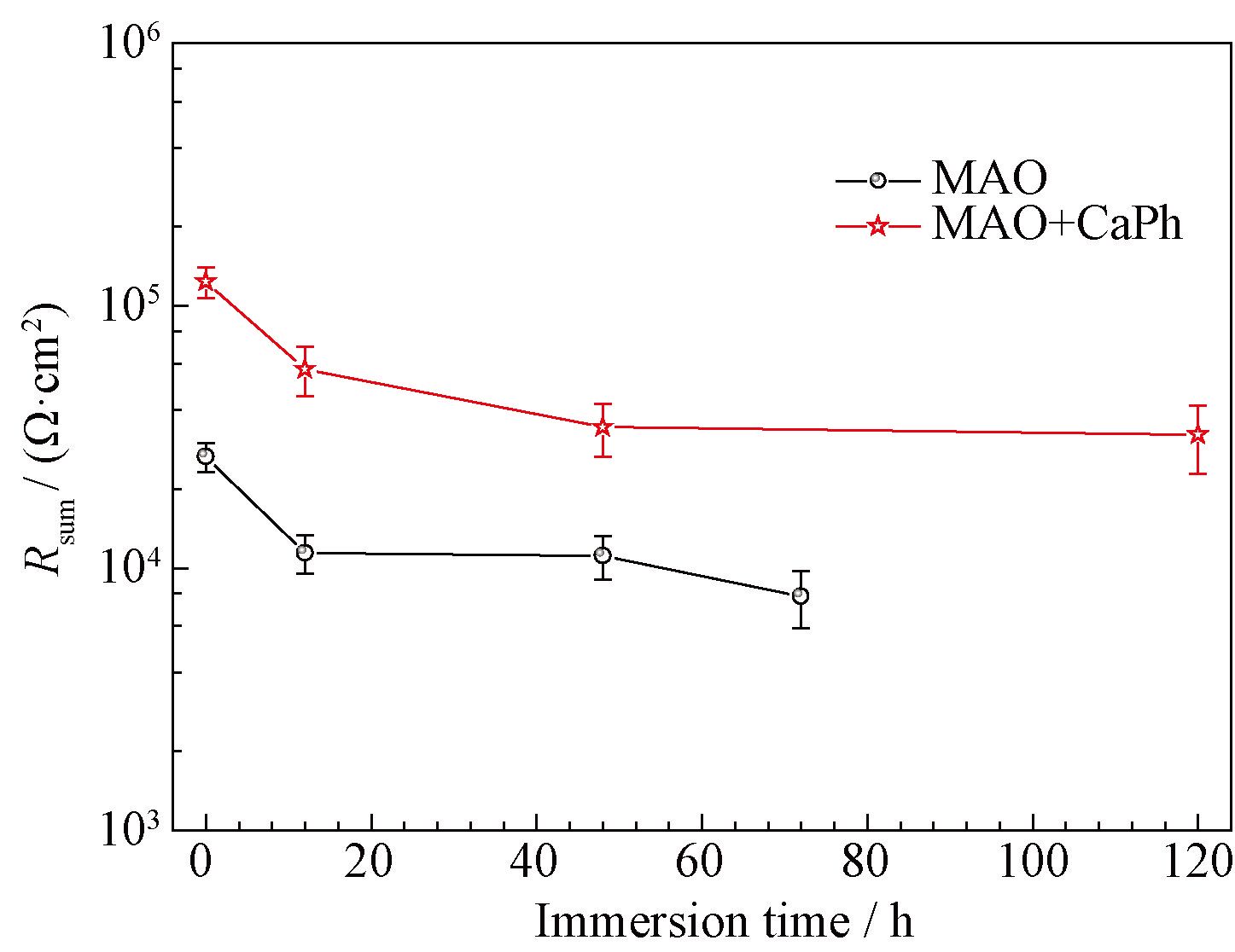
图5 钙磷涂覆前后微弧氧化镁的总极化电阻值
表1 电化学阻抗谱图的拟合结果
钙磷涂覆前后的动电位极化曲线如图6 所示。纯镁的腐蚀电流密度( i corr) 和腐蚀电位(Ecorr)仅为(1.74±0.52) × 10-4 A·cm-2和-1.92 V。经微弧氧化处理后,i corr 下降了约2 个数量级, Ecorr 上升了200 mV。钙磷涂覆试样的 i corr 略有下降,Ecorr 则继续上升了约200 mV。该试样在SBF中浸泡120 h后,Ecorr 降低了60 mV,但 i corr没有明显变化。说明在120 h浸泡过程中,腐蚀速率并没有显著增加。 EIS和极化曲线结果表明复合涂层大幅度提升了镁基体的耐蚀性能。
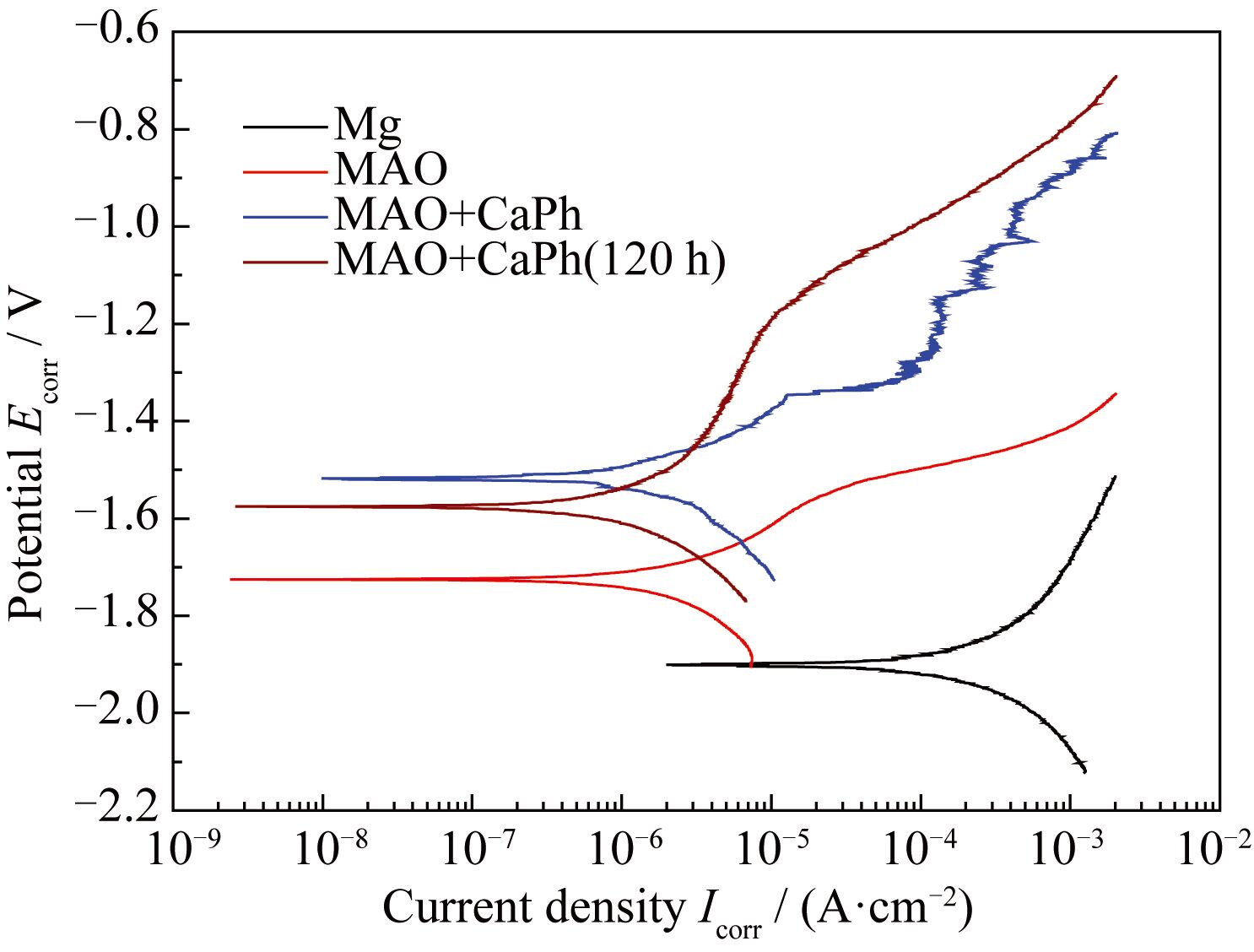
图6 涂覆前后镁在SBF中的动电位极化曲线
2.4 涂层的生物性能
为了评价涂层的骨形成能力,钙磷涂覆的微弧氧化镁被分别浸泡在SBF和细胞培养液中。在SBF中浸泡120 h后涂层的表面形貌和物相组成分别如图7(a)和7(b)所示。浸泡后DCPD片的尺寸明显减小,XRD结果表明,DCPD衍射峰的相对强度明显降低,与此同时,发现了新的HA衍射峰。这表明随着DCPD的溶解,HA逐渐沉积到试样表面。
在细胞培养液中浸泡14 d后的表面形貌如图8(a)和8(b)所示。图中仍可以清晰地观察到DCPD的片状结构,且其尺寸没有明显的变化。在高的放大倍数下(图8(b))可以观察到球状和菜花状结构。 EDS分析结果表明,该结构中所含有的钙磷元素原子百分比约为1.6。同样比例的钙磷结构在其他研究中也有报道,其为典型的类骨羟基磷灰石组织结构[18]。
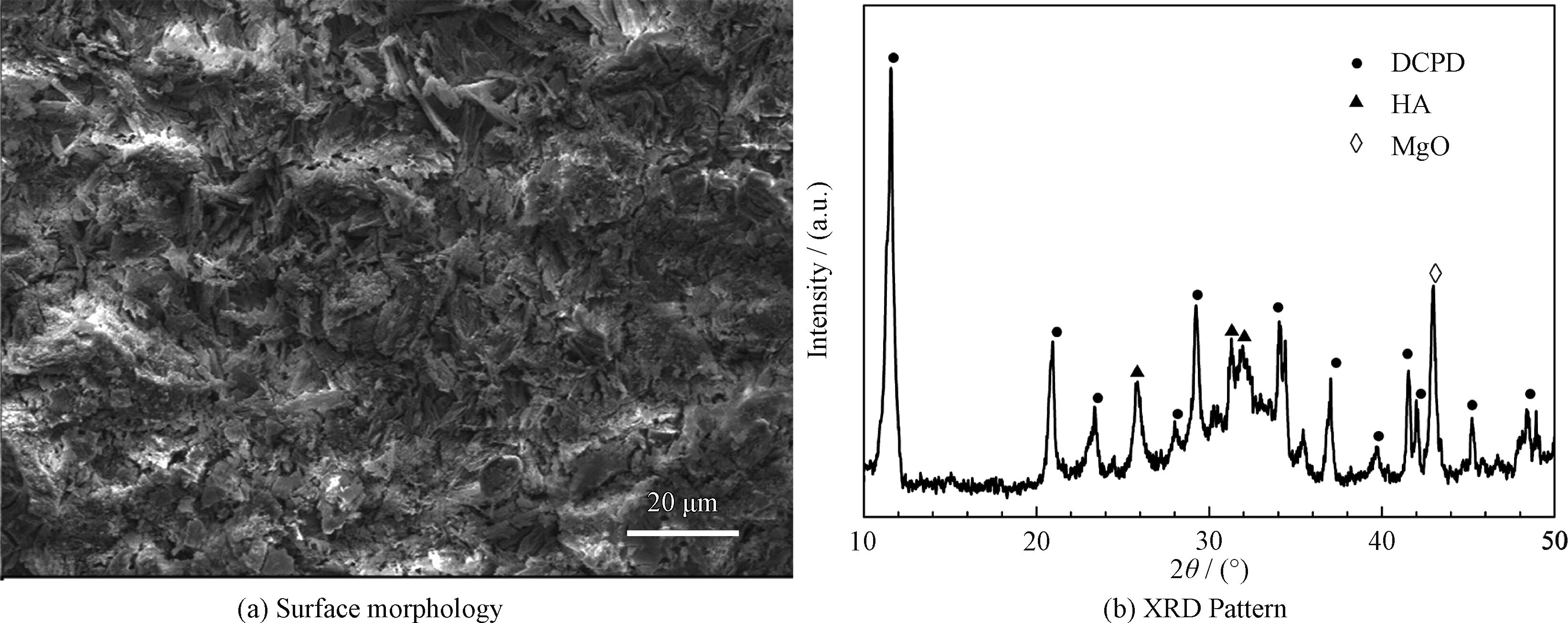
图7 复合涂层在SBF中浸泡120 h后的表面形貌和XRD图谱

图8 复合涂层在细胞培养液中浸泡14 d后的表面形貌
浸泡试验结果表明,无论是在SBF还是细胞培养液中,涂层均表现出了诱导HA沉积的能力。 DCPD在弱碱性体液中的溶解度较高,溶解后依据反应式(5)及(6)在涂层表面附近释放出一定量的Ca2+和PO 3- 4。试样表面局部钙磷离子浓度的升高,会促进HA的沉积,如反应式( 7) 所示:
有所不同的是,通过比较DCPD在两种介质中的结构演化发现,DCPD在SBF中的溶解速率更快,从而更易于诱导HA沉积在试样表面。由于SBF的化学成分与细胞培养液中的无机成分相似,其主要用于评估HA的体外沉积能力,与体液中蛋白物质的氧化还原和细胞间反应无关。同时,SBF溶液每2 d更换一次,及时地补充了试样表面由于HA沉积所消耗的Ca和P原子,从而加速了HA的沉积过程。因此, 在SBF中DCPD的溶解和HA的转化速率更快。
在细胞培养液中培养14 d后的细胞黏附情况如图9 所示。大量的活细胞黏附在了涂层表面,且细胞形状狭长,表明细胞在培养后出现了的增殖分化,表现出了良好的细胞黏附和增殖分化能力。研究报道,与镁的氧化物或无机盐相比,细胞的丝状伪足更优先于在钙磷相上沉积[19]。从图9 中可以观察到,黏附的细胞呈带状或者网状分布,其特征与DCPD的结构相似,可以推断,细胞更优先地在钙磷物相上粘附。此外,细胞的黏附还与涂层的表面状态和腐蚀性能有关[20]。在整个培养过程中,DCPD不断地溶解并转化成HA,在一定程度上降低了细胞在涂层上的黏附数量。但由于体系的耐蚀性较高, DCPD向HA转化进行缓慢,保持了表面状态的稳定性,因而对细胞在表面粘附影响有限。
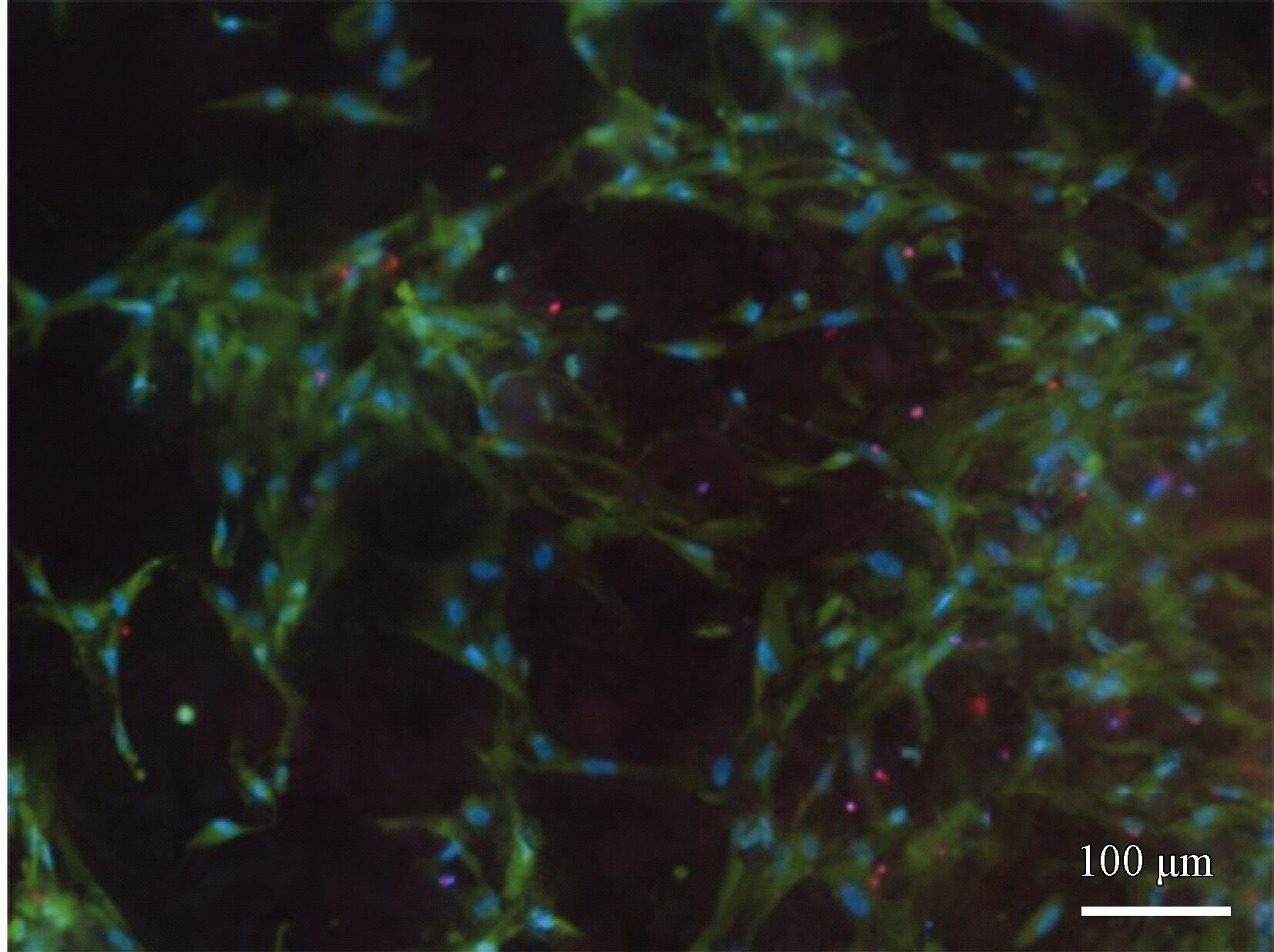
图9 复合涂层在细胞培养液中浸泡14 d后的细胞粘附
2.5 复合涂层的耐蚀性及生物活性
作为骨植入材料,钙磷涂层具有明显的优势。 DCPD被认为是HA在体液中的前驱体,拥有较高的Gibbs自由能,在模拟体液中浸泡后可以溶解释放出Ca2+ 和PO 3- 4,诱导HA形成[21]。这一过程对于促进骨愈合、诱导骨生长具有显著的作用。因此,研究者们更愿意尝试在镁表面构建DCPD涂层,而不是直接沉积HA涂层[22]。但直接在镁表面沉积DCPD并不是最佳选择,由于涂层与镁基体靠物理吸附,两者之间的结合力较差,DCPD在体液中的快速溶解伴随部分脱落会导致镁基体裸露在腐蚀介质中,从而造成基体的快速腐蚀失效。
采用微弧氧化与电沉积相结合的复合涂层可以有效地解决这一问题。微弧氧化层的存在,不仅阻碍了腐蚀介质的渗透,提高了镁的耐蚀性,而且其粗糙的表面为钙磷相的形核提供了更多的位置。此外,微弧氧化层和钙磷层之间通过机械交错咬合(图2( d)),可有效提高涂层与基体的结合力,从而降低DCPD在SBF和细胞培养液中的溶解速率,使整个涂层体系可以稳定降解。在浸泡初期,由于DCPD层的封孔作用,延缓了腐蚀介质的快速渗透,提高了涂层体系的耐蚀性。随着浸泡时间的延长,尽管DCPD的溶解会加速涂层体系的腐蚀,但由于促进了HA的沉积,在一定程度上保持了体系的稳定性。
毫无疑问,体系的耐蚀性能对其骨形成和细胞黏附过程起到至关重要的影响。以往有关DCPD涂层细胞黏附报道较少的主要原因是涂层体系的腐蚀性能较差,腐蚀反应阻碍了HA的沉积和细胞丝状伪足的吸附[23]。通过构建微弧氧化和钙磷复合涂层,强化了涂层与基体之间的界面结合,提升了体系的稳定性。保证了DCPD向HA转化和细胞丝状伪足的黏附过程的平稳进行。在细胞培养液中浸泡14 d后,仍可观察到DCPD的存在,同时观察到类骨状HA结构(图8(b)),活细胞几乎分布在整个复合涂层试样的表面(图9), 表现出了良好的骨形成和细胞黏附能力。
3 结论
采用微弧氧化和电沉积相结合的方法,在镁表面制备了微弧氧化层及钙磷复合涂层,通过复合涂层组织及性能研究,得到的主要结论如下。
(1) 微弧氧化层的相组成为Mg3( PO4)2 和MgO,钙磷涂层的主要相结构为DCPD;钙磷相优先在微弧氧化层中的通孔和放电通道处形核,钙磷相的沉积对微弧氧化层起到封孔作用,钙磷层和微弧氧化层之间通过机械咬合方式结合在一起。
(2) 复合涂层表现出较高的耐蚀性能和生物活性,与未涂覆的镁基体相比,腐蚀电位上升了400 mV,腐蚀电流密度降低了约3 个数量级, 在SBF中浸泡120 h后的阻抗测量过程中,体系总极化电阻值稳定在4×10 4 Ω·cm 2。
(3) 在SBF及细胞营养液的浸泡过程中, DCPD逐渐溶解并促进类骨状HA在涂层表面析出,涂层表现出良好的细胞活性,活细胞几乎粘附在整个涂层表面。
参考文献
[1] STAIGER M P,PIETAK A M,HUADMAI J,et al.Magne-sium and its alloys as orthopedic biomaterials:A review[J].Biomaterials,2006,27:1728-1734.
[2] YANG J J,LU X P,BLAWERT C,et al.Microstructure and corrosion behavior of Ca/P coatings prepared on magnesi-um by plasma electrolytic oxidation[J].Surface & Coatings Technology,2017,319:359-369.
[3] KHALAJABADI S Z,KADIR M R A,IZMAN S,et al.The effect of MgO on the biodegradation,physical properties and biocompatibility of a Mg/HA/MgO nanocomposite manufac-tured by powder metallurgy method [J].Journal of Alloys and Compounds,2016,655:266-280.
[4] GAO J H,GUAN S K,CHEN J,et al.Fabrication and characterization of rod-like nano-hydroxyapatite on MAO coat-ing supported on Mg-Zn-Ca alloy[J].Applied Surface Sci-ence,2011,257:2231-2237.
[5] TIAN P,LIU X,DING C.In vitro degradation behavior and cytocompatibility of biodegradable AZ31 alloy with PEO/HT composite coating[J].Colloids and Surfaces B-Biointerfac-es,2015,128:44-54.
[6] SONG Y W,ZHANG S,LI J,et al.Electrodeposition of Ca-P coatings on biodegradable Mg alloy:In vitro biomineralization behavior[J].Acta Biomaterialia,2010,(6):1736-1742.
[7] BAKHSHESHI-RAD H R,IDRIS M H,KADIR M R,Syn-thesis and in vitro degradation evaluation of the nano-HA/MgF2 and DCPD/MgF2 composite coating on biodegradable Mg-Ca-Zn alloy[J].Surface & Coatings Technology,2013,222:79-89.
[8] SHI Y,QI M,CHEN Y,et al.MAO-DCPD composite coat-ing on Mg alloy for degradable implant applications[J].Ma-terials Letters,2011,65:2201-2204.
[9] SHADANBAZ S,DIAS G J.Calcium phosphate coatings on magnesium alloys for biomedical applications:A review[J].Acta Biomaterialia,2012,8:20-30.
[10] GAO Y H,YEROKHIN A,MATTHEWS A.Deposition and evaluation of duplex hydroxyapatite and plasma electrolytic oxidation coatings on magnesium [J].Surface & Coatings Technology,2015,269:170-182.
[11] SHI H,YE X,HE F,et al.Improving osteogenesis of calci-um phosphate bone cement by incorporating with lysine:An in vitro study [J].Colloids and Surfaces B-Biointerfaces,2019,177:462-469.
[12] ANAWATI,ASOH H,ONO S.Enhanced uniformity of apa-tite coating on a PEO film formed on AZ31 Mg alloy by an al-kali pretreatment [J].Surface & Coatings Technology,2015,272:182-189.
[13] BAKHSHESHI H R,HANZAH E,ISMAIL A F,et al.In vitro degradation behavior,antibacterial activity and cytotox-icity of TiO2-MAO/ZnHA composite coating on Mg alloy for orthopedic implants [J].Surface & Coatings Technology,2018,334:450-460.
[14] LU X P,BLAWERT C,HUANG Y D,et al.Plasma elec-trolytic oxidation coatings on Mg alloy with addition of SiO2 particles[J].Electrochimica Acta,2016,187:20-33.
[15] CHENG Z,LIAN J,YANG H,et al.Biocompatible DCPD coating formed on AZ91D magnesium alloy by chemical depo-sition and its corrosion behaviors in SBF [J].Journal of Bionic Engineering,2014,11:610-619.
[16] HAN J P,BLAWERT C,TANG S W,et al.Effect of sur-face pre-treatments on the formation and degradation behavior of a caluium phosphate coationg on pure magnesium [J].Coatings,2019,259:1-18.
[17] MAO L,ZHOU H,CHEN L,et al.Enhanced biocompati-bility and long-term durability in vivo of Mg-Nd-Zn-Zr alloy for vascular stent application[J].Journal of Alloys and Com-pounds,2017,720:245-253.
[18] SUNDAR L S,ANJUM N A,FERRO M C,et al.Biocom-patibility and biotoxicity of in-situ synthesized carboxylated nanodiamond-cobalt oxide nanocomposite[J].Journal of Ma-terials Science & Technology,2017,33:879-888.
[19] KHALAJABADI S Z,KADIR M R A,IZMAN S,et al.The effect of MgO on the biodegradation,physical properties and biocompatibility of a Mg/HA/MgO nanocomposite manufac-tured by powder metallurgy method [J].Journal of Alloys and Compounds,2016,655:266-280.
[20] ASRI R I M,HARUN W S W,SAMYKANO M,et al.Cor-rosion and surface modification on biocompatible metals:A review[J].Materials Science & Engineering C,Materials for Biological Applications,2017,77:1261-1274.
[21] HAN J P,TANG S W,SAN H S,et al.Formation mecha-nism of calcium phosphate coating on a plasma electrolytic oxidized magnesium and its corrosion behavior in simulated body fluids[J].Journal of Alloys and Compounds,2020,818:152834.
[22] ZENG C Y,ZENG R C,LI C L,et al.Comparison of calci-um phosphate coatings on Mg-Al and Mg-Ca alloys and their corrosion behavior in Hank′s solution[J].Surface & Coat-ings Technology,2010,204:3636-3640.
[23] SURMENEV R A,SURMENEVA M A,IVANOVA A A,Significance of calcium phosphate coatings for the enhance-ment of new bone osteogenesis-A review[J].Acta Biomate-rialia,2014,10:557-579.
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





