摘要
综述了铁还原菌 (IRB) 对海洋中钢铁等材料腐蚀影响的国内外研究进展。阐述了IRB种类和代谢方式的多样性,介绍了其在代谢过程中的电子传递方式;总结了海水环境中IRB所致金属腐蚀机理的研究现状,分析了不同研究者的结论存在差异的原因;最后介绍了研究IRB腐蚀影响常用的方法,并对今后的研究方向提出相应的建议。
关键词: 海水腐蚀; 微生物腐蚀; 铁还原菌; 异化铁还原
根据我国自然资源部发布的《2018年中国海洋经济统计公报》,2018年的全国海洋生产总值已达83415亿元,占国内生产总值的9.3%,航运业以及海洋相关产业已经成为当今经济发展的重要引擎。海洋环境复杂多变,高浓度的盐、溶解氧等因素共同作用造成海洋工程材料的严重腐蚀,带来巨大经济损失,埋下许多安全隐患。其中,微生物如细菌、真菌、古菌等在海洋装备灾难性事故中扮演的角色引起人们越来越多的关注。这种由于微生物生命活动或代谢产物所导致的腐蚀称为微生物腐蚀 (MIC)。
海洋中已经报道的微生物约有1500多种,具有腐蚀活性的微生物主要有硫酸盐还原菌 (SRB)、硝酸盐还原菌 (NRB)、铁氧化菌 (IOB)、铁还原菌 (IRB) 和产酸菌 (APB) 等[1],其主要通过参与Fe、S等的循环并改变金属表面的阴、阳极反应影响腐蚀过程[2-4]。自然环境下,金属的MIC往往伴随着生物膜的生成和发展,生物膜可以为微生物提供适合的生存环境,对杀菌剂起到屏障作用,且生物膜不同深度溶解氧、无机盐、有机营养成分等的浓度不同,为微生物之间的协同作用提供有利环境。MIC的控制在很大程度上是生物膜的控制[5,6]。SRB由于广泛存在于无氧环境,造成严重的腐蚀后果,被认为是最重要的腐蚀微生物。因此,MIC理论大多是以SRB为研究对象提出的,如经典的阴极去极化理论、浓差电池理论、代谢产物腐蚀理论等。而Jia等[6,7]在前人的基础上通过分析SRB、APB等微生物在金属腐蚀过程中的能量和电子传递过程,提出胞外电子传递理论 (EET-MIC)、代谢产物腐蚀理论 (M-MIC) 和生物降解腐蚀理论 (BD-MIC) 的划分,进一步完善了MIC理论。IRB作为海洋环境中一类重要的微生物,其对金属材料的腐蚀影响研究相对较少,有待进一步探索。
地球上的生命活动及进化与各类元素的循环息息相关,其中Fe作为地壳中含量第四位的元素,参与地球上大部分的生命代谢活动。现今的地球表面是一个固、液、气三相组成的高度异质环境,Fe主要以氧化态Fe(Ⅲ) 形式存在,但Fe(Ⅲ) 组成的矿物质或化合物溶解度极低,生物难以直接吸收。20世纪80年代以前,人们认为S的还原是微生物还原最早的形式,直到1987年分离并培养出第一株具有铁还原功能的细菌,人们开始意识到微生物还原Fe(Ⅲ) 可能是地球早期生命的呼吸方式之一,Vargas等[8]也通过实验证明了几种嗜热菌相比S更易还原Fe(Ⅲ)。近年来,随着不同种类的IRB被陆续从海水、海泥甚至深海热液区等水域环境中分离提取,其对金属材料的腐蚀作用也引起人们的关注[9]。虽然IRB对金属材料的腐蚀影响已取得一些成果,但对其作用结果及作用机制存在争议。因此,深入系统地探究IRB所致金属的腐蚀机制不仅可以进一步丰富MIC理论,还对海洋工程装备的防护具有理论指导意义。
本文从IRB种类的多样性、代谢过程的多样性、对金属材料的腐蚀机制研究现状、腐蚀研究方法等几个方面总结了海水环境中IRB所致金属材料腐蚀的研究进展。
1 海水环境中IRB种类的多样性
IRB并不是一个分类学上的概念,而是一类可以将Fe(Ⅲ) 还原为Fe(Ⅱ) 的微生物统称。Fe(Ⅲ) 的还原也称为异化铁还原,微生物通过氧化电子供体获得电子,以胞外Fe(Ⅲ) 作为末端电子受体,将Fe(Ⅲ) 还原为Fe(Ⅱ),同时获得能量[10]。IRB是一类严格厌氧或兼性厌氧的细菌或古菌,生存环境广泛,常见的海水环境中存在的IRB种类如表1所示。其中,深海热液区是重要的含铁氧化物的储存区,为异化IRB的生存繁殖提供了电子受体。但是,由于当前的技术限制,热液区的样品不易获取,并且外部条件改变后菌株不易存活,因此对深海热液区的IRB研究报道较少。目前在金属腐蚀领域研究最多的是Shewanella和Geobacter。
表1 海水环境已知的部分IRB种类
2 IRB代谢过程的多样性
微生物在代谢过程中需要不断地与外界进行物质交换,摄取能量,同时排出代谢产物,其本质是一系列的氧化还原反应,即存在电子供体和电子受体的电子传递过程。IRB从电子供体中获得电子,再将电子传递给Fe(Ⅲ) 使其还原,在此过程中获得并储存能量,有些IRB也可以还原其他有毒重金属和类金属,将还原过程作为自身的一种解毒机制[24]。
2.1 电子供体
IRB可利用H2、有机酸作为电子供体,尤其是短链有机酸,如乳酸盐、乙酸盐、甲酸盐,琥珀酸等;Geoglobus ahangari、Desulfuromonas palmitatis以及Geothrix fermentans可以利用一些长链脂肪酸如硬脂酸、棕榈酸等;还有少数几种可以利用葡萄糖和芳香族化合物作为电子供体,其中利用葡萄糖获得能量时大多通过发酵路径,产生乙酸。除此以外,极端环境分离的超嗜热菌如Ferroglobus placidus还能在一定条件下以Fe(Ⅱ) 为电子供体[25]。
2.2 电子受体
IRB在代谢过程中除了以Fe(Ⅲ) 作为电子受体,兼性厌氧的IRB在有氧环境下还能以O2为电子受体,Mn(Ⅳ)、胞外苯醌类化合物、富马酸、含氯化合物、硝酸根等也在一定条件下也可以作为IRB的电子受体[26-28]。其中,Shewanella、Acidiphilium以及Rhodoferax在利用O2作为电子受体时比Fe(III) 生长更好,这是因为在中性或偏碱性pH值环境下Fe(III) 的溶解度和氧化还原电位都比较低,微生物利用O2呼吸可产生更多的能量。在酸性条件下Fe(III) 以Fe3+的形式存在,Fe3+的氧化还原电位与O2接近,可同时利用O2和Fe(III) 进行呼吸。
此外,根据呼吸类型,可以分为呼吸型IRB和发酵型IRB。其中,呼吸型IRB可以通过完全或不完全氧化有机物获取电子,再传递给电子受体,获取并储存能量,如Geobacter、Desulfuromonas可以完全将有机物氧化成CO2,而Shewanella、Pseudomonas不能将有机物完全氧化为CO2。发酵型IRB通过发酵有机物获取能量并进行异化铁还原,但是大部分电子储存在发酵代谢产物中,只有极少部分的电子用来还原Fe(Ⅲ),如Vibrios和Bacillus等。研究者们通过计算表明,少量Fe(Ⅲ) 可以促进发酵获取更多能量[29,30]。因此,呼吸型的IRB更易对金属腐蚀产生影响。
2.3 电子传递机制
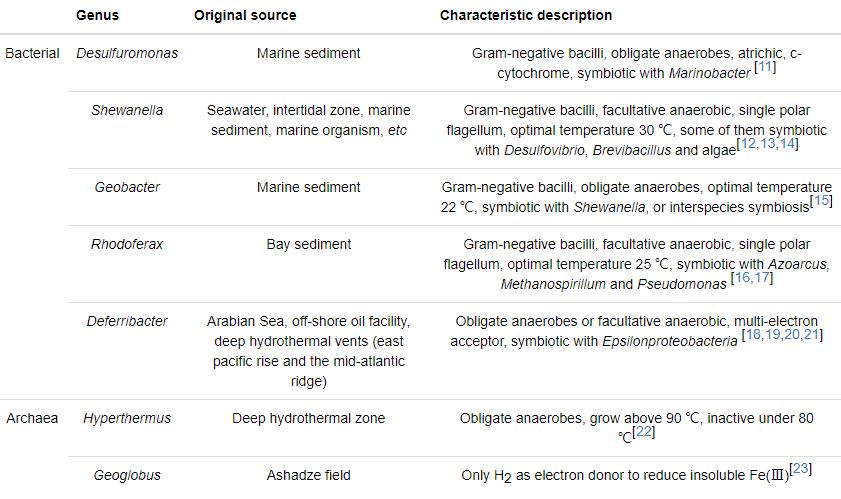
IRB是通过向胞外转移电子的代谢方式实现电子传递过程。目前普遍认为,IRB通过以下几种机制传递电子 (见图1):(a) 直接接触机制:细菌以菌毛作为纳米导线或通过外膜上的活性蛋白,直接接触铁氧化物表面释放电子;(b) 电子穿梭机制:微生物分泌的氧化还原物质携带电子传递至胞外受体,再以氧化态返回胞内继续接受电子,如此往返于胞内外的介质;(c) 鳌合作用机制:微生物分泌出复杂的有机配位体与不溶性铁氧化物作用形成可溶性复合体,溶解性的Fe通过扩散作用到微生物表面,增大微生物与Fe(Ⅲ) 的接触效率,提高铁还原速率[31]。在实际环境中,这几种机制的贡献还不是很清楚。例如,Geobacter不能产生电子穿梭体及络合物,通常被认为主要是通过膜蛋白或产生鞭毛进行电子传递[32];而Shewanella能分泌电子穿梭体或螯合物,比如醌、有机配位基、黑色素等,直接接触可能就不作为其还原不溶性铁氧化物的主要途径[33,34]。
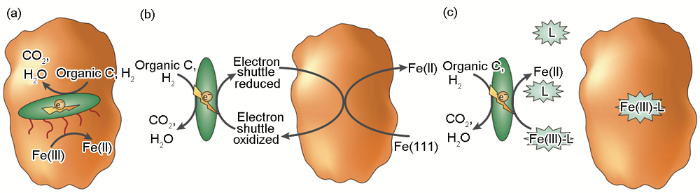
图1 微生物作用于Fe(Ⅲ) 氧化物表面传递电子的3种方式[31]
3 IRB对金属材料腐蚀的影响
金属在海水环境中的腐蚀过程大多是电化学过程,以钢铁的腐蚀为例,腐蚀过程中必定伴随着Fe的溶解,电极反应中的阳极反应为:
![]()
在有氧环境下,阴极反应很容易发生,O2迅速将Fe2+氧化为Fe3+,生成铁的氧化物或氢氧化物。而在无氧环境下,电子传递给H2O电解的H+,电极反应为[5,35]:

当微生物参与到腐蚀过程中时,其生长代谢会通过不同的途径改变电化学过程,例如微生物生命活动分泌能够促进阴极还原的酶而影响电极反应的动力学过程。生物膜结构创造生物膜内部的腐蚀微环境,如降低膜内溶解氧、生成抗菌素、分泌缓蚀剂等,改变金属与体系接触的表面状态,从而改变金属的腐蚀速率[5,36,37]及新陈代谢产物的腐蚀作用。IRB对金属的腐蚀影响近年来取得一系列研究成果。
3.1 单一IRB作用下的腐蚀过程
3.1.1 腐蚀促进理论
IRB引起金属材料腐蚀促进的MIC理论可总结为以下几方面:(1) 被广泛接受的腐蚀产物保护膜破坏理论。在一定条件下,钢铁表面形成的腐蚀产物膜对材料起到一定的保护作用,而IRB能够将保护性的Fe(III) 氧化物还原为可溶性的Fe(II),使得金属在腐蚀环境中呈现出新鲜的表面,加速金属腐蚀,其腐蚀机理如图2。上个世纪80年代,Obuekwe等[38]在微厌氧环境下研究了一株IRB (Pseudomonas sp.) 对碳钢腐蚀的影响,证明了IRB能够还原和移除由Fe(III) 化合物组成的保护性膜,促进阳极反应,进而加速碳钢腐蚀。之后,Little等[39]采用电化学噪声法研究了另外一株IRB (Shewanella purefaciens) 对碳钢腐蚀的影响,结果也表明IRB在碳钢表面通过将固态Fe(III) 的氧化物还原为可溶性的Fe(II),促进碳钢的腐蚀。(2) 局部腐蚀促进理论。IRB可形成不均匀生物膜,影响电化学过程,为局部腐蚀提供了条件,整体上表现为碳钢腐蚀被加速[36]。Chen等[40]采用丝束电极 (WBE) 的方法结合生物膜的形貌表征研究了一株IRB (Thalassospira. sp.) 在氧饱和海水中所致Q235碳钢局部腐蚀的动态过程,结果表明IRB的存在生成了不均匀的生物膜,且IRB在生物膜内的代谢导致了表面膜的局部破坏,产生了电化学活性位点,促进了Q235碳钢电荷转移过程。(3) 氢氧化腐蚀促进理论。随着电化学技术的发展,微区电化学技术已经在腐蚀领域得到越来越广泛的应用,因此有研究者研究了IRB和H2存在下碳钢的局部腐蚀[41,42],证明了IRB的氢氧化会使碳钢在短期内腐蚀加剧。
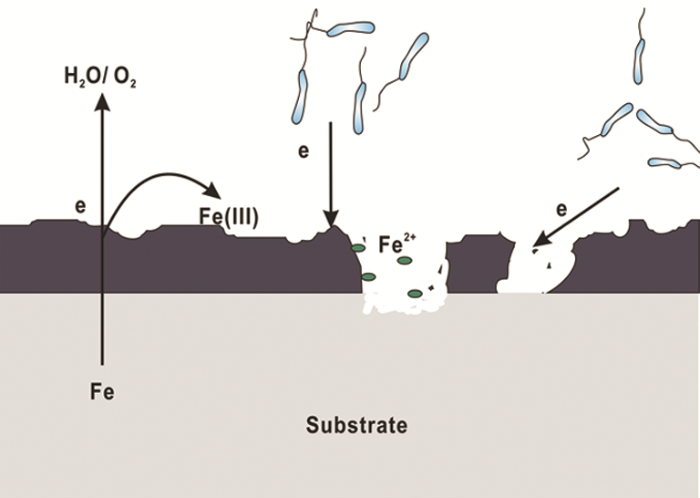
图2 IRB引起的腐蚀促进机理图
3.1.2 腐蚀抑制理论
随着对IRB腐蚀作用研究的深入,越来越多的研究结果表明,IRB对金属材料起到腐蚀抑制作用,其原因可以总结为以下几点:(1) O2消耗腐蚀抑制理论。IRB的存在会直接或间接地消耗O2,抑制阴极反应从而抑制材料的腐蚀[43]。O2在金属腐蚀过程中起到重要作用,其氧化还原电位大于Fe(III)的,使得一些兼性IRB更倾向以O2作为电子受体以获得更多的能量;同时,被还原生成的Fe(II) 氧化进一步消耗O2,降低体系中的溶解氧,腐蚀机理模型见图3。(2) 保护性产物层腐蚀抑制理论。近期研究表明,一些IRB会诱导生成具有缓蚀性的保护层如蓝铁矿,从而抑制腐蚀。Cote等[44]认为Geobacter sulfurreducens以醋酸盐为碳源将Fe(III) 还原为Fe(II),而Fe (II) 与磷酸根结合生成磷酸亚铁 (Fe3(PO4)2·8H2O) 即蓝铁矿,沉积在碳钢表面,减少碳钢的腐蚀。Volkland等[45]也利用IRB在钢表面成功制备了蓝铁矿涂层,反应如下:
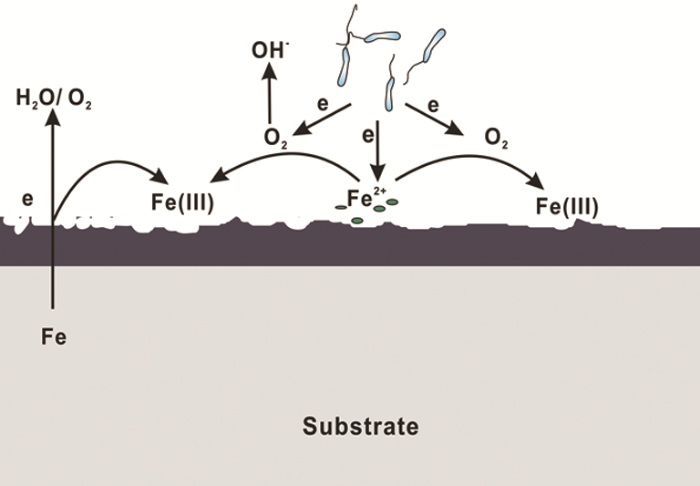
图3 IRB引起的腐蚀抑制机理图
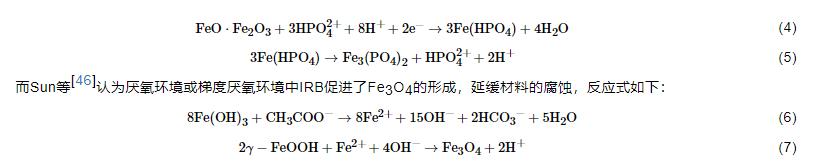
(3) 生物膜腐蚀抑制理论。微生物若在金属表面生成均匀的生物膜,则会对金属材料起到保护作用,因为均匀的生物膜屏蔽了O2的向内扩散,有些IRB在生物膜内的代谢还会产生缓蚀剂,抑制腐蚀[37,47]。(4) 电子传递腐蚀抑制理论。有研究[48]证明,如果IRB通过纳米导线传递电子,该过程中会产生阴极电流,抑制腐蚀。
3.2 混合菌作用下的腐蚀过程
实际的海水环境是复杂多样的,MIC在多数情况下是不同微生物协同作用的结果。除了单一菌种,混合菌即两种及以上的菌种作用下金属的腐蚀行为也开始受到关注。其中,有研究者报道了IRB与IOB、铜绿假单胞菌等协同作用对金属腐蚀的影响。
IOB是常见的一类具有腐蚀活性的微生物,代谢过程中通过将Fe(II) 氧化成Fe(III) 获取能量,导致在金属表面产生氧浓差电池,引起局部腐蚀,腐蚀结果往往是在管道等金属表面形成锈瘤[49],锈瘤又为腐蚀性的厌氧微生物提供厌氧条件,从而造成金属严重的腐蚀。当IRB与IOB同时存在于体系中时,IOB以O2为电子受体,将Fe(II) 氧化成为Fe(III)。而IRB利用生成的Fe(III) 作为电子受体进行还原,但一些种类的IRB也倾向于以O2为电子受体,与IOB形成竞争。因此,二者的共同作用对金属腐蚀的影响值得探究。IRB与IOB的协同作用在淡水环境如自来水管道等方面研究较多。Wang等[50-52]的一系列研究证实,IRB与IOB通过在金属管道的内层和外层形成致密的腐蚀产物膜如α-FeOOH和Fe3O4等抑制管道的腐蚀。海水环境中其协同作用对腐蚀过程的影响研究较少。其中,Lee等[53]和Chen等[54]分别研究了不同种类的IRB和IOB混合菌作用对碳钢腐蚀的影响,结果均表明在有氧环境中IRB的加入会降低体系中O2含量,从而抑制阴极反应的进行,缓解IOB的腐蚀作用。
铜绿假单胞菌也是一种常见的微生物,广泛存在于各类环境中。Black等[55]在微好氧条件下,研究了低碳钢中铜绿假单胞菌和IRB共存的腐蚀效应,认为IRB去除保护性铁氧化物的能力导致铜绿假单胞菌进一步引起阳极极化导致腐蚀加速。
3.3 IRB影响腐蚀复杂性的原因剖析
IRB对海洋工程装备材料的腐蚀作用是不容忽视的,而现有的研究成果存在争议的主要原因可以概括为以下两点:
(1) IRB是一类具有铁还原能力的微生物,种类繁多,分布在不同的水域环境,因此,不同种类的IRB代谢过程中对电子受体和电子供体的选择不同。其中O2是一个影响IRB电子受体选择的重要因素,其氧化还原电位高于Fe(III),理论上有氧条件下兼性IRB趋向以O2作为电子受体,消耗体系中的O2,抑制腐蚀;而无氧条件下,IRB原则上以Fe(III) 等金属氧化物为电子受体,破坏腐蚀产物保护膜,可能会造成腐蚀加速。因此,不同种类的IRB在不同环境下对电子受体的选择不同,就会造成结果上的差异,很难进行系统对比。
(2) 生物膜的形成是一个非常复杂的生物/化学过程,对腐蚀过程的影响很难预测和控制,其组成受环境中微小扰动 (如温度、营养浓度和流量) 的影响,生物膜的状态会造成材料腐蚀的较大差异。现代的科学技术虽然已经在电化学检测、生物膜检测等方面得到了很大的改善,但生物膜内部的微环境如溶解氧、酸碱度、离子种类等还未能实现精确的跟踪检测。
4 IRB腐蚀影响的研究方法
4.1 腐蚀过程与产物测试
4.1.1 失重法
失重法测量腐蚀速率是一种简单可靠的方法。在IRB腐蚀影响的研究过程中,失重法被广泛应用。打磨后的样品在置于腐蚀体系中之前称重,浸泡一定的时间后,根据标准方法除去样品表面的生物膜及腐蚀产物后再称重,前后重量差值即为失重量。利用失重法可以得到一个直观、相对准确的腐蚀速率,但耗时较长且不易得到动态变化过程[6]。
4.1.2 电化学方法
相较于失重法,利用电化学手段研究IRB对金属表面腐蚀过程热力学和动力学过程的影响,可以得到快速准确的测试结果,是传统失重等方法不可比拟的。电化学阻抗谱 (EIS) 测试技术是研究金属腐蚀最常用的方法之一,该技术对被测体系扰动小,即使扰动信号长时间作用于电极,也不会给被测电极表面造成大的影响。极化曲线测量是腐蚀电化学研究的重要手段,线性极化 (LPR) 对研究电极在腐蚀电位附近外加电流进行微极化,通常选用相对开路电位±10 mV的扫描范围以最大限度接近体系的真实状态,通过计算电位对电流的斜率得到极化电阻 (Rp),可表征金属腐蚀速率;而通过Tafel极化得到的腐蚀电流 (icorr),不仅可以分析电极表面物质传输及腐蚀机理,还可以换算得到直观的腐蚀速率。
利用传统的电化学手段测试得到的是电极整体的电化学行为,不能提供某一微小区域的状态,微区电化学测试技术应运而生,弥补了普通电化学的不足。例如,局部电化学阻抗 (LEIS) 是通过向被测电极施加一个微扰电压,可以精确测量局部区域固/液界面的阻抗行为[56],从而分析局部腐蚀速率和生物膜下的差异。此外,扫描电化学显微镜 (SECM),扫描振动电极 (SVET)、扫描Kelvin探针 (SKP) 等微区电化学技术也得到相应的发展和应用。
4.1.3 腐蚀产物表征
金属表面的腐蚀产物形貌及成分分析对研究IRB影响下的腐蚀机制是不可或缺的。目前最常用的微观形貌表征手段有扫描电子显微镜 (SEM)、透射电子显微镜 (TEM),与其联用能谱 (EDS) 可进行元素分析。而腐蚀产物的物相分析常采用X射线衍射 (XRD)、X射线光电子能谱 (XPS)、Raman光谱分析等,多种方法相互验证,为确定产物成分提供可靠论证。
4.2 生物学研究方法
研究IRB对金属腐蚀的影响时,IRB的种类及其代谢特点、附着生物膜特征等信息必不可少,现代生物技术的发展为此提供了有力的工具。
4.2.1 IRB的分类
微生物的分类方法包括单菌株测序、宏基因高通量测序等。应用基因序列分析可鉴定生物之间的亲缘性,确定细菌分类及代谢特点,分析群落结构丰富度和多样性。其中,16SrRNA基因测序可以对特定环境下细菌和古菌的IRB种类和丰度进行有效的鉴定;而聚合酶链式反应技术 (PCR) 在短时间内大量扩增特定的DNA片段,用于序列分析、基因表达调控等。
4.2.2 生物膜表征
被微生物附着的样品经过超临界脱水后可以保留完整的微生物和胞外多聚物 (EPS) 形貌,在SEM下可以观察到其在金属表面的附着状态,但SEM无法给出细菌的存活状态和生物膜厚度。激光扫描共聚焦显微镜 (CLSM) 可以有效解决这一问题。观察前用不同的染料对含生物膜样品进行染色,生物膜中不同的成分与特定的染料结合,在CLSM下会激发出不同的荧光,确定生物膜中不同组分的分布情况。例如,用Live/Dead染料染色后的细菌,活细胞显示为绿色,而死细胞显示为红色,同时可以进行3D图像采集,既可以获得细菌在金属表面的存活状态,也可以获得直观的生物膜厚度。
4.2.3 基因敲除
分子生物学技术的发展使得基因敲除技术得到越来越广泛的应用,根据生物种类的不同,主要用到RecA系统同源重组法、CRISPR/Cas系统介导的基因敲除法和基于自杀载体的同源重组法等[57]。在IRB电子传递方式的研究过程中,通过敲除与电子传递相关的酶基因,可以进一步确定IRB的电子传递机制,Geobacter作为模式菌种已有所研究。例如,Summers等[58]利用基因敲除手段去除Geobacter sulfurreducens菌株中的色素蛋白Omcs (一种调节c型细胞色素的蛋白) 基因,再与Geobacter metallireducens构建共培养体系后证明了Geobacter sulfurreducens的导电纤毛参与种间直接电子传递的机制。Liu等[59]敲除Geobacter sulfurreducens菌株的Omcs基因后认为,纳米磁铁矿会促进Geobacter sulfurreducens和Geobacter metallireducens的直接电子传递过程。但是,由于IRB种类的复杂性和技术的局限,大部分IRB菌株还未见应用。在MIC研究领域,利用基因敲除技术去除与微生物腐蚀活性表达有关的基因,有助于明确微生物对金属腐蚀产生影响的直接因素,目前已应用在SRB、铜绿假单胞菌等所致金属腐蚀的研究中。例如,Huang等[60]通过基因敲除证实了铜绿假单胞菌中的phzM和phzS基因片段调控X80碳钢的EET-MIC。但是在IRB所致金属腐蚀的机制研究中,基因敲除的应用还比较少,具有较大的应用前景。
5 结语
综上所述,IRB作为一类重要的铁代谢菌,研究其对海水环境中金属的腐蚀影响意义重大。结合研究现状,针对存在的问题提出几点建议:第一,体系中参数的控制 (如溶解氧) 对研究IRB的腐蚀作用非常关键,尤其是有氧环境下应尽量减少溶解氧变化产生的影响,可以采用通氧或通空气的方式使体系内溶解氧保持浓度;第二,对生物膜内部微环境检测手段的提升和改善对研究IRB腐蚀影响机理具有重要意义;第三,IRB对O2的消耗容易造成贫氧环境,在实际海洋环境中能够为厌氧菌提供有利的生存环境,IRB与其他微生物混合作用所致腐蚀的机理需要进一步研究。
参考文献
[1] Mansfeld F. The interaction of bacteria and metal surfaces [J]. Electrochim. Acta, 2007, 52: 7670
[2] Shi X B, Yang C G, Yan W, et al. Microbiologically influenced corrosion of pipeline steels [J]. J. Chin. Soc. Corros. Prot., 2019, 39: 9
[2] (史显波, 杨春光, 严伟等. 管线钢的微生物腐蚀 [J]. 中国腐蚀与防护学报, 2019, 39: 9)
[3] Zhang P Y, Xu D K, Li Y C, et al. Electron mediators accelerate the microbiologically influenced corrosion of 304 stainless steel by the Desulfovibriovulgaris biofilm [J]. Bioelectrochemistry, 2015, 101: 14
doi: 10.1016/j.bioelechem.2014.06.010 pmid: 25023048
[4] Yi Y, Cho P, Al Zaabi A, et al. Potentiodynamic polarization behaviour of AISI type 316 stainless steel in NaCl solution [J]. Corros. Sci., 2013, 74: 92
[5] Zuo R J. Biofilms: Strategies for metal corrosion inhibition employing microorganisms [J]. Appl. Microbiol. Biotechnol., 2007, 76: 1245
doi: 10.1007/s00253-007-1130-6 pmid: 17701408
[6] Jia R, Unsal T, Xu D K, et al. Microbiologically influenced corrosion and current mitigation strategies: A state of the art review [J]. Int. Biodeterior. Biodegrad., 2019, 137: 42
[7] Jia R, Yang D Q, Xu D K, et al. Electron transfer mediators accelerated the microbiologically influence corrosion against carbon steel by nitrate reducing Pseudomonas aeruginosa biofilm [J]. Bioelectrochemistry, 2017, 118: 38
doi: 10.1016/j.bioelechem.2017.06.013 pmid: 28715664
[8] Vargas M, Kashefi K, Blunt-Harris E L, et al. Microbiological evidence for Fe(III) reduction on early Earth [J]. Nature, 1998, 395: 65
doi: 10.1038/25720 pmid: 9738498
[9] Guan F, Zhai X F, Duan J Z, et al. Progress on influence of cathodic polarization on sulfate-reducing bacteria induced corrosion [J]. J. Chin. Soc. Corros. Prot., 2018, 38: 1
[9] (管方, 翟晓凡, 段继周等. 阴极极化对硫酸盐还原菌腐蚀影响的研究进展 [J]. 中国腐蚀与防护学报, 2018, 38: 1)
doi: 10.11902/1005.4537.2016.216
[10] Javaherdashti R. Microbiologically Influenced Corrosion-An Engineering Insight [M]. Switzerland: Springer International Publishing, 2017
[11] Rousseau R, Santaella C, Bonnafous A, et al. Halotolerant bioanodes: The applied potential modulates the electrochemical characteristics, the biofilm structure and the ratio of the two dominant genera [J]. Bioelectrochemistry, 2016, 112: 24
doi: 10.1016/j.bioelechem.2016.06.006 pmid: 27429069
[12] Liu W Z, Wang A J, Sun D, et al. Characterization of microbial communities during anode biofilm reformation in a two-chambered microbial electrolysis cell (MEC) [J]. J. Biotechnol., 2012, 157: 628
doi: 10.1016/j.jbiotec.2011.09.010 pmid: 21939699
[13] Li J L, Wang T, Yu S X, et al. Community characteristics and ecological roles of bacterial biofilms associated with various algal settlements on coastal reefs [J]. J. Environ. Manage., 2019, 250: 109459
[14] Bayat Z, Hassanshahian M, Hesni M A. Enrichment and isolation of crude oil degrading bacteria from some mussels collected from the Persian Gulf [J]. Mar. Pollut. Bull., 2015, 101: 85
[15] You Y S, Zheng S L, Zang H M, et al. Stimulatory effect of magnetite on the syntrophic metabolism of Geobacter co-cultures: Influences of surface coating [J]. Geochim. Cosmochim. Acta, 2019, 256: 82
[16] Zhao Z Q, Sun C, Li Y, et al. Upgrading current method of anaerobic co-digestion of waste activated sludge for high-efficiency methanogenesis: Establishing direct interspecies electron transfer via ethanol-type fermentation [J]. Renew. Energ., 2020, 148: 523
[17] Táncsics A, Farkas M, Szoboszlay S, et al. One-year monitoring of meta-cleavage dioxygenase gene expression and microbial community dynamics reveals the relevance of subfamily I.2.C extradiol dioxygenases in hypoxic, BTEX-contaminated groundwater [J]. Syst. Appl. Microbiol., 2013, 36: 339
doi: 10.1016/j.syapm.2013.03.008 pmid: 23706914
[18] Nair H P, Puthusseri R M, Vincent H, et al. 16S rDNA-based bacterial diversity analysis of Arabian Sea sediments: A metagenomic approach [J]. Ecolog. Genet. Genomic., 2017, 3: 47
[19] Gittel A, Kofoed M V W, S?rensen K B, et al. Succession of Deferribacteres and Epsilonproteobacteria through a nitrate-treated high-temperature oil production facility [J]. Syst. Appl. Microbiol, 2012, 35: 165
doi: 10.1016/j.syapm.2012.01.003 pmid: 22381470
[20] Slobodkin A, Campbell B, Cary S C, et al. Evidence for the presence of thermophilic Fe(III)-reducing microorganisms in deep-sea hydrothermal vents at 13°N (East Pacific Rise) [J]. FEMS Microbiol. Ecol., 2001, 36: 235
doi: 10.1111/j.1574-6941.2001.tb00844.x pmid: 11451528
[21] Slobodkina G B, Kolganova T V, Chernyh N A, et al. Deferribacter autotrophicus sp. nov., an iron (III)-reducing bacterium from a deep-sea hydrothermal vent [J]. Int. J. Syst. Evol. Microbiol., 2009, 59: 1508
doi: 10.1099/ijs.0.006767-0 pmid: 19502344
[22] Lin T J, Breves E A, Dyar M D, et al. Magnetite formation from ferrihydrite by hyperthermophilic archaea from Endeavour Segment, Juan de Fuca Ridge hydrothermal vent chimneys [J]. Geobiology, 2014, 12: 200
doi: 10.1111/gbi.12083 pmid: 24612368
[23] Slobodkina G B, Kolganova T V, Querellou J, et al. Geoglobus acetivorans sp. nov., an iron (III)-reducing archaeon from a deep-sea hydrothermal vent [J]. Int. J. Syst. Evol. Microbiol., 2009, 59: 2880
doi: 10.1099/ijs.0.011080-0 pmid: 19628601
[24] He J Z, Qu D, Zhang L L. DissImilatory Fe(III) reduction by microorganisms [J]. Microbiol. Chin., 2006, 33(5): 158
[24] (贺江舟, 曲东, 张莉利. Fe(III) 的微生物异化还原 [J]. 微生物学通报, 2006, 33(5): 158)
[25] Smith J A, Aklujkar M, Risso C, et al. Mechanisms involved in Fe(III) respiration by the hyperthermophilic archaeon Ferroglobus placidus [J]. Appl. Environ. Microbiol., 2015, 81: 2735
[26] Herrera L K, Videla H A. Role of iron-reducing bacteria in corrosion and protection of carbon steel [J]. Int. Biodeterior. Biodegrad., 2009, 63: 891
[27] Niu Y, Lin Z L, Lin G J, et al. Research on corrosion behavior of Q235 steel in marine iron-oxidizing bacteria [J]. Marin. Environ. Sci., 2014, 33: 739
[27] (牛艳, 林振龙, 林国基等. Q235钢在海洋铁细菌作用下的腐蚀行为研究 [J]. 海洋环境科学, 2014, 33: 739)
[28] Chen R, Liu H, Tong M, et al. Impact of Fe(II) oxidation in the presence of iron-reducing bacteria on subsequent Fe(III) bio-reduction [J]. Sci. Total Environ., 2018, 639: 1007
[29] Vecchia E D, Suvorova E I, Maillard J, et al. Fe(III) reduction during pyruvate fermentation by Desulfotomaculum reducens strain MI-1 [J]. Geobiology, 2014, 12: 48
pmid: 24279507
[30] Lehours A C, Rabiet M, Morel-Desrosiers N, et al. Ferric iron reduction by fermentative strain BS2 isolated from an iron-rich anoxic environment (Lake Pavin, France) [J]. Geomicrobiol. J., 2010, 27: 714
[31] Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction [J]. Nat. Rev. Microbiol., 2006, 4: 752
doi: 10.1038/nrmicro1490 pmid: 16980937
[32] Nevin K P, Lovley D R. Lack of production of electron-shuttling compounds or solubilization of Fe(III) during reduction of insoluble Fe(III) oxide by Geobacter metallireducens [J]. Appl. Environ. Microbiol., 2000, 66: 2248
doi: 10.1128/aem.66.5.2248-2251.2000 pmid: 10788411
[33] Burns J L, Ginn B R, Bates D J, et al. Outer membrane-associated serine protease involved in adhesion of Shewanella oneidensis to Fe(Ⅲ) oxides [J]. Environ. Sci. Technol., 2010, 44: 68
[34] Marsili E, Baron D B, Shikhare I D, et al. Shewanella secretes flavins that mediate extracellular electron transfer [J]. Proc. Natl. Acad. Sci. USA, 2008, 105: 3968
doi: 10.1073/pnas.0710525105 pmid: 18316736
[35] Gu T Y, Jia R, Unsal T, et al. Toward a better understanding of microbiologically influenced corrosion caused by sulfate reducing bacteria [J]. J. Mater. Sci. Technol., 2019, 35: 631
[36] Little B, Ray R. A perspective on corrosion inhibition by biofilms [J]. Corrosion, 2002, 58: 424
[37] Videla H A, Herrera L K. Understanding microbial inhibition of corrosion. A comprehensive overview [J]. Int. Biodeterior. Biodegrad., 2009, 63: 896
[38] Obuekwe C O, Westlake D W S, Plambeck J A, et al. Corrosion of mild steel in cultures of ferric iron reducing bacterium isolated from crude oil i. polarization characteristics [J]. Corrosion, 1981, 37: 461
[39] Little B, Wagner P, Hart K, et al. The role of biomineralization in microbiologically influenced corrosion [J]. Biodegradation, 1998, 9: 1
doi: 10.1023/a:1008264313065 pmid: 9807800
[40] Chen S Q, Zhang D. Corrosion behavior of Q235 carbon steel in air-saturated seawater containing Thalassospira sp. [J]. Corros. Sci., 2019, 148: 71
[41] Moreira R, Schutz M K, Libert M, et al. Influence of hydrogen-oxidizing bacteria on the corrosion of low carbon steel: Local electrochemical investigations [J]. Bioelectrochemistry, 2014, 97: 69
doi: 10.1016/j.bioelechem.2013.10.003 pmid: 24177135
[42] Esnault L, Jullien M, Mustin C, et al. Metallic corrosion processes reactivation sustained by iron-reducing bacteria: Implication on long-term stability of protective layers [J]. Phys. Chem. Earth, 2011, 36: 1624
[43] Dubiel M, Hsu C H, Chien C C, et al. Microbial iron respiration can protect steel from corrosion [J]. Appl. Environ. Microbiol., 2002, 68: 1440
pmid: 11872499
[44] Cote C, Rosas O, Basseguy R. Geobacter sulfurreducens: An iron reducing bacterium that can protect carbon steel against corrosion? [J]. Corros. Sci., 2015, 94: 104
doi: 10.1016/j.corsci.2015.01.044
[45] Volkland H P, Harms H, Kaufmann K, et al. Repair of damaged vivianite coatings on mild steel using bacteria [J]. Corros. Sci., 2001, 43: 2135
doi: 10.1016/S0010-938X(01)00004-X
[46] Sun H F, Shi B Y, Lytle D A, et al. Formation and release behavior of iron corrosion products under the influence of bacterial communities in a simulated water distribution system [J]. Environ. Sci.-Process Impacts, 2014, 16: 576
doi: 10.1039/c3em00544e pmid: 24509822
[47] Wang H B, Hu C, Hu X X, et al. Effects of disinfectant and biofilm on the corrosion of cast iron pipes in a reclaimed water distribution system [J]. Water Res., 2012, 46: 1070
doi: 10.1016/j.watres.2011.12.001
[48] Yan B Z, Wrenn B A, Basak S, et al. Microbial reduction of Fe(III) in hematite nanoparticles by Geobacter sulfurreducens [J]. Environ. Sci. Technol., 2008, 42: 6526
doi: 10.1021/es800620f pmid: 18800525
[49] Liu H W, Gu T Y, Asif M, et al. The corrosion behavior and mechanism of carbon steel induced by extracellular polymeric substances of iron-oxidizing bacteria [J]. Corros. Sci., 2017, 114: 102
doi: 10.1016/j.corsci.2016.10.025
[50] Wang H B, Hu C, Zhang L L, et al. Effects of microbial redox cycling of iron on cast iron pipe corrosion in drinking water distribution systems [J]. Water Res., 2014, 65: 362
doi: 10.1016/j.watres.2014.07.042
[51] Li X X, Wang H B, Hu X X, et al. Characteristics of corrosion sales and biofilm in aged pipe distribution systems with switching water source [J]. Eng. Fail. Anal., 2016, 60: 166
[52] Wang H B, Hu C, Li X X. Characterization of biofilm bacterial communities and cast iron corrosion in bench-scale reactors with chloraminated drinking water [J]. Eng. Fail. Anal., 2015, 57: 423
[53] Lee J S, McBeth J M, Ray R I, et al. Iron cycling at corroding carbon steel surfaces [J]. Biofouling, 2013, 29: 1243
doi: 10.1080/08927014.2013.836184 pmid: 24093730
[54] Chen S Q, Deng H, Liu G Z, et al. Corrosion of Q235 carbon steel in seawater containing mariprofundus ferrooxydans and Thalassospira sp. [J]. Front. Microbiol., 2019, 10: 936
doi: 10.3389/fmicb.2019.00936 pmid: 31134004
[55] Black E, Owens K, Staub R, et al. Evaluation of AISI Type 304 stainless steel as a suitable surface material for evaluating the efficacy of peracetic acid-based disinfectants against Clostridium difficile spores [J]. PLoS One, 2017, 12: e0187074
[56] Mouanga M, Puiggali M, Tribollet B, et al. Galvanic corrosion between zinc and carbon steel investigated by local electrochemical impedance spectroscopy [J]. Electrochim. Acta, 2013, 88: 6
[57] Wang X, Huang J Z, Li L. Advances in gene knockout techniques in microbiology [J]. J. Microbiol., 2019, 39(4): 100
[57] (王雪, 黄健中, 李力. 基因敲除技术在微生物中的应用 [J]. 微生物学杂志, 2019, 39(4): 100)
[58] Summers Z M, Fogarty H E, Leang C, et al. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria [J]. Science, 2010, 330: 1413
doi: 10.1126/science.1196526 pmid: 21127257
[59] Liu F H, Rotaru A E, Shrestha P M, et al. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange [J]. Environ. Microbiol., 2015, 17: 648
doi: 10.1111/1462-2920.12485 pmid: 24725505
[60] Huang L Y, Huang Y, Lou Y T, et al. Pyocyanin-modifying genes phzM and phzS regulated the extracellular electron transfer in microbiologically-influenced corrosion of X80 carbon steel by Pseudomonas aeruginosa [J]. Corros. Sci., 2019, 164: 108355
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





