摘要
采用失重法、动电位极化曲线、电化学阻抗谱探究了在三氯乙酸 (Cl3CCOOH) 溶液中0~500 mg/L咪唑啉 (IM) 缓蚀剂对冷轧钢的缓蚀性能,并通过SEM、AFM及接触角测试表征钢表面微观形貌结构和亲水/疏水性。采用量子化学理论探讨了IM在钢表面的吸附方式及质子化作用对缓蚀剂分子吸附行为的影响。结果表明:IM能有效减缓冷轧钢在0.10 mol/L Cl3CCOOH溶液中的腐蚀,20 ℃下500 mg/L缓蚀剂 IM的缓蚀率超过95%。IM的吸附服从Langmuir吸附等温式,在钢表面发生的吸附作用为混合吸附。动电位极化曲线显示IM属于混合抑制型缓蚀剂。冷轧钢在未添加和添加一定缓蚀剂IM的0.10 mol/L Cl3CCOOH中的Nyquist图谱均由高频区的容抗弧和低频区的感抗弧构成;加入IM后电荷转移电阻、电感电阻和电感值均显著增加。在添加IM的溶液中,钢表面腐蚀程度急剧降低,而疏水性增强。量子化学计算表明,IM易发生质子化生成p-IM,质子化后给电子能力减弱,接受电子能力加大。
关键词: 咪唑啉 ; 钢 ; 三氯乙酸 ; 缓蚀 ; 吸附 ; 量子化学计算
缓蚀剂在石油化工领域以及油气田酸化过程中广泛用于抑制金属材料的腐蚀[1]。作为缓蚀剂咪唑啉类化合物具有低毒性、高生物降解性优点,且在各种酸性介质中的缓蚀效果显著[2]。卤代咪唑啉衍生物对软钢在盐酸溶液中表现出较好的缓蚀效果,服从Langmuir吸附等温式,且氯代的缓蚀效果优于氟代[3]。赵景茂等[4-6]系统研究了油酸基咪唑啉衍生物在油田开采中饱和CO2介质中的缓蚀性能,及其分子结构和缓蚀性能的构效关系;同时研究了复配后的缓蚀协同效应,研发出了系列咪唑啉复配高效缓蚀剂。
近年来,研究发现油酸基咪唑啉衍生物在含有乙酸的饱和CO2的NaCl溶液中对碳钢的缝隙腐蚀具有良好的缓蚀性能[7]。Solomon等[8]研究报道了疏水烷基链长对咪唑啉衍生物在15%HCl溶液中对碳钢缓蚀性能排序为:—C13H27>—C15H35>—C17H35,并发现这些咪唑啉衍生物与KI复配后产生了明显的缓蚀协同效应。
量子化学计算[9]已成功应用于研究缓蚀剂分子的吸附活性中心及吸附作用基团,可弥补实验手段的局限性,进而从原子、分子层次上阐释缓蚀作用机理。胡松青等[10]通过量子化学研究了3种有所差别的咪唑啉缓蚀剂分子上的咪唑环和与其对应的亲水支链上的极性官能团优先吸附,发现3种不同的咪唑啉缓蚀剂分子的烷基长链以一定的倾角对金属表面有一定的隔离效果,形成了疏水膜。范峥等[11]利用量子化学特征的模糊人工神经网络预测了不同系列咪唑啉衍生物的缓蚀效率,并得出对缓蚀性能影响因素最大的结构参数是最高占据轨道能量。
然而,咪唑啉衍生物在有机酸溶液中的缓蚀研究报道还较为少见。三氯乙酸 (Cl3CCOOH) 的酸性较强 (Ka=2.2×10-1),可以作为去除金属材料表面氧化物及锈层的常见酸洗剂,故在酸洗过程中需要加入缓蚀剂来保护金属基体。此外,Cl3CCOOH是纤维素工业中常用的有机酸,广泛用于有机合成、杀虫剂等化工领域,在生产、运输及使用过程中对金属设备容易造成腐蚀[12],所以探究Cl3CCOOH介质中对金属材料腐蚀的有良好抑制效果的缓蚀剂具有重要实践意义。
早在20世纪70年代,Sampat和Vora[13]通过研究发现,甲基吡啶类化合物能有效抑制铝在Cl3CCOOH溶液介质中的腐蚀,且邻位甲基取代的缓蚀性能优于间位甲基取代,但吡啶类化合物的浓烈刺激性气味限制了其工业应用。进入21世纪,磺胺噻唑[14]和2-乙酰基吩噻嗪[15]可以作为Al在Cl3CCOOH溶液中的有效缓蚀剂,然而这类缓蚀剂存在价格昂贵的局限性。值得注意的是,对于三氯乙酸介质中钢的缓蚀研究公开报道极少,急需筛选出成本低廉且环境友好的高效缓蚀剂。
咪唑啉衍生物作为传统的高效缓蚀剂,虽然咪唑啉环上的取代基对缓蚀性能会产生影响,但吸附中心仍主要为咪唑啉 (C3H8N2)。为此,本工作采用失重法和电化学法研究了咪唑啉 (IM) 对冷轧钢在Cl3CCOOH溶液中的缓蚀性能,拟合出吸附等温式并获得吸附平衡常数,阐释了电化学作用机理;表征了IM缓蚀剂在Cl3CCOOH介质中钢表面吸附的微观结构,及其亲水/疏水性;进一步基于量子化学理论研究了IM在钢表面的吸附方式及质子化作用对缓蚀剂分子吸附行为的影响,深入探究了缓蚀作用机理,以便为咪唑啉类缓蚀剂作为Cl3CCOOH介质中的酸性缓蚀剂提供理论依据。
1 实验方法
LST12冷轧钢片试样 (质量分数,%) 成分为:Fe 99、C 0.05、Si 0.02、Mn 0.28、P 0.023、S 0.019。三氯乙酸为分析纯;咪唑啉 (IM,水溶,C3H8N2,分子量为72.11 g/mol)。
采用静态失重法进行缓蚀性能测试。首先将尺寸为25.0 mm×20.0 mm×0.50 mm的冷轧钢片试样采用600#、800#、1000#砂纸逐级打磨表面,丙酮脱脂、吹干后,用电子天平称取初始质量 (±0.1 mg)。然后将两块平行样钢片全浸悬于Cl3CCOOH测试液中,恒温 (±0.1 ℃) 6 h后,取出钢片试样,清洗腐蚀产物,冷风吹干后,再次称取腐蚀后的质量,得出两块平行样腐蚀前后的平均失重W (g)。冷轧钢在0.10 mol/L Cl3CCOOH溶液中的腐蚀速率 (v) 通过下式计算:

式中,S为单片钢片的表面积,t为水浴箱中钢片试样的腐蚀时间 (6 h)。在此基础上,可以通过下式得出IM的失重法缓蚀率 (ηw):

式中,v0、v分别为冷轧钢片在不含和含有一定浓度IM的0.10 mol/L Cl3CCOOH溶液中的腐蚀速率 (g·m-2·h-1)。
在PARSTAT 2273电化学工作站进行电化学测试,采用三电极系统并使用测试软件Powersuite进行测量。工作电极为测试钢片,参比电极为饱和甘汞电极 (SCE),对电极为铂片 (1.0 cm×1.0 cm)。测试钢片采用环氧树脂 (聚酰胺树脂为固化剂) 灌封,其裸露面积为1.0 cm2。实验时,放入250 mL 0.10 mol/L Cl3CCOOH溶液的电解池中浸泡约2 h,以便使开路电位充分稳定后进行测试。极化曲线扫描电位范围:-250~250 mV (相对于开路电位),极化曲线扫描速率:0.5 mV/s,EIS测量频率范围:10-2~105 Hz,EIS激励信号幅值10 mV。极化曲线法缓蚀率 (ηp) 的计算式如下:

式中,Icorr (0)和Icorr (inh) 分别为钢片在未添加和添加IM的0.10 mol/L Cl3CCOOH溶液中的腐蚀电流密度。
EIS法缓蚀率 (ηR) 则通过下式换算:

式中,Rt(inh)和Rt(0) 分别为钢电极在未添加和添加IM缓蚀剂的0.10 mol/L Cl3CCOOH溶液中的电荷转移电阻。
将冷轧钢片表面处理后,20 ℃恒温浸泡于不含和含500 mg/L IM的0.10 mol/L Cl3CCOOH溶液中,6 h后取出;洗净、吹干后,使用S4800型扫描电镜 (SEM) 和SPA-400 SPM unit原子力显微镜 (AFM) 进行形貌观察,使用Dataphyscis OCA20视频光学接触角测量仪测试接触角。
量子化学计算软件为Materials Studio 7.0 软件中的DMol3模块。方法为密度泛函理论 (DFT),函数选用广义梯度近似 (GGA) 中的BLYP[16],基组为DND (双数值轨道基组加d-轨道极化函数)[17],并利用COSMO溶剂模型[18]设置。
2 结果与讨论
2.1 IM的缓蚀性能
Cl3CCOOH对冷轧钢表面产生剧烈的腐蚀,实验中可观察到钢表面析出有连续不断的气泡 (H2)。20、30、40和50 ℃时的失重法挂片测试的腐蚀速率 (v) 分别为23.44、36.59、53.86 和76.63 g·m-2·h-1,但在加入IM缓蚀剂后钢的腐蚀速率明显降低。图1为缓蚀剂IM对冷轧钢在20~50 ℃下0.10 mol/L Cl3CCOOH溶液中的缓蚀率 (ηw) 随IM浓度 (c) 的变化曲线。当IM浓度为50~150 mg/L时,ηw增长较快;但在200~500 mg/L范围内,ηw基本无明显变化,说明IM在钢表面的吸附基本达到饱和,故缓蚀性能基本不再随IM浓度增加而不断升高。在20、30、40和50 ℃时500 mg/L IM的ηw分别高达95.92%、93.71%、86.39%和80.97%,表明IM对冷轧钢在0.10 mol/L Cl3CCOOH中具有良好的缓蚀效果。同时从图1也可看出,20和30 ℃时的缓蚀率差距不大,但升温至40和50 ℃时缓蚀率下降较为明显。温度升高,加快了钢的析氢腐蚀,IM在钢表面吸附能力随H2气泡的增多而变弱,甚至发生脱附,缓蚀性能降低。
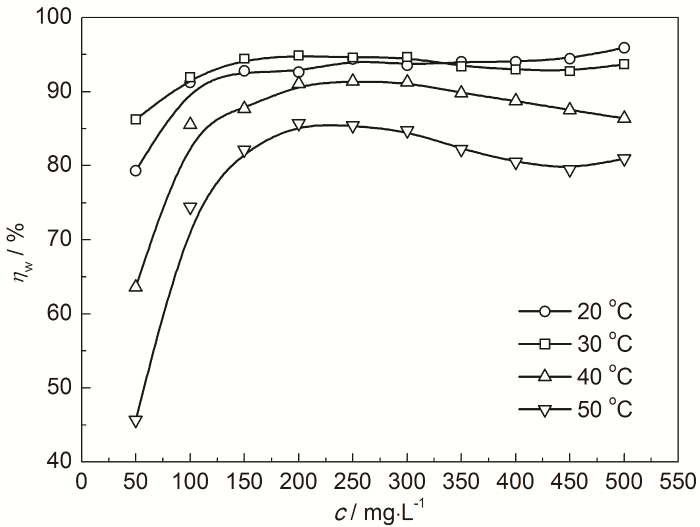
图1 在0.10 mol/L Cl3CCOOH溶液中IM对钢的ηw和c的关系曲线
2.2 IM在钢表面的吸附热力学行为
对失重法测试的IM在Cl3CCOOH溶液中实验数据进行Langmuir吸附等温式拟合[19]:

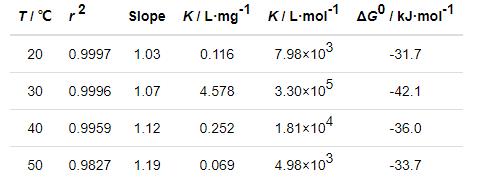
式中,c为缓蚀剂浓度 (mg/L);K为吸附平衡常数 (L/mg),表征缓蚀剂咪唑啉分子在钢表面的吸附强度。作各温度下c/θ-c直线拟合 (图2),直线的拟合参数列于表1。从图2及表1可以看出,c/θ-c之间呈良好的线性关系,20~50 ℃的直线线性相关系数 (r2)十分接近于1,说明0.10 mol/L Cl3CCOOH溶液中IM缓蚀剂在钢表面的吸附符合Langmuir吸附等温方程式。从表1也可看出,在30~50 ℃期间,K值随温度升高而减小,说明缓蚀剂分子在钢表面的吸附能力减弱。拟合直线c/θ-c的斜率在温度升高时已有所偏离1,说明该体系随着温度的升高钢表面上的IM缓蚀剂分子相互间的排斥力逐渐增大[20]。
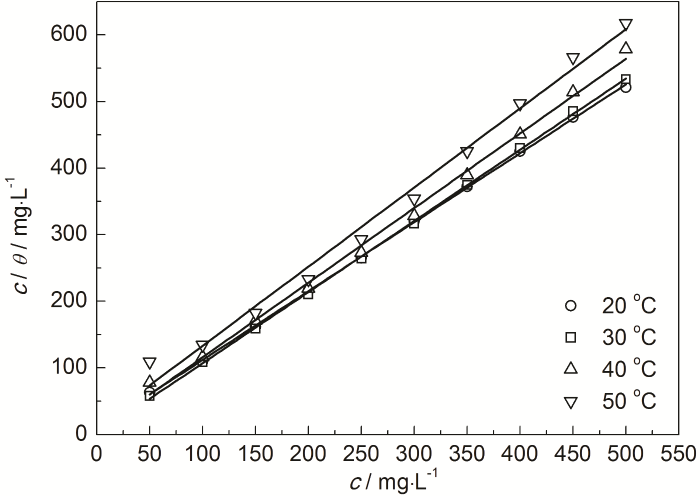
图2 0.10 mol/L Cl3CCOOH溶液中IM在实验钢表面的吸附等温方程式
表1 各实验温度下c/θ-c直线回归参数及ΔG0
标准吸附Gibbs自由能 (?G0) 可通过下式进行计算[21]:

式中,R表示气体常数 (8.314 J·K-1·mol-1),T表示热力学温度 (K);55.5为缓蚀体系中溶剂水的浓度 (mol/L)。先将表1中K的单位L/mg换算成L/mol[22],然后再求算ΔG0,结果亦列于表1中。由表1可知,各温度下ΔG0处于-31~-43 kJ/mol范围内,表明在0.10 mol/L Cl3CCOOH溶液中缓蚀剂IM分子对冷轧钢吸附作用趋势较强,且IM缓蚀剂在钢表面发生物理和化学吸附共存的混合吸附[23]。
2.3 动电位极化曲线分析
图3为冷轧钢在20 ℃下未加入及加入IM缓蚀剂的0.10 mol/L Cl3CCOOH溶液中的动电位极化曲线。由图3可以看出,在添加IM溶液中的阴极和阳极两支动电位极化曲线往腐蚀电流密度小的方向移动,且随着IM浓度的增加,移动程度增大,故可归属为混合抑制型缓蚀剂。
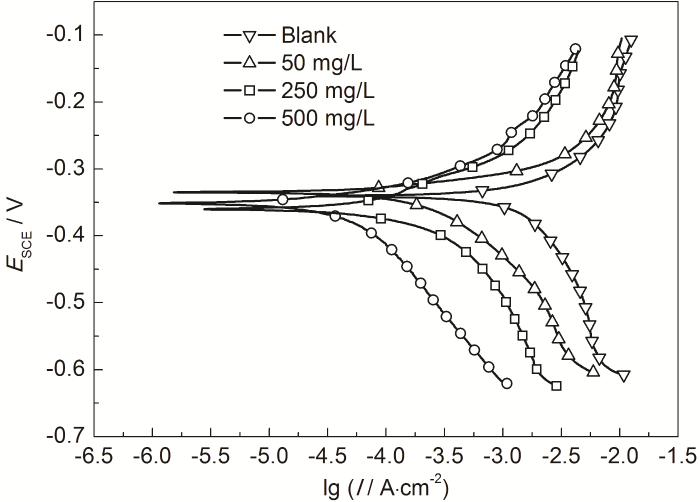
图3 冷轧钢在20 ℃下Cl3CCOOH溶液中的动电位极化曲线
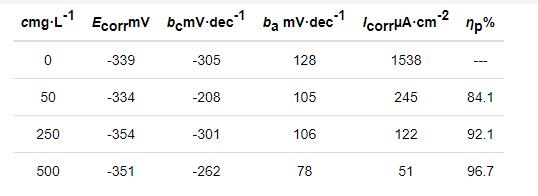
腐蚀电化学参数见表2。腐蚀电位 (Ecorr) 随着IM浓度的增加而基本保持不变;当浓度为50 mg/L时,最大负移值仅为12 mV。Icorr在未添加缓蚀剂的0.10 mol/L Cl3CCOOH中高达1538 μA/cm2,但添加IM后Icorr不断降低;当IM的浓度为500 mg/L 时,Icorr已下降至51 μA/cm2,缓蚀率 (ηp) 已达到96.7%,表明IM缓蚀剂对钢在0.10 mol/L Cl3CCOOH中起到良好的缓蚀作用。在0.10 mol/L Cl3CCOOH溶液添加IM后,阳极Tafel斜率 (ba) 和阴极Tafel斜率 (bc) 都发生了一定的变化,即在添加IM的0.10 mol/L Cl3CCOOH溶液中阴极、阳极的极化变化率发生改变。表明在0.10 mol/L Cl3CCOOH中IM为混合抑制型缓蚀剂,缓蚀作用机理为“几何覆盖效应”[24]。
表2 冷轧钢在20 ℃下Cl3CCOOH溶液中的腐蚀电化学参数
2.4 EIS分析
EIS中的Nyquist图谱见图4。冷轧钢在20 oC下未加入及加入IM的0.10 mol/L Cl3CCOOH溶液中的整个Nyquist图谱由高频区的容抗弧和低频区的感抗弧构成 (两个时间常数),且添加IM前后形状基本保持一致,只是大小发生了改变,故冷轧钢在缓蚀体系溶液中的腐蚀速率虽然下降,但腐蚀反应机理未变。
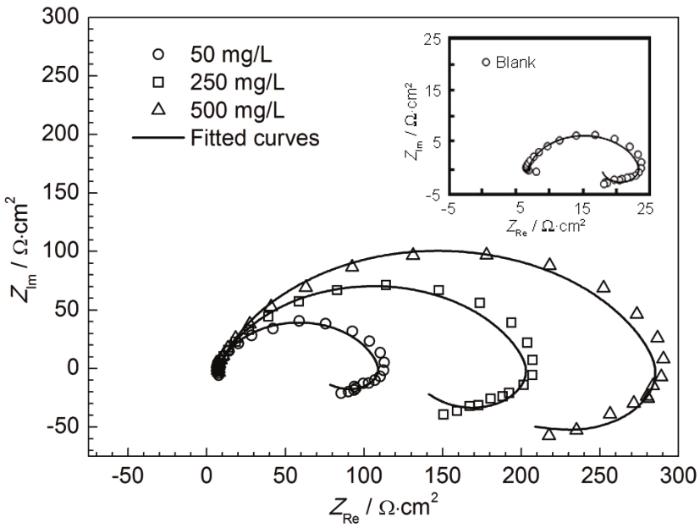
图4 冷轧钢在20 ℃下Cl3CCOOH溶液中的Nyquist谱
高频区的容抗弧主要反映电极/溶液双电层的阻容弛豫过程,且该容抗弧不是完整的半圆,这主要是由于电极表面不均匀、吸附扩散不均衡造成的频率弥散效应所致[23]。IM含量增加,容抗弧随之不断增大,故IM对冷轧钢的抑制作用随缓蚀剂浓度增加而不断增大。值得注意的是,低频区的感抗弧则与钢表面的“中间产物”的吸脱附过程相关,本缓蚀体系中的“中间产物”主要包含H3O+[25]、酸根离子 (Cl3CCOO-)[26]及缓蚀剂IM[27]。
图5为拟合EIS的等效电路图,其拟合直线和实验数据基本能够相重合 (图4),相应的拟合参数见表3。从表3中可以看出,本测试体系中的Rs (溶液电阻) 为6~8 Ω·cm2,其值与传统HCl和H2SO4相比略显偏大,这可能是由于Cl3CCOOH在水溶液中部分电离所引起的电导率下降所致。Rt (电荷转移电阻) 可以衡量金属材料在溶液中的腐蚀程度,其值越大,表明腐蚀越难以发生。缓蚀体系的Rt显著高于空白溶液体系的,故冷轧钢在添加IM的Cl3CCOOH溶液中的腐蚀受到明显抑制,且随着IM浓度的增加,Rt不断升高,即缓蚀性能随着IM含量增加而不断增强。与之对应的是,ηR值亦不断随缓蚀剂剂量的增大而加强,当IM浓度为500 mg/L 时,ηR为92.4%,说明IM可以作为冷轧钢在Cl3CCOOH溶液中的有效缓蚀剂。与空白Cl3CCOOH溶液相比,添加IM后的缓蚀体系中电极/溶液界面的Q (常相位角元件) 值下降了一个数量级,这可能是由于IM在电极表面上发生了驱替水分子的吸附,或增加了在钢/溶液界面吸附膜层厚度[17]。
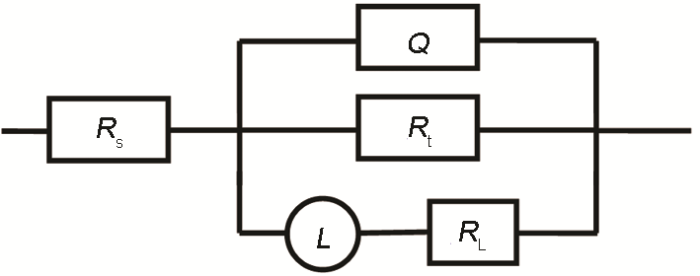
图5 冷轧钢在Cl3CCOOH溶液体系中的EIS等效电路
表3 冷轧钢在20 ℃下Cl3CCOOH溶液中的EIS参数
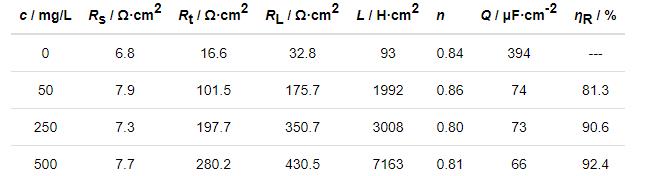
参数n (弥散效应系数) 小于1,进一步证实了钢电极表面存在频率弥散效应。通过比较发现,缓蚀体系中的n值并未发生显著变化,故缓蚀前后的弥散效应程度基本保持一致。与低频区相关的L (电感) 值在添加IM后显著增大,尤其当IM的添加量为500 mg/L时,L值已增至空白溶液中的近8倍,这可能与IM缓蚀剂分子在低频区的电极表面的“吸脱附”过程引起的扰动相关。
2.5 SEM分析
为了进一步研究钢片表面的微观结构形貌,采用SEM/EDS进行分析测试。从图6a可以观察出,表面处理好的浸泡前冷轧钢表面整体平整,但表面可看到大量的砂纸表面处理时留下的磨痕。从图6b中可以看出,冷轧钢表面在未添加缓蚀剂的Cl3CCOOH溶液中受到了剧烈的腐蚀,表面呈现凹凸不平“小山堆”状形貌。图6c显示,在0.10 mol/L Cl3CCOOH介质中添加500 mg/L IM后,IM有效抑制了钢表面的腐蚀程度,且还可以观察出浸泡前试样表面打磨的痕迹,说明IM具有非常优良的缓蚀效果。

图6 冷轧钢在0.10 mol/L Cl3CCOOH 溶液中浸泡前后的SEM像
2.6 3D-AFM分析
图7为冷轧钢表面腐蚀浸泡前后的3D-AFM图片。图7a表明,腐蚀浸泡前钢片表面较为平滑,但也可以观察到表面存在砂纸处理残留的痕迹和起伏,且存在深色“沟壑”状形貌。图7b显示,冷轧钢表面在20 ℃下0.1 mol/L Cl3CCOOH中浸泡6 h后的整体腐蚀严重,表面粗糙度增加。由图7c可看出,500 mg/L IM对冷轧钢片表面产生了显著的抑制作用,整个钢表面变得较平整光滑,说明缓蚀剂IM在0.1 mol/L Cl3CCOOH溶液中具有良好的缓蚀作用。
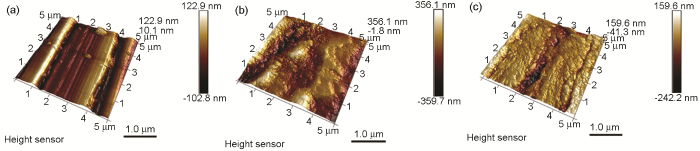
图7 冷轧钢在浸泡前后的表面3D-AFM像
2.7 接触角测试
从图8a中可以看出,表面处理好的钢表面接触角具有亲水性,其接触角为锐角,故腐蚀介质较容易浸润整个钢表面而发生进一步腐蚀。冷轧钢表面在三氯乙酸溶液介质中遭受严重腐蚀后,其表面接触角反而有所增加,即亲水性有所减弱,这可能与钢表面的腐蚀产物附着有关。当加入500 mg/L IM后,其表面接触角急剧上升,且已大于90o,表明缓蚀存在时钢表面具有疏水性质,从而可以有效抑制Cl3CCOOH溶液对钢表面的腐蚀。

图8 冷轧钢浸泡前后的表面接触角图片
2.8 IM的量子化学计算
IM分子中含有N杂原子,在酸溶液介质中会与H+发生质子化形成质子化咪唑啉 (p-IM)。图9为量子化学计算所得的IM和p-IM两种分子的几何优化结构,相应的质子亲和能 (PA) 通过量子化学计算得出为1211 kJ/mol,PA的数值非常大,表明IM易发生质子化生成p-IM。由图9中可以得出,IM和p-IM中的咪唑环不是一个平面,属于“信封式”构象,可以解释为五元环中四个原子在一个平面,而另一个原子不在这个平面。质子化发生后的p-IM中咪唑环结构大体上没有发生变化。
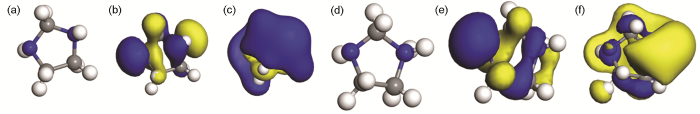
图9 优化的分子结构及前线轨道分布
N-杂环缓蚀剂在钢表面会出现物理吸附和化学吸附。物理吸附与缓蚀剂分子的偶极矩 (μ) 有一定的关联。一般来说,μ越大,表明缓蚀剂分子在钢表面的物理吸附作用越强[28]。
通过计算得出IM和p-IM两种分子的μ分别为1.2953和10.2420 Debye。显然,μ(p-IM)>μ(IM),故质子化的p-IM比未质子化IM更易发生物理吸附。
IM和p-IM的最高占据轨道 (HOMO) 和最低空轨道 (LUMO) 两个前线轨道均离域分布在整个分子中,缓蚀剂分子IM和质子化后的p-IM给出电子与Fe的空轨道构成配位键,接受Fe的电子构成反馈键,综合起来继而会产生化学吸附,使吸附更加稳固。
为了进一步定量化探究吸附能力,计算得出最高占据轨道能量 (EHOMO) 和最低空轨道能量 (ELUMO),并在此基础上依据如下公式计算出能隙 (ΔE)、绝对电负性 (β)、全局硬度 (γ) 和全局软度 (s) 系列缓蚀剂分子结构参数:
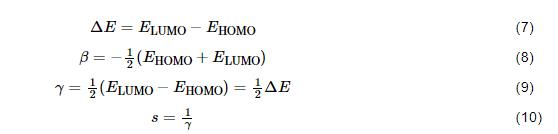
缓蚀剂分子向Fe原子的转移电子数 (ΔN) 可以从下式计算[29]:

式中,βFe的理论值为7 eV,而γFe值为0 eV[30]。
EHOMO越大,缓蚀剂分子给出电子的能力越强;而ELUMO越小,缓蚀剂分子接受电子的能力越强;其反应活性随?E减小而增大,易产生吸附效果。低数值的γ意味着强的极化度,从而具有较强的缓蚀效果。参数s和γ互为倒数,故高数值的s则表示强的缓蚀性能。与之相反的是,β值越大,则接受电子能力越强;而ΔN越大,则缓蚀剂分子的给电子能力越强。总之,缓蚀率正比于β、s和ΔN,但与ΔE和γ成反比。
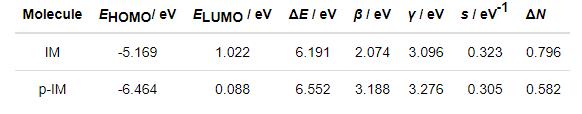
所有量子化学结构参数列于表4。表4的数据表明:EHOMO(IM)>EHOMO(p-IM),故质子化后的p-IM给出电子的能力变弱。E LUMO(p-IM)<ELUMO(IM)、β(p-IM)>β(IM),表明质子化后p-IM接受电子能力变强。?E、γ、s和ΔN均表明IM的化学吸附能力强于p-IM。事实上,从分子结构上看,p-IM中的质子化N杂原子多了一个质子后,本身的空间位阻效应增加,故化学吸附活性也会下降。
表4 IM的量子化学结构参数
2.9 在Cl3CCOOH溶液中的腐蚀及IM缓蚀机理
Cl3CCOOH在水溶液中会发生部分电离:
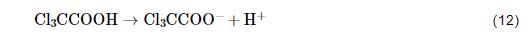
冷轧钢在Cl3CCOOH溶液中的腐蚀可归类为全面析氢腐蚀 (实验中可观察到钢表面析出大量的连续不断的气泡)。根据文献[30],阴极H+还原反应的总反应 (2H++2e-→H2↑) 包含有如下若干反应步骤:
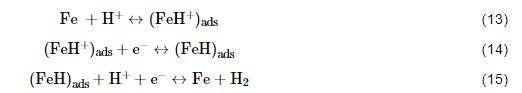
阳极氧化总反应 (Fe-2e-→Fe2+) 的机理历程颇为繁杂,参照冷轧钢在常见有机酸溶液中的阳极反应机理如甲酸 (HCOOH)[31]和乙酸 (CH3COOH)[32],拟定Cl3CCOOH与冷轧钢表面的阳极反应机理如下:
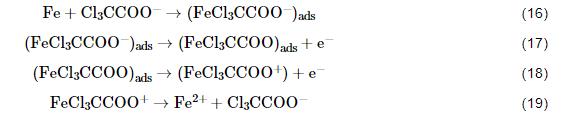
参照Fe在酸中的阳极反应历程,速率控制步骤为Fe表面的吸附络合物放电成为溶液中的络离子[33],故此处推测反应步骤 (18) 为速率控制步骤。
在Cl3CCOOH溶液中添加IM后,钢的腐蚀程度受到明显抑制。结合实验与理论、宏观和微观相结合的研究结果,缓蚀剂IM在Cl3CCOOH溶液中的缓蚀作用机理作如下解释:IM在酸性介质中发生质子化反应生成p-IM,p-IM易发生物理吸附,其与阳极腐蚀反应过程的中间产物 (FeCH3COO-)ads通过静电引力作用吸附在钢表面,减少了溶液与钢表面的接触面积,从而减慢了阳极腐蚀反应的进程。此外,IM和p-IM分子结构中的N杂原子将孤对电子及咪唑环中的π电子与Fe的空d轨道形成配位键,引起化学吸附的产生。同时,也可以接受Fe的电子形成反馈键。最后,IM和p-IM中的N杂原子具有孤对电子,可以作为良好的螯合配位体,故可能与在0.10 mol/L Cl3CCOOH介质中缓蚀体系中的Fe2+形成螯合物吸附覆盖在金属表面,从而阻隔了Cl3CCOOH对钢表面的腐蚀。
3 结论
(1) 咪唑啉 (IM) 对冷轧钢在0.10 mol/L Cl3CCOOH溶液中有着较好的缓蚀作用,缓蚀率随IM浓度的增高而升高,但增加至150 mg/L后基本保持不变;随温度的上升而下降。失重法测试的500 mg/L IM的ηw分别高达95.92% (20 ℃)、93.71% (30 ℃)、86.39% (40 ℃) 和80.97% (50 ℃)。
(2) IM在0.10 mol/L Cl3CCOOH溶液中冷轧钢表面的吸附符合Langmuir吸附等温方程式,且吸附作用趋势较强;IM在钢表面产生混合吸附。
(3) IM为通过“几何覆盖效应”作用的混合抑制型缓蚀剂。在未加入和加入一定缓蚀剂IM的0.10 mol/L Cl3CCOOH中,冷轧钢的Nyquist图谱由高频区的容抗弧和低频区的感抗弧构成;加入IM后电荷转移电阻、电感电阻和电感值均显著增加,而电极/溶液界面的常相位角元件数值下降。
(4) 在0.10 mol/L Cl3CCOOH溶液中添加缓蚀剂IM能有效抑制钢表面的腐蚀程度,粗糙度降低;在0.10 mol/L Cl3CCOOH溶液中,缓蚀剂IM使钢表面的疏水性增强,且接触角为钝角。
(5) IM和p-IM的优化分子结构为平面型分子,前线轨道HOMO和LUMO离域分布于整个分子;质子化p-IM的偶极矩变大,易发生物理吸附。
参考文献
1 Finšgar M, Jackson J. Application of corrosion inhibitors for steels in acidic media for the oil and gas industry: A review [J]. Corros. Sci., 2014, 86: 17
2 Song S F, Guo Y Y. The research status and progress of imidazoline inhibitors [J]. Guangdong Chem. Ind., 2016, 43(22): 91
2 宋绍富, 郭银银. 咪唑啉类缓蚀剂的研究现状及进展 [J]. 广东化工, 2016, 43(22): 91
3 Zhang K G, Xu B, Yang W Z, et al. Halogen-substituted imidazoline derivatives as corrosion inhibitors for mild steel in hydrochloric acid solution [J]. Corros. Sci., 2015, 90: 284
4 Zhao J M, Zhao Q F, Jiang R J. Relationship between structure of imidazoline derivates with corrosion inhibition performance in CO2/H2S environment [J]. J. Chin. Soc. Corros. Prot., 2017, 37: 142
4 赵景茂, 赵起锋, 姜瑞景. 咪唑啉缓蚀剂在CO2/H2S共存体系中的构效关系研究 [J]. 中国腐蚀与防护学报, 2017, 37: 142
5 Zhang C, Duan H B, Zhao J M. Synergistic inhibition effect of imidazoline derivative and L-cysteine on carbon steel corrosion in a CO2-saturated brine solution [J]. Corros. Sci., 2016, 112: 160
6 Lu Y, Zhang C, Wang W, et al. Study of the synergistic effect between corrosion inhibitors by using fractional free volume [J]. Chem. Res. Chin. Univ., 2019, 35: 1046
7 Li Y A, Xu N, Guo X P, et al. Inhibition effect of imidazoline inhibitor on the crevice corrosion of N80 carbon steel in the CO2-saturated NaCl solution containing acetic acid [J]. Corros. Sci., 2017, 126: 127
8 Solomon M M, Umoren S A, Quraishi M A, et al. Effect of akyl chain length, flow, and temperature on the corrosion inhibition of carbon steel in a simulated acidizing environment by an imidazoline-based inhibitor [J]. J. Petrol. Sci. Eng., 2020, 187: 106801
9 Obot I B, Macdonald D D, Gasem Z M. Density functional theory (DFT) as a powerful tool for designing new organic corrosion inhibitors. Part 1: An overview [J]. Corros. Sci., 2015, 99: 1
10 Hu S Q, Hu J C, Fan C C, et al. Theoretical and experimental study of corrosion inhibition performance of new imidazoline corrosion inhibitors [J]. Acta Chim. Sin., 2010, 68: 2051
10 胡松青, 胡建春, 范成成等. 新型咪唑啉缓蚀剂缓蚀性能的理论与实验研究 [J]. 化学学报, 2010, 68: 2051
11 Fan Z, Liu Z, Jing X Y, et al. Prediction of corrosion inhibition efficiency of imidazoline derivatives using fuzzy artificial neural network based on quantum chemical characteristics [J]. Chem. Ind. Eng. Prog., 2019, 38: 1961
11 范峥, 刘钊, 井晓燕等. 利用量子化学特征的模糊人工神经网络预测咪唑啉衍生物缓蚀效率 [J]. 化工进展, 2019, 38: 1961
12 Zhao J G, Zhang Y. Corrosion behavior of metallic aluminium in trichloroacetic acid [J]. Corros. Sci. Prot. Technol., 2010, 22: 184
12 赵建国, 张云. 金属铝在TCA溶液中的腐蚀 [J]. 腐蚀科学与防护技术, 2010, 22: 184
13 Sampat S S, Vora J C. Corrosion inhibition of 3s aluminium in trichloroacetic acid by methyl pyridines [J]. Corros. Sci., 1974, 14: 591
14 Desai P S, Vashi R T. Inhibitive efficiency of sulphathiazole for aluminum corrosion in trichloroacetic acid [J]. Anti-Corros. Meth. Mater., 2011, 58: 70
15 Ebenso E E, Okafor P C, Ekpe U J. Studies on the inhibition of aluminium corrosion by 2-acetylphenothiazine in chloroacetic acids [J]. Anti-Corros. Meth. Mater., 2003, 50: 414
16 Becke A D. A multicenter numerical integration scheme for polyatomic molecules [J]. J. Chem. Phys., 1988, 88: 2547
17 Lee C, Yang W T, Parr R G. Development of the colle-salvetti correlation-energy formula into a functional of the electron density [J]. Phys. Rev., 1988, 37B: 785
18 Klamt A, Schüürmann G. COSMO: A new approach to dielectric screening in solvents with explicit expressions for the screening energy and its gradient [J]. J. Chem. Soc., Perkin Trans., 1993, 2: 799
19 Langmuir I. The constitution and fundamental properties of solids and liquids. Part I. solids. [J]. J. Am. Chem. Soc., 1916, 38: 2221
20 Mu G N, Li X H, Qu Q, et al. Synergistic effect on corrosion inhibition by cerium (IV) ion and sodium molybdate for cold rolled steel in hydrochloric acid solution [J]. Acta Chim. Sin., 2004, 62: 2386
20 木冠南, 李向红, 屈庆等. 稀土铈(IV)离子和钼酸钠在盐酸溶液中对冷轧钢的缓蚀协同效应 [J]. 化学学报, 2004, 62: 2386
21 Fernandes C M, Alvarez L X, Dos Santos N E, et al. Green synthesis of 1-benzyl-4-phenyl-1H-1,2,3-triazole, its application as corrosion inhibitor for mild steel in acidic medium and new approach of classical electrochemical analyses [J]. Corros. Sci., 2019, 149: 185
22 Zhou X Y, Zhou Y. The unit problem in the thermodynamic calculation of adsorption using the Langmuir equation [J]. Chem. Eng. Comm., 2014, 201: 1459
23 Zhang K, Lu J M, Li J, et al. A novel approach for copper protection: UV light triggered preparation ofthe click-assembled film on copper surface [J]. Chem. Eng. J., 2020, 385: 123406
24 Cao C. On electrochemical techniques for interface inhibitor research [J]. Corros. Sci., 1996, 38: 2073
25 Deng S D, Li X H, Fu H. Nitrotetrazolium blue chloride as a novel corrosion inhibitor of steel in sulfuric acid solution [J]. Corros. Sci., 2010, 52: 3840
26 Li X H, Deng S D, Li N, et al. Inhibition effect of bamboo leaves extract on cold rolled steel in Cl3CCOOH solution [J]. J. Mater. Res. Technol., 2017, 6: 158
27 Amin M A, Abd El-Rehim S S, El-Sherbini E E F, et al. The inhibition of low carbon steel corrosion in hydrochloric acid solutions by succinic acid: Part I. Weight loss, polarization, EIS, PZC, EDX and SEM studies [J]. Electrochim. Acta, 2007, 52: 3588
28 Lashkari M, Arshadi M R. DFT studies of pyridine corrosion inhibitors in electrical double layer: solvent, substrate, and electric field effects [J]. Chem. Phys., 2004, 299: 131
29 Ghailane T, Balkhmima R A, Ghailane R, et al. Experimental and theoretical studies for mild steel corrosion inhibition in 1 M HCl by two new benzothiazine derivatives [J]. Corros. Sci., 2013, 76: 317
30 De Assunção Araújo Pereisa S S, Pêgas M M, Fernández T L, et al. Inhibitory action of aqueous garlic peel extract on the corrosion of carbon steel in HCl solution [J]. Corros. Sci., 2012, 65: 360
31 Singh M M, Gupta A. Corrosion behaviour of mild steel in formic acid solutions [J]. Mater. Chem. Phys., 1996, 46: 15
32 Tran T, Brown B, Nešić S, et al. Investigation of the electrochemical mechanisms for acetic acid corrosion of mild steel [J]. Corrosion, 2014, 70: 223
33 Gong M. Metallic Corrosion Theory and Corrosion Control [J]. Beijing: Chemical Industry Press, 2009: 59
33 龚敏. 金属腐蚀理论与腐蚀控制 [M]. 北京: 化学工业出版社, 2009: 59
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





