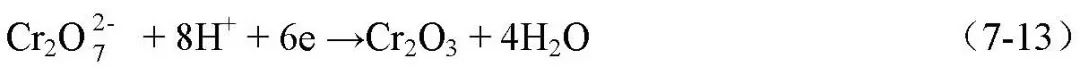选材、腐蚀试验及腐蚀控制 缓蚀剂评价与使用 1 缓蚀剂的分类 缓蚀剂保护是通过添加少量能阻止或减缓金属腐蚀速度的物质,即缓蚀剂,以防止或减缓金属腐蚀的方法。不但对金属的全面腐蚀可采用缓蚀剂保护,对应力腐蚀、孔蚀、缝隙腐蚀、晶间腐蚀和腐蚀疲劳等也可采用缓蚀剂保护。缓蚀剂可以是单组分物质,或者多组分,用量很少,虽然它不能改变金属在介质中的腐蚀倾向,但它能在金属表面形成保护膜,从而抑制金属的腐蚀,减缓金属的腐蚀速度;多种缓蚀剂的配合使用,还可以同时保护与腐蚀介质接触的多种金属材料。缓蚀剂还可以和涂料、电化学保护等联合使用。 缓蚀剂保护的特点是药剂直接投加到腐蚀系统,设备和操作简单、一次投资少,收效快。采用合适的缓蚀剂及保护工艺,保护效率可达99%~100%。缓蚀剂不仅可有效地减缓金属的腐蚀,有时在保护金属的机械强度、加工性能以及改善生产环境、降低原料消耗上也有一定的效果。广泛应用于石油、化工、钢铁、机械、航空航天、动力和运输部门,是重要的防腐蚀方法之一,主要用于腐蚀性为中等或较轻的系统的中长期保护,或对某些强腐蚀介质的短期保护。如,美国阿波罗登月计划中,在N2O4介质中加入少量H2O或NO,解决了钛合金制容器的应力腐蚀问题,既是缓蚀剂应用的典型案列。 缓蚀剂的品种繁多,常用的如亚硝酸钠、铬酸盐、磷酸盐、石油磺酸钡、亚硝酸二环已胺等,至今尚难以有统一的分类方法。常见到的分类方法有以下几种。 01 按缓蚀剂作用的电化学理论分类 a.阳极型缓蚀剂 也称阳极抑制型缓蚀剂,是通过抑制腐蚀的阳极过程而阻滞金属腐蚀的物质。这种缓蚀剂通常是由其阴离子向金属表面的阳极区迁移,它们能增加阳极极化,从而使腐蚀电位正移。氧化金属使之钝化,从而阻滞阳极过程。例如,中性介质中的铬酸盐与亚硝酸盐。一些非氧化型的缓蚀剂,例如苯甲酸盐、正磷酸盐、硅酸盐等在中性介质中,只有与溶解氧并存,才起到阳极抑制剂的作用。该类缓蚀剂属于“危险型”缓蚀剂,钝化剂的缓蚀率很高,但用量必须足够。否则,导致腐蚀加速或发生孔蚀。 作用过程为: i.具有强氧化作用的缓蚀剂,使金属钝化,主要有亚硝酸钠,高铬酸等; ii.具有阴极去极化性的钝化剂,在阴极被还原,加大阴极电流,使体系的氧化还原电位向正方移动,超过钝化电位,而使腐蚀电流达到很低的值。主要有亚硝酸盐、硝酸盐与高价金属盐,铬酸盐、磷酸盐、钼酸盐、钨酸盐等在酸性溶液中。 铬酸盐有很强的氧化能力,发生氧化反应时Cr6+还原为Cr3+,铬酸盐在较高浓度时是十分有效的阳极钝化剂。铬酸盐对碳钢的钝化与碳钢在H2SO4 中的电位极化相似,钝化时铁表面发生的反应为: 反应时被还原的铬酸盐以Cr2O3 的形态吸附在铁的表面和铁表面同时生成的Fe2O3 共同组成钝化膜。钝化膜充分脱水,结构致密,防腐性能好。而其它缓蚀剂处理铁都无法得到这样的膜,甚至用KMnO4 强氧化剂也不能达到铬酸盐钝化铁的这种程度。 铬酸盐对钢铁和铜、锌、铝及其合金都能给予良好的保护作用,适用pH值范围宽(pH6~11),使用铬酸盐作缓蚀剂时,碳钢的腐蚀速度可低于0.025 mm·a-1。铬酸盐的缺点是毒性大,环境保护部门对铬酸盐的排放有严格的要求,容易被还原而失效,不宜用于有还原性物质的炼油厂的冷却系统中; b.阴极型缓蚀剂 通过抑制腐蚀的阴极过程而阻滞金属腐蚀的物质。这种缓蚀剂通常是由其阳离子向金属表面的阴极区迁移,或者被阴极还原,或者与阴离子反应而形成沉淀膜,使阴极过程受到阻滞,增大酸性溶液中氢析出的过电位,使腐蚀电位向负移动。例如聚磷酸盐、ZnSO4、Ca(HCO3)2、As3+、Sb3+可以分别和OH-生成Zn(OH)2、Ca(OH)2沉淀或被还原为As、Sb覆盖在阴极表面,以阻滞腐蚀。此类缓蚀剂是“安全型缓蚀剂”。 作用过程为: i.成膜型阴极缓蚀剂,腐蚀过程在阴极生成的OH-与缓蚀剂反应生成的不溶性物质使金属表面形成膜层,阻碍阴极反应。如硫酸锌,碳酸氢钙及镁,锰等钢铁缓蚀剂; ⅱ.提高阴极反应过电位的缓蚀剂。此类缓蚀剂的作用在于增大腐蚀电池的阴极极化,使阴极反应速度降低,从而减小金属的腐蚀。如,增加H+放电过电位的缓蚀剂,硫化物和在酸性溶液中砷离子、锑离子等在金属表面析出时,提高了H+放电的过电位而抑制H+的还原反应。这类化合物可能导致金属的氢损伤(氢鼓泡、氢脆等) ⅲ.阴极去极化型缓蚀剂。加入了阴极缓蚀剂后,只改变了阴极反应过程,而阳极反应不发生变化。如亚硝酸盐; ⅳ.除氧剂型缓蚀剂。这类缓蚀剂可以在腐蚀介质中可以消耗其中的氧气,从而降低阴极反应速度。这类缓蚀剂有亚硫酸钠、肼等还原剂。如肼与氧反应: N2H4+O2→N2+2H2O (7-14) c.混合型缓蚀剂 这种缓蚀剂既可抑制阳极过程,又可抑制阴级过程。如含氮、含硫以及既含氮含硫的有机化合物、琼脂、生物碱,硅酸钠,铝酸钠等。 金属在腐蚀介质中的腐蚀电位>零电荷电位时,金属表面带正电荷,易吸附阴离子型缓蚀剂;金属在某腐蚀介质中的腐蚀电位<零电荷电位时,金属表面带负电荷,易吸附阳离子型缓蚀剂;金属在某腐蚀介质中的腐蚀电位接近零电荷电位时,金属表面几乎没有电荷,易吸附中性分子缓蚀剂。 02 成分分类 a.无机缓蚀剂,如亚硝酸盐、硝酸盐;铬酸盐、重铬酸盐;磷酸盐、多磷酸盐;硅酸盐;钼酸盐;含砷化和物等。无机缓蚀剂多半是使金属生成不溶性钝化膜层或反应膜层(苯甲酸钠与无机缓蚀剂作用相似)来阻止腐蚀; b.有机缓蚀剂,有机缓蚀剂大多含氮或硫,或者二者都有。如,有机硫化合物(硫醇、硫醚、硫脲及其衍生物等)、胺和胺盐、醛类、炔醇类、有机磷化合物、羧酸及其盐类;磺酸及其盐类;杂环化合物等。有机缓蚀剂大部分主要是吸附在金属表面,改变金属表面的状态而起缓蚀作用; 03 缓蚀剂所形成保护膜的特征分类 a.钝化膜型缓蚀剂 通过使金属表面形成致密的、附着力强的氧化膜而阻滞金属腐蚀的物质。例如,铬酸盐、重铬酸盐、亚硝酸钠等。由于它们具有钝化作用,故又称为钝化剂。氧化膜型缓蚀剂必须具备两个条件,即氧化电位足够高(热力学),氧化还原反应速度要足够快(动力学)。 该缓蚀剂能直接或间接氧化金属,成膜厚度5~10nm,一般对可钝化的金属具有良好的保护作用。而对铜、锌等金属效果较差或没有效果,也可能是促进腐蚀; b.沉淀膜型缓蚀剂 能与介质中的有关离子反应并在金属表面生成有一定保护作用的沉淀膜,从而阻滞金属腐蚀的物质。可以分为阳极型和阴极型。阳极型的有磷酸盐、硼酸盐、硅酸盐、苯甲酸盐等。阴极型的主要有Ca、Mg、Zn、Mn、Ni的盐类,如Ca(HCO3)2、ZnSO4等。成膜厚度几十到几百nm,多孔。沉淀型缓蚀剂常也是“安全缓蚀剂”,用量不足不会增加金属的腐蚀。但沉淀型缓蚀剂的沉淀膜与金属的结合力较差,保护效果一般不如钝化剂,缓蚀效果较差,并可能造成结垢; c.吸附膜型缓蚀剂 能吸附在金属表面形成吸附膜从而阻滞金属腐蚀的物质。多为有机物,因有机缓蚀剂都含有极性基团和非极性基团。根据吸附机理不同,可分为物理吸附(如胺类、硫醇和硫脲等)和化学吸附型(如吡啶衍生物,苯胺衍生物,环状亚胺等)两类,在酸性介质中效果较好。吸附机理可用软硬酸碱理论来解释,硬酸与硬碱形成物理吸附,软酸与软碱形成化学吸附。该类缓蚀剂对金属表面清洁度要求较高,与不洁净的金属表面吸附不好,影响缓蚀效果。 i.物理吸附。缓蚀剂在金属表面的吸附源于缓蚀剂离子和金属表面的静电引力和范德华力,其中静电引力起到重要作用,这种吸附迅速、可逆,其吸附热小,受温度影响大。 物理吸附型多数属于阴极型缓蚀剂,该类缓蚀剂的分子往往是由极性基团和非极性基团组成,分子结构对吸附的影响首先取决于极性基团和非极性基团的性质,极性基团中含有电负性高的O、N、P、S等元素,非极性基团主要是C、H元素。其中极性基团是亲水性的,可吸附于金属表面活性点或整个表面。而非极性基团是疏水或亲油的,将金属表面和腐蚀介质隔开; ⅱ.化学吸附。化学吸附是指缓蚀剂分子中极性基团中心原子的未共用电子对和金属形成配价键而引起吸附。 供电子型有机缓蚀剂分子中,含有以O、N、S、P为中心原子的极性基团,这些原子具有未共用的孤对电子,具有一定的供电子能力。缓蚀剂中的双键、三键上的键类似于孤对电子,也有提供电子的能力。缓蚀剂和金属两者可以形成配位反应而发生化学吸附,该吸附具有明显的吸附选择性,化学吸附多为抑制阳极反应,过程为不可逆。缓蚀剂的分子结构会影响化学吸附作用,受温度影响小。 供质子型缓蚀剂 当极性基团中的中心原子吸引相邻H上的电子时,会使H上的电子偏向中心原子,使H类似于带正电荷的质子一样,这样氢就可以和金属表面多电子的阴极区发生吸附作用。 04 缓蚀剂的用途分类 可分为冷却水、油气井、酸洗、气相缓蚀剂等。 05 缓蚀剂的溶解特性分类 a.水溶性缓蚀剂 如亚硝酸盐、磷酸盐、苯甲酸盐、1-羟基苯骈三氮唑等;工业用水缓蚀剂方面,聚丙烯衍生物(聚丙烯酸、聚丙烯酰胺等)、含磷有机酸聚合物(POCA)在工业冷却水中具有较好的阻垢、缓蚀等多功能作用。 聚乙烯吡咯烷酮及聚乙烯亚胺等高分子聚合物可以作为磷酸中低碳钢的缓蚀剂。果胶(P)、羧甲基纤维素(PEG)、聚乙烯醇(PVA)、聚乙二醇(PEG)、聚丙烯酸(PAA)、聚丙烯酸钠(Na-PAA)等高分子聚合物在不同的酸溶液中缓蚀效果有明显的差别,但其共同点是对生态环境不会造成不良影响。 防锈水即是水溶性的缓蚀剂与各种辅剂(消泡、增稠、浸润等)的水溶液,通常用于短期的工序间防锈; b. 油溶性缓蚀剂 油溶性缓蚀剂,如石油磺酸钡、十二烯基丁二酸等;油溶性缓蚀剂分子结构的特点是不对称性,一般由极性和非极性的两个基团构成。常见的极性基团有-OH、-COOH、-SO3H、-NH2等,它们与金属、水具有很强的亲和力;非极性基团主要是烃基,具有亲油憎水性。因此,当油溶性缓蚀剂与金属接触时,会发生缓蚀剂分子在油-金属界面的定向吸附。主要类型有: 羧酸及其皂类(RCOOH及(RCOO)N·Mm):有硬脂酸、油酸、蓖麻油、棕榈酸、环烷酸、氧化石油及氧化地腊、烯基丁二酸、壬基苯氧基醋酸、羟基脂肪酸等。羧酸皂的防锈效果比相应的酸性强,故皂类常用于封存油品。 酯类(RCOOR):蜂蜡、羊毛脂,酯类缓蚀剂在高温下易氧化变质。 胺类及其它含氮化合物:胺类有三乙醇胺、单乙醇胺、尿素等,含氮化合物有苯并三唑、哌啶等。 磺酸盐及其它含硫化合物:石油磺酸盐、石油磺酸的钠皂、钡皂和钙皂都可以用作油溶性缓蚀剂。巯基苯并噻唑、烷基磺酸钠等。 磷酸酯及其它含磷化合物:常见有酸性磷酸酯、酸性亚磷酸酯及硫代磷酸酯等。 防锈油即为基础油脂+油溶性缓蚀剂+辅剂组成的,国内常用的油溶性缓蚀剂有石油磺酸钡、二壬基萘磺酸钡、十二烯基丁二酸、氧化石油脂及其皂类、硬脂肪铝、环烷酸锌、羊毛脂及其皂类、苯并三唑、咪唑啉衍生物等。辅剂指抗氧化、助溶、消泡、抗熔、抗凝固以及提高低温附着力的助剂。 作用机理有两种理论,膜理论理论认为,缓蚀剂分子吸附在金属表面后,会与金属发生化学反应,生成难溶于水的钝化膜(相膜),从而阻滞了腐蚀电池的电极过程。如铜缓蚀剂苯并三氮唑(BTA)即属于该类。吸附理论分为物理吸附和化学吸附,当在金属表面涂敷防锈油之后,便迅速形成了3层吸附膜防护层,即在油-金属界面上的缓蚀剂分子定向排列的吸附层,与缓蚀剂分子非极性尾相互交溶而垂直向外的有序排列的油分子层,以及缓蚀剂分子在气-油界面上的一层单分子吸附膜。 c.气相缓蚀剂 气相缓蚀剂,即挥发性缓蚀剂,能在常温下自动挥发出气体,依靠它所挥发的缓蚀分子或缓蚀基团在金属表面作用,从而阻止金属锈蚀或降低金属大气腐蚀速度。其作用机理是气化以后,和空气中的湿气一起凝结在金属表面,形成液膜。 气相缓蚀剂具有经济、有效、干净、清洁的特点,由于气体是无孔不入的,所以无论是金属制品的表面,还是内腔、沟槽甚至缝隙部位均可得到保护。气相缓蚀剂使用时不必直接接触金属表面,特别适合于结构复杂的金属制品与构件的非涂装性保护,主要作为气相防锈包装材料应用于金属制品的储存和运输。 为了使气相缓蚀剂能有效发挥作用,使用空间应当是封闭的。气相缓蚀剂的应用方式很多,如,将气相缓蚀剂粉末装入布袋内或直接散布于机械设备的不同部位;将制成不同形状的片、丸、锭剂;还可以制成气相防锈纸、气相防锈液、气相防锈油。 气相缓蚀剂应当有比较大的蒸汽压,容易挥发充满金属设备所在空间。有机二胺或多胺化合物作是通过阻止金属腐蚀的阳极过程来减缓腐蚀。有机胺分子量较小且有较高的饱和蒸气压,在一定条件下容易挥发,在金属表面形成一种保护膜,或者能与酸性气体发生反应,从而抑制金属的气相腐蚀。而且,缓蚀剂的稳定性能很好,不因光、热等因素的影响而降低缓蚀剂性能,即使空气湿度增加。 气相缓蚀剂主要种类有: i.机酸与有机酸的铵盐。如苯甲酸铵、碳酸铵、亚硝酸二环己胺、亚硝酸二异丙基胺等。它们主要是钢铁的缓蚀剂,少数对Cu、Al也有缓蚀作用; ⅱ.基化合物及其胺盐。如硝基甲烷、间硝基苯酚、α-硝基氮茂等。主要适合于黑色与有色金属的缓蚀剂; ⅲ.酯类。如邻苯二甲酸二丁酯、己二酸二丁酯和醋酸异戊酯等; ⅳ.混合型。如亚硝酸钠+磷酸氢二铵+碳酸氢钠、亚硝酸钠+苯甲酸铵、亚硝酸钠+乌洛托品、亚硝酸钠+尿素等,适用于黑色金属。 有机胺均有很大毒性,因为挥发性大,气相缓蚀剂在排放过程中很难处理,容易被人体吸入,使用受到限制。氨基酸具有无毒、易分解特点,是气相缓蚀剂的发展方向。 06 金属材料的品种分类 分为黑色金属(如亚硝酸盐、钼酸盐、胺等)、铜(如苯并三氮唑、2-巯基苯并噻唑等)、铝(如硫脲、硅酸盐等)、不锈钢(如CdSO4、CaSO4等)缓蚀剂等。 07 介质的酸碱性分类 分为酸性介质、中性介质和碱性介质缓蚀剂。 a.中性介质中的缓蚀剂 是指在pH值为6-8的水溶液中使用的缓蚀剂。该类缓蚀剂是水溶性的。常见的有聚磷酸盐、铬酸盐、硅酸盐、碳酸盐、亚硝酸盐、苯并二氮唑、2-巯基苯并噻唑、亚硫酸钠、氨水、肼、环己胺、烷基胺、苯甲酸钠等。 亚硝酸钠适用于黑金属,但不能用于铜等有色金属; 三乙醇胺与油酸作用后可作为乳化剂,用于配制乳化切削液,也用于气相防锈剂。 六次甲基四胺(乌洛托品)与其他水溶性防锈剂配合使用。 苯甲酸钠可与其他缓蚀剂配合使用。 b.酸性介质中的缓蚀剂 一般酸性介质缓蚀剂均属于吸附型缓蚀剂,该类缓蚀剂一般用于金属除锈及除氧化皮的酸洗过程中,故称酸洗缓蚀剂。该类缓蚀剂的作用是在酸溶解金属上的氧化皮、锈蚀产物的同时,抑制酸对金属基体的溶解。常用的酸性介质缓蚀剂有二邻甲苯基硫脲,主要用于黑色金属酸洗,但有促进渗氢的危险;乌洛托品适用于硫酸、盐酸除锈液,对降低渗氢有效,缓蚀效率较高;若丁,邻二甲苯基硫脲、糊精、氯化钠、皂角粉的混合物,用于黑色金属。KC缓蚀剂,动物蛋白及其水解产物,对钢铁在硫酸中有缓蚀效果。 c.碱性介质中的缓蚀剂 常温条件下, 在NaOH、Na2CO3、氨水等稀碱溶液中, 一般金属(除铝、铅、锡等两性金属外)的腐蚀速率很低。然而在环境温度升高、碱溶液浓度增加时, 则有可能产生明显的腐蚀过程。此外, 当碱溶液中有溶解氧存在时,铜及铜合金的腐蚀进程加剧。为此,针对不同的金属材料和介质开发了在碱性环境下使用的缓蚀剂以解决金属材料在碱性环境下的全面腐蚀、点蚀和应力腐蚀等。如,稀NaOH(质量分数2-3%)溶液中,可采用向介质中通入H2S的方法抑制海军黄铜腐蚀;糖类有机化合物可抑制氨水对铜及铜合金的腐蚀。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414