近日,包括“科学探索奖”发起人谢晓亮、获奖人付巧妹在内的十余位著名科学家,分别对Science杂志评选出的2021年十大科学突破进行解读,深入解析其科学价值。
人工智能预测蛋白质结构
从蛋白质分子的序列出发准确预测其结构是分子生物学的“圣杯”问题之一,具有高度的科学和应用价值。2021年11月17日,Science杂志公布了年度十大科学突破榜单,其中“人工智能预测蛋白质结构”第二次入选;该进展同时也被列为Nature杂志2021年十大科技新闻之一、Nature Methods 杂志2021年度技术。
基因组是编码生命信息的蓝图,而蛋白质是将这张蓝图付诸实施的工人。蛋白质执行生命活动功能的基础是其折叠形成的独特结构。解析蛋白质结构对探索生命活动分子机制和药物研发都具有重大意义。目前,解析蛋白质结构主要依靠X射线晶体衍射(X-ray Crystallography)、核磁共振(NMR)以及冷冻电镜(Cryo-EM)等实验技术,这些技术一直面临着通量低、成本高、周期长等问题,严重制约了解析蛋白质结构的速度。截至当前,已知的十几亿蛋白序列中仅有不到二十万对应的结构被实验解析。
幸运的是,早在20世纪60年代,Christian Anfinsen就通过实验证明蛋白质的序列决定了其结构(Christian Anfinsen因此获得1972年诺贝尔奖)。求解蛋白质序列和其三维结构之间的映射关系,即蛋白质结构预测,成为诸多分子生物学家的梦想。然而,这个映射关系非常复杂,传统的基于物理和数学的方法难以解决。随着实验数据的积累,基于进化分析的新思路,特别是人工智能方法的发展,预测精度近几年得到突破性提升。从2016年RaptorX首次将深度残差网络应用于残基接触图预测,到2018年AlphaFold1设计深达200多层的残差网络,再到2020年AlphaFold2通过端到端的神经网络设计,终于将蛋白质结构预测的精度提升到接近实验方法结构解析的精度,引起了整个生物学领域的巨大轰动。AlphaFold2团队随后于2021年在Nature杂志连发两篇文章,公开了方法的实现细节和部分源代码,预测了整个人类蛋白质组的结构,并免费向公众开放(https://alphafold.ebi.ac.uk)。同年,华盛顿大学的Baker团队开发了RoseTTAFold,同样利用深度学习技术准确、快速地预测蛋白质结构。
AlphaFold2的突破是人工智能工程实践的巨大成功。从蛋白质结构预测角度来看,AlphaFold2并没有引入新的思路。然而,AlphaFold2成功实现了端到端的蛋白结构预测框架,直接通过PDB文件中原子的三维坐标来学习模型的参数。AlphaFold2大量应用了深度学习的新技术和技巧,包括针对三维结构等变性质的点不变注意力模块、融合序列和结构信息的变换神经网络Evoformer模块、迭代优化和知识蒸馏策略等。AlphaFold2开发团队包括多位深度学习工程师,他们使用了谷歌公司大量计算资源,在海量多序列比对信息上进行学习,对其复杂模型进行各种调试、优化,最后得到一套精确的预测模型。
AlphaFold2的突破将带领结构生物学研究和药物开发进入新的时代。AlphaFold2可以赋能结构生物学新的研究方向,比如加速X射线晶体衍射和冷冻电镜等实验技术解析蛋白质结构的速度、结合冷冻电镜单颗粒分析(SPA)和电子断层扫描(Cryo-ET)解析超大蛋白质复合物结构,甚至是其在细胞内的原位结构。AlphaFold2将启发新的药物发现方法的出现。药物分子通过与靶标蛋白作用而发挥药效。根据AlphaFold2预测的目标蛋白结构,可以对该蛋白的成药性进行大致判断并进行药物分子设计。AlphaFold2还将促进新功能蛋白质的设计,比如可以利用AlphaFold2针对新型冠状病毒设计更高效抗体,为解决新型冠状病毒大流行提供新型解决方案。
AlphaFold2的突破甚至可能加速生命科学新研究范式的来临。如前所述,AlphaFold2的突破是人工智能的巨大成功,是大数据的巨大成功,也是工业化科研的巨大成功。随着测序、影像、结构等新生物技术的开发和广泛应用,生命科学已经发展成为数据驱动的学科。生命系统的复杂性为人工智能提供了科学问题的沃土。这两者在工业化组织形式下,必将催生基于大数据和人工智能的新生物学研究时代。
当然,我们也要看到,虽然AlphaFold2取得了巨大的突破,但蛋白质结构预测的问题并没有得到完全解决。目前,AlphaFold2对于序列较长的蛋白质、不存在同源序列或同源序列较少的孤儿蛋白预测效果明显变差;对于蛋白质无序区域,蛋白质结合位点,特别是大的蛋白质复合体结构预测上仍然有较大挑战;对于造成蛋白质结构变化的突变,AlphaFold2也不能很好地预测。这些问题期待在未来,随着结构生物学与人工智能的进一步发展及更深度交叉融合下取得新的进展。但有鉴于此,在现阶段我们不宜过分夸大基于AlphaFold2的结构预测在结构生物学研究、药物开发中的作用。
华人科学家在蛋白质结构预测领域取得了诸多里程碑式的成果。如在早期CASP比赛中一直处于前列的I-TASSER、RaptorX、trRosetta等方法的领导者和核心成员都是海外华人。随着中国经济的高速发展和科研投入的不断加大,中国科学家在蛋白质结构解析和人工智能研究领域已经跻身世界前列,这为进一步发展蛋白质结构预测及相关研究奠定了基础。期待在不久的未来,中国科学家在蛋白质结构预测、冷冻电镜结构解析、新功能蛋白质设计、药物设计等领域开发出更多原创性的方法,获得更多具有突破性的成果。
解读专家
张强锋 | 清华大学生命科学学院副教授
徐魁 | 清华大学生命科学学院助理研究员
解锁古老泥土DNA宝库
最近,沉积物古DNA研究领域的三项最新研究首次从世界不同洞穴遗址的沉积物里获得古核DNA以揭示相关物种的演化历史。这些重要进展共同以主题“解锁古老泥土DNA宝库”,入选Science杂志“2021年度十大科学突破”,标志着沉积物古DNA研究正式迈入全基因组阶段,为远古生物的遗传演化研究打开新的窗口。
众所周知,古DNA研究自20世纪80年代以来,通过从生物骨骸或化石中提取丰富的遗传信息,为揭秘地球上各种生物群落,特别是现代人类的演化历程带来前所未有的变革与全新的认识。然而,古DNA领域在很大程度上往往依赖于古生物骨骸或化石的来源与保存情况,在材料上受到极大的限制。为探索在生物骨骸或化石材料之外获取古DNA的可能,沉积物古DNA研究作为一个新的分支,在20世纪初悄然而生。
科学家们在很早就已明确古DNA可以在沉积物里长期保存,但是直到2021年以前,该领域的探索仍只停留在通过线粒体DNA片段鉴定相关生物种群的存在,重建远古生态环境或是了解相关物种的时空分布和生存活动历史上。因线粒体DNA可提供的遗传信息有限,以核DNA信息为基础的群体遗传学研究一直无法得以开展。经过数十年的不断探索,沉积物古DNA研究终于迎来新的契机——核DNA提取与研究的突破。
2021年4月,哥本哈根大学维勒斯列夫团队率先从墨西哥北部Chiquihuite洞穴距今1.6万至1.4万年的沉积物样本里,获取古代黑熊和已灭绝的巨型短面熊的低覆盖度核基因组,这是从沉积物里首次获得史前生物的核DNA,创造性解答了有关熊科动物种群分化及美洲黑熊起源和迁徙的重要科学问题,最重要的是研究从沉积物里大量破碎的基因组序列重建、识别出相似物种的核DNA并展开种群间系统发育关系的探索。
而后,维也纳大学佩雷·格拉伯特团队从美国佐治亚州Satsurblia洞穴距今2.5万年的沉积物样本中提取到携有尼安德特人基因的古欧亚人女性、已灭绝狼和野牛的核基因组,并揭示这三个物种晚更新世时期的遗传历史。这一研究探索了单个沉积物样本提取多种物种核DNA的可能,并在沉积物所获基因序列片段的个体来源鉴定方法上有所突破。
最重要的一项进展是马蒂亚斯·迈耶团队通过开发新的古核DNA富集方法及设计特异性的分子探针组,从西班牙北部Estatuas洞穴沉积物里成功捕获到多个来自不同遗传谱系的尼安德特古人类核DNA,揭示此地在约10万年前发生尼安德特人种群更替的事件。这一突破对人类古基因组学研究尤其具有里程碑意义,它表明科学家们未来将可能从更多不管是否有人类遗骸或活动痕迹的更新世时期遗址沉积物里去探寻可能存在的远古人类,为更全面探究灭绝古人类迁徙、演化和环境适应的历史提供了更多可能。
这三项突破性成果在很大程度上代表着古DNA领域的材料革命,它就像一把钥匙,为我们打开沉积物里埋藏着的巨大古DNA宝库的大门;为我们跨越人类骨骸或化石材料的限制,在更宏大时空框架下探究远古不同人类群体及其他生物种群的起源、演化、扩散和适应等重大科学问题开辟了新的视角。未来,世界各遗址沉积物将成为常规而不限量的古DNA研究材料以至古生物基因组的来源,而沉积物古DNA研究也将成为演化与群体遗传学最强有力的工具,为我们探索远古丰富的生命世界开启新的征程。
解读专家
付巧妹 | 中国科学院古脊椎动物与古人类研究所研究员、分子古生物学实验室主任,2019年“科学探索奖”天文和地学领域获奖人
实现历史性核聚变突破
“阳春布德泽,万物生光辉”,普照世界的太阳的能量来自于热核聚变。热核聚变能是宇宙中亿万恒星能量的来源,也是人类梦寐以求的能源。一旦实现可控热核聚变放能,将一劳永逸地为人类社会提供无穷无尽的清洁能源。从发现核聚变现象以来,人类就开始梦想实现人工聚变放能。在20世纪50年代,人类制造了氢弹,实现了不可控的聚变放能。自此伊始,可控核聚变,即实验室“人造太阳”或“微氢弹”,就成了世界主要核大国的国家追求,也是全球科学精英们梦寐以求的科学“圣杯”。
为了实现实验室“人造太阳”,人们提出了多种技术途径。其中,间接驱动惯性约束聚变(Inertial Confinement Fusion,ICF)是核大国研发投入最多的技术路线之一。在ICF中,由若干个足球场大的激光装置所产生的激光被注入到长度为厘米级的黑腔中,并在黑腔内壁上转换成X光,X光驱动位于黑腔中心、尺度为毫米级的球形氘氚靶丸进行内爆;氘氚燃料中心的“热斑”被压缩至可媲美太阳中心的极端高温、高密度、高压状态时,便以极快的核聚变反应速率在燃料解体前释放出巨大的聚变核能。当聚变放能与驱动激光能量相当时,即科学上定义的“点火”。ICF点火是一项集理论、实验、诊断、制靶和激光装置于一体的高精尖大科学工程,难度极大。美国有关ICF的研究一直处于严格保密状态直至20世纪90年代。在我国,氢弹之父、国家功勋奖章获得者于敏院士于20世纪70年代初期提出ICF概念。在ICF这条路上,除了美国和中国,同台竞技的还有核大国法国和俄罗斯。
美国于2009年率先建成以点火为目的、驱动激光能量为1.9兆焦耳的国家点火装置(National Ignition Facility,NIF)并启动国家点火攻关,雄心勃勃要在2012年实现点火。然而,因所获聚变放能远远低于驱动激光能量,NIF点火攻关黯然落幕。之后,美国科学家不懈努力,在致力于点火的艰辛征途上,将其理论、实验、诊断、制靶和激光装置都推到了极致和完美,终于在2020年底至2021年初分别取得0.05兆焦耳、0.17兆焦耳的系列好成绩。更令人惊喜甚至难以置信的是,短短几个月之后,2021年8月8日,美国科学家在NIF上突破性获得1.3兆焦耳聚变放能,占驱动能量的70%,成功抵达点火门槛!这是可载入聚变史册的巨大成就,标志着ICF研究从此进入了全新的物理空间,对相关的核物理、天体物理、等离子体物理和高能量密度物理研究都具有划时代的意义。特别是,意味着人类能够在实验室中创造“人造太阳”,并从此踏上了追求可控聚变能源的新征程。美国这一重大成果入选Science 杂志2021年度十大科学突破。用美国NIF装置ICF项目首席科学家Omar Hurricane的话说,“这是聚变的莱特兄弟时刻”。
实验结果的可重复性至关重要。经过精心准备,美国NIF于2021年10月进行了重复实验,不过这次仅获得0.5MJ的聚变放能。在间接驱动ICF中,创造出一个在时间、空间和频谱上均满足点火靶丸要求的准球形辐射驱动源是获得近理想设计的聚变产能的大前提,而如何创造这个大前提则与ICF黑腔构型技术路线的选取密切相关。几十年来,ICF一直以柱腔构型为主流路线。美国NIF装置便采用柱腔构型设计。纵观美国与ICF点火较量的这12年,其与柱腔中辐照不均匀度的博弈以及试图获知柱腔中靶丸所感受到的辐射驱动源特性的努力贯穿始终。ICF的大前提成为NIF的大难题。美国漫长而艰难的点火之路与美国过于自信地选择柱腔技术路线有关。下一步,美国要在NIF装置上获得可重复、可预测的高增益聚变产额,必然面临着更巨大的挑战。不过,美国NIF的1.3兆焦耳放能必将激励人们在最近若干年,针对简单、高效、大裕量的新型点火靶设计,采用可被黑腔高效吸收的新技术激光,升级改造现有点火装置甚至从头打造新一代点火装置,以便能稳定获得高增益聚变产额、可兼顾间接驱动、直接驱动、混合驱动等多种激光聚变方式。
解读专家
蓝可 | 北京应用物理与计算数学研究所研究员
任国利 | 北京应用物理与计算数学研究所副研究员
抗新冠强效药出现
近日揭晓的Science杂志2021年十大科学突破,以“抗新冠强效药出现”为题,介绍了默克(Merck & Co.)和辉瑞(Pfizer)公司研发的莫努皮拉韦(Molnupiravir)和PF-07321332两款抗病毒药物。
新冠病毒(SARS-CoV-2)引发的新冠肺炎疫情(COVID-19)已持续两年,造成全球近3.2亿人感染和550多万人死亡[1],成为21世纪以来人类社会面临的最严重的疫情之一。疫情发生后,针对新冠病毒的疫苗和中和抗体药物等防治手段取得巨大进展,但不断出现的突变株(如Delta株、Omicron株等)向当前使用的疫苗和中和抗体药物提出挑战,迫切需要深入研究各型突变株中高度保守的药物靶点,并据此发展具有广谱抗病毒效果的药物。特别是发展能够口服使用的药物,还能有效减轻医院资源的压力,提高对重症患者的治疗效率。
在新冠病毒编码的蛋白中,主蛋白酶(Main Protease,Mpro)和RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp)在病毒复制中发挥最核心的功能,不但在人体内没有同源蛋白,而且在各突变株中高度保守,是发展广谱抗病毒药物的核心靶点[2]。
默克和辉瑞研发的两款药物即是分别针对这两个靶点的药物,各具显著创新性。默克研发的莫努皮拉韦是一种典型的核苷类似物类的聚合酶抑制剂(Nucleotide Analogue Inhibitor),其作用原理是通过模拟天然核苷酸,被病毒聚合酶掺入新生成的病毒核酸中,导致新生核酸产生突变或合成停止,进而抑制病毒复制[3]。与莫努皮拉韦类似,新冠肺炎疫情发生之初备受瞩目的瑞德西韦(Remdesivir)也是具有类似机制的药物。莫努皮拉韦之所以能够展现比瑞德西韦更好的药效,其中一个非常重要的原因是莫努皮拉韦能够逃逸病毒“复制校正”(Proofreading)过程,防止被病毒去除掉,因此在临床研究中展现了更好的治疗效果,可降低高危人群30%的住院或死亡几率。
辉瑞研发的PF-07321332是一种典型的蛋白酶抑制剂(Protease Inhibitor),能够可逆共价结合在新冠病毒主蛋白酶的活性位点,从而阻断其功能。针对冠状病毒主蛋白酶抑制剂研究已有较长历史[4,5],但由于此类抑制剂的代谢和生物利用度的局限,一直限制了临床应用。辉瑞公司创新性地使用利托那韦(Ritonavir,是一种HIV蛋白酶抑制剂)与PF-07321332联合使用,利用利托那韦能够有效抑制代谢药物的细胞色素CYP3A4蛋白的活性,有效提升了PF-07321332的代谢特性和生物利用度,临床研究表明如果在早期服药,可降低89%的住院几率,为发展针对新冠病毒蛋白酶的药物提供了一条新的路径。
自疫情发生后,我国科学家在新冠病毒核心抗病毒药物靶点机制研究中取得了全球领先的基础研究成果,在新冠病毒主蛋白酶与抑制剂作用机制[6,7]、聚合酶结构与核苷类药物作用机制[8-10]、核苷类药物逃逸机制[11]等研究中取得重要突破。同时,在针对主蛋白酶的抗病毒药物发现中也取得系列突破,筛选、设计和研发了一系列具有良好抑制效果的主蛋白酶抑制剂[6,12-14],其中一些抑制剂已开展临床试验。今后一段时间,我国抗新冠小分子药物研究应着重解决的问题包括,阐明核苷类抗病毒药物的逃逸机制,并发展具有更好抑制效果的核苷类抗病毒药物;进一步提升主蛋白酶抑制剂的抑制效果,改善其生物利用度;解决抗病毒药物口服使用的关键技术问题等。
药物研发是需要长期积累和投入的研究领域。我国在抗新冠病毒药物机制和药物研发中已有相当好的基础,相信假以时日,一定可以研发成功中国的抗新冠小分子药物。
解读专家
饶子和 | 中国科学院院士,清华大学教授
“摇头丸”可治疗创伤后应激障碍
创伤后应激障碍(PTSD)是一种常见的精神疾病,指个体在经历重大灾难性事件后所形成的一种精神障碍,严重的PTSD常伴有酒精依赖、抑郁甚至自杀意图等。PTSD的终生患病率为1.3%~12.2%,对人类健康造成严重损害,对社会资源造成巨大消耗。认知行为疗法是目前PTSD的金标准疗法,但是,仍有相当一部分患者对该疗法无反应,因此脱落率高居不下。选择性5-羟色胺再摄取抑制剂(SSRI)舍曲林和帕罗西汀是美国食品和药物管理局(FDA)批准用于治疗PTSD的一线疗法,然而,传统药物治疗对40%~60%患者没有改善作用。因此,发现新的治疗手段已成为国际上研究的热点。
致幻剂是一类能让人产生幻觉的精神活性物质,曾为缓解PTSD等精神疾病带来希望,但证明它们有效性的大规模、严格的临床试验却寥寥无几。2021年5月发表在Nature Medicine上的一项多中心、随机、双盲和安慰剂对照的Ⅲ期临床研究发现,结合心理治疗,致幻剂二亚甲双氧安非他明(MDMA,俗称“摇头丸”)辅助治疗能够显著减轻PTSD的症状,并因此入选Science 2021年度十大科学突破。在该研究中,79名受试者完成2个月的临床试验后,67%的MDMA组受试者不再符合PTSD的诊断标准,而安慰剂组则仅为32%。
除了MDMA,常见的致幻剂还包括赛洛西宾(Psilocybin,又称裸盖菇素,从“神奇蘑菇”中提取的一种天然致幻剂)、麦角二乙胺(LSD)和麦司卡林(Mescaline)等。在我国,致幻剂属于Ⅰ类精神药品,对它们的持有和使用都受严格管制。目前世界上绝大部分国家和地区都将致幻剂列为Ⅰ类管制药品。近几年随着投资者和科学家重新关注致幻剂的精神治疗潜力,一系列临床试验得以开展,初步的研究结果显示,相比传统抗精神疾病类药物,致幻剂在缓解抑郁症、焦虑症、成瘾症和PTSD等精神疾病的症状方面具有起效快、持续时间长等特点,因此可能具有巨大的临床应用前景。以赛洛西宾为例,2016年5月发表在The Lancet Psychiatry上的一篇报道就指出,赛洛西宾治疗难治性抑郁症显示出良好的耐受性,间隔7天的两次用药使患者在一周后抑郁症状得到明显缓解甚至消失,且疗效持续达3个月。2020年11月英国精神保健公司COMPASS Pathways报道的迄今为止完成的最大规模(233例)的ⅡB期双盲对照研究发现,结合心理治疗,单剂量的赛洛西宾能在1天后迅速缓解难治性抑郁症的抑郁症状,且疗效持续达3个月。2020年11月发表在JAMA Psychiatry上的一项临床研究报道,结合心理治疗,单剂量的赛洛西宾能在1天后迅速缓解重度抑郁症的抑郁症状,而间隔7天的两次用药能在1周后显著减轻重度抑郁症患者的抑郁症状,且疗效持续达1个月。由于传统抗抑郁药的起效时间通常在3~4周,且对近三分之一的抑郁症患者无改善作用,因此,赛洛西宾可能不仅对传统抗抑郁药物无效的抑郁症具有缓解作用,而且对传统抗抑郁药物有效的抑郁症也展现出更好的疗效。此外,赛洛西宾在PTSD、焦虑症和成瘾症等精神疾病中可能也有治疗潜力。
近十年来,有关致幻剂的基础和临床研究开始复苏。但是,致幻剂要摆脱“毒品”成为“药品”,科学家还只是“万里长征走完了第一步”。其中一个重要原因是治疗剂量的致幻剂往往也具有致幻作用。可喜的是,最新研究发现,致幻剂的抗精神疾病作用可能不依赖于其致幻作用。2020年12月发表在Nature上的一项研究中,科学家鉴定出致幻剂伊博格碱(Ibogaine)中具有治疗作用的关键基团,并以此为基础合成了一种无毒、非致幻性的水溶性致幻剂类似物Tabernanthalog,后续的动物研究发现这种新化合物不仅保留了伊博格碱的抗成瘾作用,还增加了抗抑郁作用。我国科学家最新研究发现,基于结构改造的致幻剂可以分离出致幻和抗抑郁作用,并以此为基础设计并合成一系列新型化合物,并在动物研究中证实该系列化合物无致幻作用,但具备与致幻剂相似的快速抗抑郁效果,该研究于2022年1月发表在Science杂志上。随着对致幻剂治疗作用的深入了解,科学家有望在不久的将来开发出更安全、非致幻性的新化合物用于疾病治疗。
解读专家
高天明 | 中国工程院院士,南方医科大学教授
单克隆抗体治疗传染性疾病
1890年,冯·贝林和北里柴三郎[15]在《动物对白喉和破伤风免疫的机理》的论文中报道了血清含有具免疫作用的物质“抗毒素”,含“抗毒素”的血清能治疗和预防动物感染,而“抗毒素”就是我们现在熟知的“抗体”。正如保罗·埃里希[16]在诺贝尔奖的演讲中将“抗毒素”和“毒素”的关系比作“钥匙”和“锁”,抗体具有特异性结合抗原的能力,这是抗体能够阻断病原体入侵和清除病原体的前提。作为体液免疫的主要成分,每个B细胞可产生一种抗体,从而使人体拥有丰富的B细胞库和抗体库,帮助机体抵御疾病。
单克隆抗体是从感染者、免疫动物或者体外抗体展示库等中分离出的能结合抗原的单一抗体。研究者通过测序手段得到抗体的序列后,可以在体外细胞中大量表达抗体蛋白。这些基因工程重组单抗比抗血清成分单一、可扩大生产,比小分子药物特异性强、副作用小。随着近年来单细胞技术、疫苗优化、蛋白质结构解析等诸多新技术的发展,研究者能更快获得高质量抗体。
近期,Science杂志发布了2021年“十大科学突破”,单克隆抗体应对传染性疾病入选[3]。单克隆抗体在应对如新冠、埃博拉、吸入性炭疽、复发性艰难梭状芽孢杆菌感染、艾滋病、疟疾、婴儿呼吸道合胞病毒感染等诸多危害性大的传染性疾病方面有重要新进展[17]。能阻断传染性病原体的抗体被称为“中和抗体”。
在新型冠状病毒流行的背景下,国内外研究者在新冠病毒中和抗体研究方面进展迅速。再生元的REGEN-COV抗体对、礼来的Bamlanivimab和Etesevimab、VIR的Sotrovimab、阿斯利康的Evusheld抗体对率先获得美国FDA的紧急使用授权[18]。Sotrovimab来源于非典康复者,具有较好的广谱性。Etesevimab是我国中科院微生物所严景华/高福团队最初发现的中和抗体。我国清华大学张林琦团队、深圳市第三人民医院、腾盛华创公司共同开发的Amubarvimab/Romlusevimab抗体组合在2021年12月获得我国药品监督管理局批准上市。我们团队利用高通量单细胞测序技术筛选出多个高活性中和抗体,其中DXP-604在全国多地的同期用药临床实验中效果良好。
然而,病毒变异株的不断出现使研究者夜以继日开发出的许多抗体遭到逃逸,努力付诸东流。目前,多数中和抗体药物已被新冠流行变异株逃逸[19-21]。由于被奥密克戎变异株逃逸,FDA停止了REGEN-COV,Bamlanivimab/Etesevimab以及Sotrovimab的紧急使用授权[18];国产Amubarvimab / Romlusevimab已被奥密克戎BA.2,BA.2.12.1,BA.4/BA.5变异株逃逸[22];DXP-604也对BA.4效果大打折扣。研究人员陆续报道了一些能中和多种变异株的抗体,但这还远不够。一方面,新冠病毒若不能在全世界被有效控制,一定会不断进化产生新的逃逸突变;另一方面,人类也面临诸多其他乙型冠状病毒属2型病毒的威胁。因此,我们应尽可能地寻找有效抵抗乙型冠状病毒属2型病毒的广谱抗体,而不仅是抗新冠变异株的广谱抗体,以更高效的方式应对冠状病毒的威胁。这一目标要求我们更深入理解新冠病毒及其他近源病毒的保守位点和抗体的中和机制。美国Jesse Bloom团队开发的酵母展示突变扫描技术能有效预测逃逸新冠抗体的突变逃逸位点[23],而我们团队使该实验体系的通量提高了两个数量级,使得我们可以系统性地描述抗变异株抗体和其他乙型冠状病毒属2型病毒广谱抗体的表位分布和特征[19],让我们可以在实验室里寻找最难被逃逸的抗体。
新兴技术进步与中和抗体研究相辅相成。例如,将高通量单细胞测序技术运用于抗体测序大大提高了实验通量并降低了单个细胞的实验成本、扩展了抗体筛选库。而高通量突变扫描技术使全面快速描述抗原表位和特征成为可能。在研究新冠病毒中和抗体中获得的经验教训也对其他病原体的抗体研究提供了宝贵借鉴。我们相信,不断通过生命科学与医学理论与技术创新,人类一定能通过科学的力量战胜疫情。
解读专家
谢晓亮 | 生物物理化学家,北京大学李兆基讲席教授,“科学探索奖”发起人之一
曹云龙 | 北京大学生物医学前沿创新中心(BIOPIC)副研究员
阿依江·伊斯马衣 | 北京大学生命科学学院博士研究生
“洞察”号首次揭示火星内部结构
对类地行星内部结构的探测与研究可了解行星的起源和演化,也有助于理解行星地球的过去、现在和未来。2018年11月26日,美国宇航局“洞察”号(InSight)火星探测器携火震仪成功着陆于火星赤道附近,开启了人类探测火星内部结构的新篇章。国际研究团队于2021年7月23日在Science连续刊发三篇文章,逐一揭开火星壳、火星幔和火星核的神秘面纱。这一系列重要发现对刻画火星的内部结构、约束火星的物质组成及热演化都具有重要意义,这是人类火星科学探测史上的一个里程碑。
火星是太阳系中与地球最为相似的一颗行星。尽管当今火星与地球的环境迥异,但是许多地质证据显示出其早期存在过宜居环境。在火星演化过程中,磁场是如何产生,又怎样消亡?是什么导致了火星大气和液态水的逃逸,造成火星环境的剧变?为什么缺失板块构造运动?内部过程是行星演化的重要引擎。对火星内部结构的探测研究,不仅有助于理解火星的起源和演化,也是认识其宜居性的关键。在美国宇航局“洞察”号(InSight)任务前,人类对火星的内部结构知之甚少。前期研究主要依赖于火星轨道卫星重力和地形数据,间接推测火星壳的厚度约在30km到100km之间,火星核的半径约为1400km至2000km。然而,关于火星的详细内部圈层结构,火星核的大小、成分和物理状态(固态或液态),火星震活动频率及分布等几乎都是完全未知的。
行星地震学方法是探测行星内部结构和状态最有效的手段。通过布设行星地震仪,分析其记录到的行星地震事件及背景噪声,获得行星内部的壳、幔、核结构,并间接约束其物质组成及动力学过程。“洞察”号的英文“InSight”源自“基于地震、大地测量与热传导的内部探测”(Interior exploration using Seismic investigations, geodesy and heat transport)的首字母缩写。这一名称也指明了任务的首要科学目标是“洞察”火星内部。本次任务的最大亮点是首次实现在火星表面布设火震仪,开启了人类利用行星地震学方法探测火星内部结构和火星震活动的新篇章。
经过两年多的探测,火震仪共记录到733次有效火星震信号,包括大量震源位于壳内的高频事件和少量源于火星幔的低频事件。尽管这些火星震都不强烈,最大的规模也仅有4.0级,但部分低频事件包含较清晰的穿透火星幔的震相。研究发现,“洞察”号着陆区的火星壳具有分层特性,厚约20km或39km。结合火星全球重力及地形数据,推测整个火星壳的平均厚度在24km到72km之间,较早期的预测厚度更薄,为火星壳生热和火星硅酸盐分异程度提供了新的约束。随着深度增加,火星幔波速总体增加,但在400~600km深度处存在明显的低速层,可能对应于火星软流圈,表明火星岩石圈厚度约400~600km。在火星更深部,火星核的半径约为1830km,平均密度为5.7~6.3g/cm3。这表明火星核半径大于早期的估计,而且火星核含有大量的轻元素。研究还发现,不同于地球,火星只有上火星幔和火星幔过渡带,缺失下火星幔,这对于探讨火星核和幔的成份、火星热演化动力学过程以及火星磁场等具有重要意义。上述基于“洞察”号火震仪观测研究揭开了火星壳、幔和核的神秘面纱,研究成果入选了Science杂志2021年度的“十大科学突破”。
我国已迈入深空探测快速发展新时代。“嫦娥五号”任务成功携月壤样品返回地球,“天问一号”首次火星探测任务已成功实现“环绕、着陆和巡视”,国家航天局还拟实施一系列的月球和行星探测任务。内部结构的地球物理探测与研究仍是月球和行星探测的前沿方向。一方面,我国需加强行星地震仪自主研制能力,积极研制新一代的行星地震仪,如光纤行星地震仪,6分量旋转行星地震仪等。另一方面,科研人员需提前做好技术和理论攻关,发展行星内部结构成像算法,并结合矿物学和动力学模拟等手段,增强行星内部结构及演化研究能力,加强科学、技术与应用协同创新,更好地服务国家深空探测战略发展。
解读专家
潘永信 | 中国科学院院士,中国科学院地质与地球物理研究所研究员,中国科学院大学地球与行星科学学院岗位教授
王新 | 中国科学院地质与地球物理研究所副研究员
粒子物理学的标准模型出现“裂缝”
自古以来人类对什么是宇宙中最小的基本结构以及它们如何相互作用充满好奇心,不断在不同层面进行理论和实验的探索,在20世纪60年代末70年代初建立起了描述基本粒子弱电及强相互作用统一的标准模型。2012年发现的希格斯粒子完美地完成了粒子物理标准模型的最后一块拼图。尽管标准模型取得了很大的成功,它仍然存在很多需要改进和完善的地方,需要回答如何把万有引力包括在模型内,有没有标准模型外的新粒子、新的相互作用等问题。但是希格斯粒子发现近10年时间过去了,仍然没有确切的新发现提供任何线索。2021年4月7日在美国费米实验室进行的缪子反常磁矩实验(Muon g-2)公布的首个结果表明作为基本粒子之一的缪子的行为存在与标准模型理论预言不相符的反常现象,引起了粒子物理界不小的震动。这一重要发现和进展入选了Science杂志2021年度的“十大科学突破”之一,也被很形象地称为标准模型出现的“裂缝”。这一“裂缝”也许将开启了解自然规律的新方向。

早在1997—2001年间,在美国布鲁克海文实验室的国际实验组就对aμ进行了精确测量。于2006年发表的最终结果发现理论预言和实验测量值存在2.7个标准方差的不一致性。为进一步提高测量精度,科学家们2011年组建了缪子反常磁矩合作组(Muon g-2),并决定把布鲁克海文实验室的半径约16米的超导储存环从纽约运到芝加哥郊区的费米实验室对aμ重新测量。2013年,超导储存环运到后,又搭建了相应的各项实验设备,并全面测试了整个系统。2018年运行一年采集了超过以前所有实验总和的数据量,然后用约3年的时间详尽分析这批数据。实验组于2021年4月7日在Physical Review Letters上发表了测量结果。结果显示,理论预言和实验测量值存在3.3个标准方差,支持布鲁克海文实验室的结果。结合布鲁克海文和费米两家实验室的数据,相对误差精度达到3.5×10??,理论预言值与实验值之差为251(±59)×10???。这一差异达到了4.2个标准方差。出现统计误差的概率仅有四万分之一。
标准模型可能出现了“裂缝”。这一“裂缝”有多严重?通常实验上5个标准方差是标定一个重大发现的临界点。费米实验室测量的aμ带来的可能“裂缝”一旦被“坐实”,将对粒子物理乃至整个科学领域产生颠覆性的影响。但即使仅4.2个标准方差,这已使得物理学界困惑已久的反常磁矩之谜受到了更多的青睐。人们提出了许多可能解释这一差异的从超对称、各种新粒子到多维空间的各种新物理模型。但是我们必须说目前还不能确认这一“裂缝”确实存在。其实就在费米实验室发表结果的同时,基于格点QCD计算的BMWc团队在Nature发表了他们的最新结果,表明理论预言和实验测量值只有1.6个标准方差的差异。当然这一理论计算结果还需要其他理论计算的进一步确认。这里特别指出BESIII在正负电子对撞质心能量1GeV以下可准确测量的e?e?→π?π?截面,能用来更精准地从理论上计算缪子反常磁矩。图1是理论预言和实验测量值现况展示。实验测量也需进一步确认。费米实验室还将继续运行至少一年采集新数据,到时能提供aμ 更为精确的测量值。另外,日本J-PARC的Muon g-2/EDM实验计划于2027年开始取数,以不同的测量方式互相验证费米实验室的测量结果。希望新的实验数据彻底揭开缪子反常磁矩之谜,使人类获得对自然界基本规律更深入的了解。
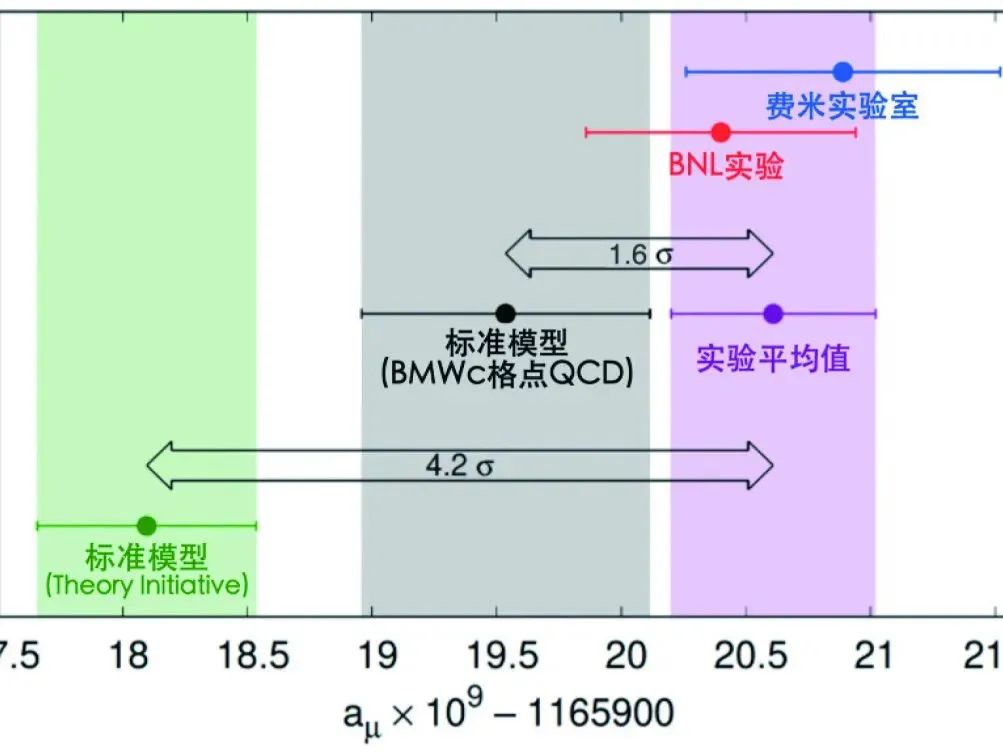
图1. 缪子反常磁矩最新理论计算和实验测量结果比较[24,25]
中国在缪子研究领域起步较晚,但近年来有了长足的进展。2012年上海交通大学成立缪子物理团队并参加了在费米实验室的缪子反常磁矩实验组,并在实验中起到了重要作用;他们还将参与实验组对缪子电偶极距以及与缪子有耦合的超轻暗物质的精确测量;也在2019年加入了瑞士PSI实验室的缪子电偶极距测量实验。此外,中国科学院高能物理研究所和近代物理研究所以及南京大学、中山大学和北京大学分别加入了日本高强度质子加速器实验室(J-PARC)的缪子电子转换实验(COMET)和缪子反常磁矩实验。中国科学院高能物理研究所、中国科学技术大学、近代物理研究所正在联合研制中国本土的基于中国东莞散裂中子源(CSNS)的强流质子加速器的首个缪子源设施(EMuS)。非常期待中国研究人员将在缪子研究领域作出更多原创性科学贡献。
解读专家
何小刚 | 上海交通大学李政道研究所李政道讲习教授
CRISPR基因编辑疗法对人类疗效首次证明
革命性的CRISPR基因编辑技术一问世就引发科研界和工业界的广泛关注。作为细菌和古细菌的获得性免疫防御系统,CRISPR系统于1987年首次被发现。2012年,来自美国和法国的两位女科学家杜德娜(Jennifer Anne Doudna)和卡彭蒂耶(Emmanuelle Marie Charpentier)第一次证明来自化脓性链球菌的CRISPR系统能够通过重新设计靶向特定的DNA序列进行定点切割,人们意识到CRISPR将是继ZFN和TALEN之后的第三代基因编辑工具。CRISPR系统主要包括两个元件—能够切割DNA的具有核酸酶活性的Cas9蛋白和能够通过碱基互补配对靶向特定DNA序列的向导RNA(sgRNA)。如此简单的组成,使得CRISPR系统不但功能强大,而且设计方便、使用简单、价格低廉,简单高效的第三代基因编辑技术从此打开了基因编辑的大门,科学家利用该技术可以轻易改写各种生命体的DNA,从植物到细胞系和各种模式生物,如酵母、果蝇、斑马鱼、小鼠、大鼠、猪和猴等。因对生命科学研究和疾病治疗领域产生的巨大推动作用,该技术在2013、2015、2017和2020年连续四次被Science杂志评为十大科学进展之一,并获得2020年诺贝尔化学奖。
2020年,人们首次将CRISPR技术应用于临床研究,通过体外造血干细胞基因编辑治疗β地中海贫血和镰状细胞贫血;2021年,由三家公司主导的CRISPR体内基因编辑治疗遗传性疾病临床研究也取得了可喜的进展。遗传性转甲状腺素蛋白(hATTR)淀粉样变性,属于常染色体显性遗传病,由转甲状腺素蛋白(TTR)基因突变引起,全球患病人数约5万人。TTR基因突变导致TTR蛋白错误折叠形成淀粉样原纤维累积在神经和心脏等组织,引发致死性的淀粉样多发性神经病或淀粉样变心肌病。TTR蛋白主要在肝脏中产生,因此利用CRISPR-Cas9介导的基因编辑技术,在体内肝组织中直接敲除TTR基因是治疗该疾病的理想选择。Intellia Therapeutics和Regeneron Pharmaceuticals公司联合开发了NTLA-2001体内基因编辑疗法,即利用脂质纳米颗粒(LNP)将基因编辑组件—密码子优化的SpCas9的信使RNA(mRNA)以及特异靶向TTR基因的向导RNA(sgRNA)递送到肝细胞中,通过敲除肝细胞中TTR基因进而降低血清中TTR蛋白的浓度来治疗hATTR淀粉样变性。在该1期临床研究中,6例接受hATTR淀粉样变性患者接受了治疗。两个初始计量组0.1 mg/kg和0.3 mg/kg在第28天血清中TTR蛋白下降幅度分别达52%和87%,目前更高剂量组临床研究正在进行中。上述临床实验结果于2021年8月5日发表在权威学术杂志The New England Journal of Medicine。
Leber先天性黑蒙也称LCA(Leber Congenital Amaurosis),是一组遗传性视网膜退行性疾病,可由至少25个不同基因的突变引起。LCA 是遗传性儿童失明的最常见原因,发病率十万分之三,其中LCA10是最常见的疾病形式,约占所有LCA患者的20%~30%。LCA10 是由位于12号染色体上的 CEP290 基因突变引起的,该突变会导致眼部感光细胞退化。在美国,大约77% LCA10患者的CEP290 基因突变发生在第26内含子c.2991+1655A>G (p.Cys998X)。该突变产生了一个新的剪接体位点,它通过与正常的剪接体位点竞争在CEP290信使RNA(mRNA)中插入一个新的外显子从而产生提前终止的密码子,进而在50%的CEP290转录本中终止蛋白质合成。CEP290 cDNA全长约7.5 kb,超过了AAV的最大包装限制(4.7 kb),不能用AAV载体导入法进行替代治疗。来自Editas Medicine公司的研究人员设计了一个巧妙的方法消除CEP290基因在第26内含子处的突变,在突变位点两侧分别设计一个sgRNA,将编码SaCas9核酸酶的基因和两个sgRNA同时转入AAV5载体中,通过视网膜下注射将基因编辑系统递送到感光细胞中。两个sgRNA分别介导SaCas9切割DNA造成双链断裂,最终将带有突变的区域切割并移除,修复后的CEP290基因不再产生多余的剪切体位点,其mRNA能够正常转录和剪切产生正常的CEP290蛋白从而改善感光细胞功能,为患者带来临床益处。
CRISPR基因编辑技术出现之初,人们就对用该技术进行遗传性疾病的基因治疗抱以厚望。经过2020年的体外基因治疗初步成功,短短一年之后,2021年CRISPR基因编辑技术首次直接用于体内基因治疗,再次证明了该技术在临床应用的可行性。让人们对更多疾病的基因治疗抱有更大信心和希望,因此CRISPR基因编辑技术体内基因治疗第五次被Science杂志评为十大科学进展。
近些年我国在基因编辑领域也做出了一些贡献。我国科学家的研究成果极大地促进了CRISPR在农业中的应用。高彩霞及其合作团队在2014年就开发出通过CRISPR编辑普通小麦的Mlo基因从而获得了耐受白粉病的突变体,最近又对该抗病株性状进行进一步的改良,获得耐受白粉病且不影响其他性状的新型突变体。博雅辑因公司为代表的我国基因编辑临床研究取得一系列进展,包括体外基因编辑造血干细胞治疗β-地中海贫血通过IND审批,开始一期临床实验。然而,我们也应该看到不足之处,目前国内开展的临床实验速度落后于美国,原创性的工作较少。
CRISPR体内基因治疗初步获得成功,但如何将大型Cas9装载到合适的载体,高效且精确运送到靶器官仍旧面临挑战。同时,CRISPR基因编辑的技术的安全性问题也应该受到越来越多的重视。开发新的运送载体、降低脱靶、全面评估安全性将是今后研究的重点方向。接下来该技术伦理问题和监管问题会受到越来越多的关注和重视。作为科研人员,我们对该技术进行全方面开发和改进,并取得一系列突破性研究成果的同时,相关成果也需要及时向公众普及,让广大群众能够理解这些技术的意义以及潜在的风险和价值。不故步自封,也不因噎废食。
解读专家
程涛 | 中国医学科学院北京协和医学院长聘教授
张健萍 | 中国医学科学院血液病医院(中国医学科学院血液学研究所)副研究员
体外胚胎培养为早期发育研究打开新窗户
哺乳动物胚胎发育一直是发育生物学中非常活跃但又困难重重的领域,从胚胎植入(Peri-implantation)、原肠胚形成(Gastrulation)到器官发生(Organogenesis)都是母体子宫内胚胎发育的重大事件。长期以来,科学家们一直将这些事件的发生阶段称为“黑匣子”[26],因为他们通常无法在不破坏胚胎生长的情况下观察到子宫内发生的情况,如果没有办法在母体子宫外培育胚胎,这些发育阶段的细节将依然迷雾尘封。
胚胎体外培育具有两个关键的时间窗口,并分别向着两种不同的技术方向发展,其中一种是胚胎植入前的体外生产。在过去的40年里,胚胎体外生产所衍生的辅助生殖技术(Assisted Reproductive Technology, ART)在国际医学领域取得了巨大的进步[27],而我国的胚胎工程技术也在医疗人工受孕、畜牧种属繁殖、遗传资源保护等方面得到了广泛的推广和使用。另一种则是胚胎植入后的体外培养,这种全胚胎培养(Whole Embryo Culture, WEC)技术的开发不管在国内还是国际上的进展却一直缓慢,很大程度上限制着人们对于哺乳动物妊娠期胚胎发育的研究。在小鼠模型中,以往所提出的胚胎培养方案虽然可以到达器官发生的早期阶段(E9.5),但在此阶段之前,体外胚胎就已经显示发育异常。在2021年3月,以色列科学团队[28]利用一个类似于微型摩天轮的滚瓶培养系统(Roller Culture System)将体外培养小鼠胚胎的时间延长至11.5天,相当于母鼠妊娠期的一半,那时胚胎已经成功发育形成了几乎所有主要器官和四肢。该研究是目前小鼠胚胎在子宫外生长的最长时间,是哺乳动物胚胎体外培养时长上的重要科学突破,它的意义在于研究人员能够在完整的器官发生阶段观察和操纵早期发育,为彻底规避体内研究的局限性提供了可能性。
小鼠胚胎的体外长时间培养系统开辟了研究人类胚胎直至妊娠第五周的可能性,但这也同时伴随着一些伦理方面的社会影响。除了啮齿类动物模型,寻找研究人类胚胎的完美替代品就显得尤为重要。2021年4月,我国科学团队携手美国生物研究所[29]创造了世界首个人猴嵌合体胚胎,这种利用人类扩展多能干细胞(Extended Pluripotent Stem Cells, EPS)嵌合灵长类动物胚胎的模型对于干细胞领域及胚胎发育学领域具有里程碑式的意义。同年3月,美国及澳大利亚科学团队[30,31]首次基于非生殖细胞制造出了完整的人类囊胚(Blastocysts)模型,该研究使我们在了解人类胚胎发育的道路上又迈出了一大步。虽然这种利用人类诱导多能干细胞(Induced Pluripotent Stem Cells, iPS)产生的人造囊胚还算不上是真正意义上的胚胎,但它却提供了一种具有指导意义且伦理争议较小的胚胎替代方案。
如果在未来可以更好地优化哺乳动物胚胎体外培养系统,甚至开发出全孕育功能的人造子宫,并和基于人类多能干细胞的人造胚胎模型有效结合,我们终将会打破人类胚胎早期发育的“黑匣子”,解开早期妊娠中胚胎发育的奥秘,对于基础发育生物学和再生医学都会带来革命性的进步。
解读专家
罗凌飞 | 西南大学教授、发育生物学与再生医学研究中心主任
参考文献:
[1] WHO. WHO coronavirus disease (COVID-19) dashboard. (1999-12-08) /[2022-01-18]. https://covid19.who.int.
[2] Yang H, Rao Z. Structural biology of SARS-CoV-2 and implications for therapeutic development. Nature Reviews Microbiology, 2021, 19(11): 685—700.
[3] Kabinger F, Stiller C, Schmitzová J, et al. Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis. Nature Structural & Molecular Biology, 2021, 28(9): 740—746.
[4] Yang HT, Xie WQ, Xue XY, et al. Design of wide-spectrum inhibitors targeting coronavirus main proteases. PLoS Biology, 2005, 3(10): e324.
[5] Yang HT, Yang MJ, Ding Y, et al. The crystal structures of severe acute respiratory syndrome virus main protease and its complex with an inhibitor. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(23): 13190—13195.
[6] Jin Z, Du X, Xu Y, et al. Structure of mpro from SARS-CoV-2 and discovery of its inhibitors. Nature, 2020, 582(7811): 289—293.
[7] Zhao Y, Fang C, Zhang Q, et al. Crystal structure of SARS-CoV-2 main protease in complex with protease inhibitor PF-07321332. Protein & Cell, 2021: 1—5.
[8] Gao Y, Yan LM, Huang YC, et al. Structure of the RNA-dependent RNA polymerase from COVID-19 virus. Science, 2020, 368(6492): 779—782.
[9] Wang Q, Wu JQ, Wang HF, et al. Structural basis for RNA replication by the SARS-CoV-2 polymerase. Cell, 2020, 182(2): 417—428.e13.
[10] Yin WC, Mao CY, Luan XD, et al. Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir. Science, 2020, 368(6498): 1499—1504.
[11] Yan LM, Yang YX, Li MY, et al. Coupling of N7-methyltransferase and 3'-5' exoribonuclease with SARS-CoV-2 polymerase reveals mechanisms for capping and proofreading. Cell, 2021, 184(13): 3474—3485.e11.
[12] Dai WH, Zhang B, Jiang XM, et al. Structure-based design of antiviral drug candidates targeting the SARS-CoV-2 main protease. Science, 2020, 368(6497): 1331—1335.
[13] Jin Z, Zhao Y, Sun Y, et al. Structural basis for the inhibition of SARS-CoV-2 main protease by antineoplastic drug carmofur. Nature Structural & Molecular Biology, 2020, 27(6): 529—532.
[14] Qiao JX, Li YS, Zeng R, et al. SARS-CoV-2 M pro inhibitors with antiviral activity in a transgenic mouse model. Science, 2021, 371(6536): 1374—1378.
[15] von Stabsarzt BD, Kutasati. Ueber das zustandekommen der diphtherie-immunit?t und der tetanus-immunit?t Bei thieren. Molecular Immunology, 1991, 28(12): 1319—1320.
[16] The Noble Prize. Partial cell functions. [2022-01-02].https://www.nobelprize.org/prizes/medicine/1908/ehrlich/lecture.
[17] Science. 2021 breakthrough of the year.
https://www.science.org/content/article/breakthrough-2021#section_breakthrough.
[18] U.S. Food&Drug Administration. Emergency use authorization. https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization#coviddrugs.
[19] Cao Y, Wang J, Jian F, et al. Omicron escapes the majority of existing SARS-CoV-2 neutralizing antibodies. Nature, 2022, 602(7898): 657—663.
[20] Liu L, Iketani S, Guo Y, et al. Striking antibody evasion manifested by the Omicron variant of SARS-CoV-2. Nature, 2022, 602(7898): 676—681.
[21] Planas D, Saunders N, Maes P, et al. Considerable escape of SARS-CoV-2 Omicron to antibody neutralization. Nature, 2022, 602 (7898): 671—675.
[22] Cao YL, Yisimayi A, Jian FC, et al. BA.2.12.1, BA.4 and BA.5 escape antibodies elicited by Omicron infection. bioRxiv, 2022, doi:10.1101/2022.04.30.489997.
[23] Starr TN, Greaney AJ, Dingens AS, et al. Complete map of SARS-CoV-2 RBD mutations that escape the monoclonal antibody LY-CoV555 and its cocktail with LY-CoV016. Cell Reports Medicine, 2021, 2(4): 100255.
[24] Abi B, Albahri T, Al-Kilani S, et al. Measurement of the positive muon anomalous magnetic moment to 0.46 ppm. Physical Review Letters, 2021, 126(14): 141801.
[25] Borsanyi S, Fodor Z, Guenther JN, et al. Leading hadronic contribution to the muon magnetic moment from lattice QCD. Nature, 2021, 593, 51—55.
[26] Svoboda E. The next frontier for human embryo research. Nature, 2021, 597(7878): S15—S17.
[27] Niederberger C, Pellicer A, Cohen J, et al. Forty years of IVF. Fertility and Sterility, 2018, 110(2): 185—324.e5.
[28] Aguilera-Castrejon A, Oldak B, Shani T, et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature, 2021, 593(7857): 119—124.
[29] Tan T, Wu J, Si CY, et al. Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo. Cell, 2021, 184(8): 2020—2032.e14.
[30] Yu L, Wei Y, Duan J, et al. Blastocyst-like structures generated from human pluripotent stem cells. Nature, 2021, 591 (7851): 620—626.
[31] Liu X, Tan JP, Schr?der J, et al. Modelling human blastocysts by reprogramming fibroblasts into iBlastoids. Nature, 2021, 591(7851): 627—632.
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





