金属电化学腐蚀倾向的判断
文/林玉珍·北京化工大学
金属电化学腐蚀过程是金属和它周围的电解质环境所组成的体系,从一个热力学不稳定状态过渡到热力学稳定状态的过程,其结果是生成各种化合物,同时引起了金属结构的破坏。例如:把铁片浸入盐酸溶液中,立即可见有氢气放出,同时铁会以相同于氢放出的速度而溶解到溶液中,即铁发生了腐蚀。又如把紫铜片放入不含溶解氧的盐酸溶液中时,却见不到有氢气放出,铜片也不发生溶解而腐蚀溶液。但是盐酸中一旦有氧溶解进去后,就能见到紫铜片不断遭受着腐蚀。此时仍然看不到有氢气放出,如图1所示。
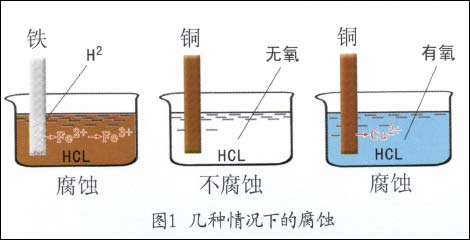
这就要问,为什么不同金属在同一种介质中的腐蚀行为不一样?又为什么同一金属在不同的介质中腐|蚀情况也不相同?那么造成金属电化学腐蚀不同倾向的原因是什么?究竟应如何判断?这些对于讨论腐蚀问题至关重要。为了搞清这些问题,首先必须了解电极、电极反应、电极电位等基本概念,还要进一步了解它们与金属腐蚀倾向之间存在的关系。
电极与电极反应
在腐蚀学科研究中,电极往往是指金属(电子导体相)与电解质溶液(离子导体相)这两种不同类导体组成的体系,亦称为电极系统,以“金属/电解质溶液”表示。它不只是指电子导体材料。如果在电极系统的两相之间伴有电荷的转移,则不可避免地同时会在两相间的界面上发生物质变化一一由一种物质变为另一种物质,即化学变化。
因此,在电极系统中,伴随着两个不同类导体之间的电荷转移在两相界面上发生的化学反应,称为电极反应。例如:
锌电极(Zn/ZnSO4):一个锌棒浸在硫酸锌溶液中组成的电极系统。此时,电子导体是金属锌,离子导体是ZnSO4溶液。当两相之间发生电荷转移时,在两相的界面上,即在与溶液接触的Zn表面上同时会发生如下的物质变化。
式中右下角括号中标注的是该物质所存在的相,e表示电子。由于金属本身参加了反应,故又称金属电极(图2a)。
氢电极(Pt,H2/HC1):一块镀铂黑的铂片浸在H2气体下的HC1溶液中组成的电极系统。此时,电子导体相是Pt,而离子导体相是HC1水溶液。两相界面上有电荷转移时发生的电极反应是:

由于反应中有气体成份,故该电极又可能为气体电极(图2b)。
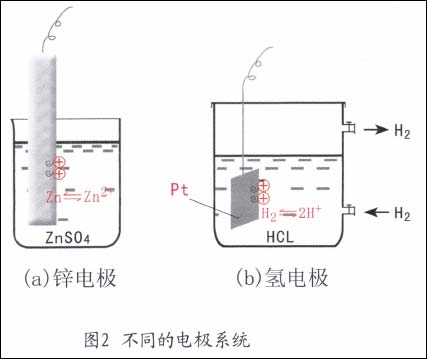
在电极系统中,两相之间电荷转移后就产生了所谓的双电层,双电层的电位差就是金属与电解质溶液之间的电位差,称为该电极的电极电位,用E表示之。
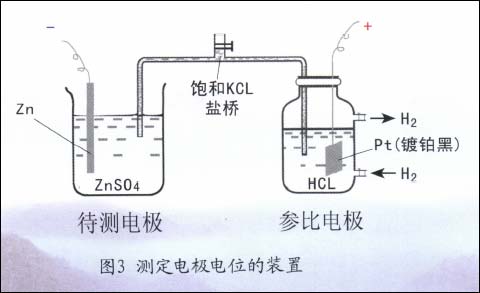
值得注意的是,这种单电极的电位,荷电的一方为金属侧,另一方为溶液侧,故其绝对电极电位值是无法直接测得的。因此,实际测量某金属的电极电位(如Zn电极)时,必须另找一个具有恒定电位值的单电极系统(如氢电极系统)作为基准(参比电极)与之组成原电池(图3),测出原电池的电动势从而获得待测电极(Zn电极)相对于氢电极参比电极的电极电位。今后用E表示的均为相对电极电位。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
-
标签: 腐蚀电化学金属倾向判断

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





