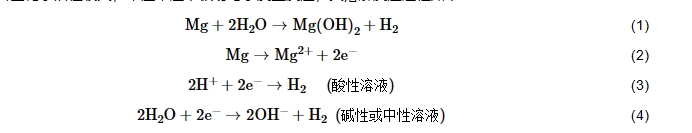摘要
镁合金是最轻的工程结构材料,其溶解特性、腐蚀机理以及防护措施等方面已被广泛研究,而镁合金腐蚀测试方法和技术则是这些研究的重要基础。由于镁合金的溶解过程存在负差数效应,导致其测试技术和分析方法与其他金属存在差异。本文综述了国内外关于镁合金腐蚀测试方法与技术的研究进展,介绍了镁合金测试的通用技术与特色技术,分析了各种测试技术的适用条件和应用案例,重点对比了腐蚀速率测试方法,期望为镁合金腐蚀测试方法与技术的选择提供支撑,避免因不当测试带来的错误分析和结论。
关键词: 镁合金 ; 测试方法 ; 电化学技术
镁合金被称为“21世纪新型绿色材料”,可作为结构材料、电极材料、植入材料和牺牲阳极材料[1, 2],应用前景广阔。由于高化学活性和疏松表面膜,镁合金极易发生溶解,因此镁合金设计过程必须考虑其溶解特性,这时镁合金的腐蚀评价方法和技术成为这些研究的重要基础。
与碳钢、不锈钢相比,镁合金溶解过程存在负差数效应,即镁合金阳极极化时实际的溶解速度“异常”地高于Faraday定律计算值,且析氢速率随着阳极极化电位或电流密度升高而增大的“反常”现象,这将影响镁合金腐蚀测试和分析方法的选择[3, 4],例如,在动电位曲线测试时,镁合金极化曲线的阳极支只代表了流经外电路的电子,而镁合金表面析氢反应消耗掉的电子却未被表征。这些特殊情况极易被研究者忽略,因此十分有必要对镁合金研究方法加以注意和选择,同时避免测试方法对镁合金溶解特性评估的准确性和科学性产生影响。
随着腐蚀测试装置和微区电化学技术的发展,镁合金溶解特性被不同仪器或方法表征,但由于镁合金表面因析氢反应产生的氢气泡附着极易导致仪器测试产生假信号,因此不能将用于碳钢等材料测试的方法简单的移植应用。同时,新的仪器和测试方法也给镁合金溶解过程带来了新的发现,这有利于推进镁合金溶解过程的深入研究。另外,一些简单的测试仪器和测试方法也被开发出来用于镁合金腐蚀性能的测试,这将为镁合金的研究带来方便。
本文系统归纳总结了目前国内外关于镁合金腐蚀测试方法和技术的研究进展,详细分析了新技术新方法在镁合金腐蚀测试技术中的应用案例及存在问题,期望为镁合金腐蚀性能研究和测试技术发展提供指导。
1 测试方法分类
镁合金化学活性较大,常温常压下极易与水发生反应,其溶解反应过程如下:
其中,阳极反应(2)实现了电极与溶液界面的电子转移,Mg原子氧化形成Mg2+,并伴随着电子释放;阴极反应(3或4)以析氢反应为主,这是由于纯Mg的腐蚀对氧气并不敏感。
基于镁合金的溶解反应过程,将其溶解测试技术分为本征测试技术和非本征测试技术。其中,本征测试技术是指检测镁合金溶解过程前后物质的变化,包括质量变化、溶液中物质变化、以及所产生的气体。非本征测试技术是指检测镁合金溶解阴阳极过程中涉及电子的转移,也称电化学技术。表征金属整体的电化学性质的技术,称为宏观电化学技术;当表征涉及金属表面若干小的阳极区和阴极区的技术,称为微区电化学技术。
2 本征测试技术
2.1 失重测试
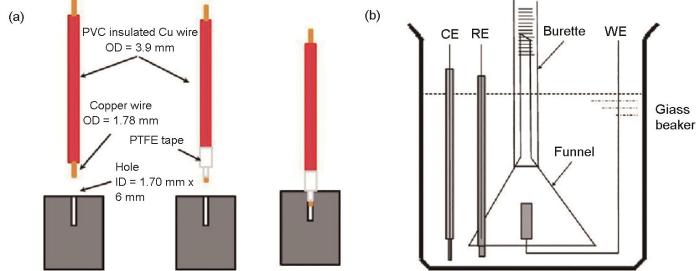
失重测试是金属腐蚀速率最简单、常用的方法,通过测试固定实验时间内样品腐蚀测试前后质量变化,可以提供腐蚀表面形貌分析,但只能提供暴露期间的平均腐蚀速率,且这个速率通常会随着时间而变化[5]。镁合金腐蚀产物通常采取硝酸银和铬酸的混合溶液去除,但是可能因为清洗不足或过度清洗导致的腐蚀速率被低估或高估。失重测试所得高纯Mg在浓的NaCl溶液中的本征腐蚀速率为0.3 mm/a[6]。上述方法测试主要用于镁合金自腐蚀的腐蚀速率。为了测试电化学极化镁合金的失重腐蚀速率,避免封装材料和连接线去除等问题的困扰,Shi和Atrens[7]设计了未封装的Mg电化学试样。如图1a所示,首先在立方体Mg样品的侧面钻取一个内径为1.70 mm的孔,然后将外径为1.78 mm部分包裹聚四氟胶带的裸铜线压入Mg样品侧面的孔内,制备坚固机械接触和良好电连接的电化学Mg试样。聚四氟胶带可以确保Mg样品和铜导线之间没有裂缝,从而电解液无法接触到铜导线。测试装置如图1b所示,测试后Mg样品可以从铜导线上取下,而不会对Mg带来任何损失或增重。去除Mg腐蚀产物后,精确测量Mg试样的质量损失。该方法已经被用于镁合金负差数效应的理论研究之中,但样品的8个角和12条棱边都暴露在溶液中,它们的行为显然不同于平面,而且底面、侧面、顶面的暴露条件也略有不同,这些都会对腐蚀结果造成影响,结果分析时应加以区别。
图1 极化条件下镁合金样品和电化学测试装置[7]
2.2 析氢测试
析氢现象是镁合金腐蚀过程的重要特征[8]。根据Mg腐蚀的化学反应(1)可知,溶解1 mol的Mg(24.3 g)就会产生1 mol的氢气(22.4 L)。因此,析氢测试可作为Mg腐蚀速率评价的特征方法,可用于开路条件和阴阳极极化条件下确定Mg的瞬时腐蚀速率,研究Mg的腐蚀机理。
析氢测试分为体积法和质量法。体积法是用漏斗覆盖在Mg试样,并插入倒置的酸性滴定管中,随后用洗耳球吸取一定体积的腐蚀溶液填入滴定管中。在测试过程中,腐蚀过程产生的氢气积聚成气泡逃离Mg表面并置换出滴定管中的溶液,最后通过不同时间滴定管中溶液体积的变化来表示氢气析出量,进而求得析氢速率[9]。质量法是基于测量浸入式容器中氢气累积产生的浮力。将Mg试样悬挂在一个倒置的烧杯下面,烧杯完全浸入到测试溶液中,并通过光纤连接到精密天平上。电极表面产生的氢气聚积到倒置烧杯内,通过浮力减少其质量。与天平相连的计算机可以自动记录质量随时间的变化[10]。
从析氢测试过程来看,该方法存在一些缺点:有些氢气泡经常附着在漏斗壁和滴定管上;实验前很少用氢气预饱和电解液,这些都会导致析氢速率被低估。但是,尽管析氢测试有一些局限性,但是装置简单易于监测镁合金的瞬时腐蚀速率[11],因此成为镁合金腐蚀评价的常用方法。
2.3 溶液分析
通过腐蚀产物分析镁合金的腐蚀过程,除了氢气外还包括了溶液中的离子。根据Mg腐蚀的阳极反应过程(2)可知,随着Mg溶解的进行,Mg2+量/浓度的变化可用来评价Mg的腐蚀速率。溶液中Mg2+浓度的测试是基于在腐蚀电解池之后连接的电感耦合等离子体发射光谱仪(ICP-OES)来实现[12]。不管是开路条件还是极化条件下,该方法都可以在腐蚀介质存在的情况下直接测量Mg的溶解速率。值得注意的是,由于Mg的腐蚀产物Mg(OH)2的溶解度较低,大部分的Mg2+可能仍储存在沉淀的腐蚀产物中,因此Mg溶解产生Mg2+的量可能被低估。
另外,根据Mg腐蚀的阴极反应过程(4)可知,随着水解离反应的进行,不断释放OH-导致溶液pH值升高,因此可以根据测量溶液pH值的相对增加量来表征Mg的整体腐蚀速率。化学滴定法可以用来评估Mg溶解的腐蚀速率,通过用适当的溶液滴定,使电解液的pH值在整个实验过程中保持在一个固定值,维持恒定pH值所需滴定液的体积来评价所消耗的电荷量[13]。值得注意的是,Mg2+的水解可能会影响溶液的pH值,从而测量过程中引入误差,尽管这对Mg溶解反应的影响相对较小。此外,随着滴定实验的进行,实时测量受到滴定所需实验时间的限制,影响阴极反应动力学的评价。
3 宏观电化学技术
电化学方法是评估金属腐蚀的重要而快速的手段,用来表征金属与溶液界面反应的动力学信息,探讨腐蚀机理和耐蚀性能。目前对于镁合金腐蚀的研究使用较多的电化学技术包括:极化曲线、电化学阻抗、恒电流/电位极化等[14],其中外推Tafel曲线所得腐蚀速率和电化学阻抗谱所得腐蚀速率也是表征镁合金腐蚀的重要数据。
3.1 极化曲线
极化曲线是以固定速率在固定间隔内扫描电极的电位,获得电极电位与极化电流或极化电流密度之间的关系图谱,表征电极阳极和阴极的动力学信息。假设腐蚀过程是电化学控制的阳极和阴极半反应动力学,就可以从距离腐蚀电位足够远的电位,通过Tafel外推相交于腐蚀电流和腐蚀电位。如图2所示,由于负差数效应的存在,Mg的阳极极化曲线并不表示真实的Mg氧化电流密度,只有将恒电位仪测量的净阳极电流密度和阳极极化过程中析氢测量计算的电流密度相加才能代表真实的Mg氧化电流密度[15, 16]。阴极极化曲线是恒电位仪在阴极动电位极化过程中得到的电流密度。在测量Mg腐蚀速率的Tafel外推法中,一般采用极化曲线阴极分支的Tafel外推法估算腐蚀电流密度Icorr。这种阴极外推法只有在镁合金的点蚀电位大于腐蚀电位时才有意义。
图2 纯镁在饱和Mg(OH)2溶液中的动电位极化曲线[16]
极化曲线测量还可以在腐蚀电位下测定瞬时腐蚀速率[2],但要考虑到若干因素的影响:其一,阴阳极两个半反应都是由电化学极化控制;其二,在阳极和阴极极化曲线中,剧烈的析氢反应和表面腐蚀产物膜都会产生欧姆电位降IR;其三,腐蚀膜影响镁金属暴露区域面积,即使在腐蚀电位附近,反应速率也可能依赖于表面膜的覆盖度。基于这些原因,使用极化曲线的瞬时腐蚀速率测定时应谨慎使用,建议与其他电化学和非电化学技术联合评估,如电化学阻抗谱(EIS)和析氢测试。事实上,对镁合金而言,动态电位极化结果最有用的方面不是腐蚀速率的测定,而是代表阳极和阴极动力学分支的相对变化。这些变化与正确的腐蚀速率测定无关,但对于理解合金化的影响至关重要。
动电位极化提供了重要的动力学信息,是唯一可以揭示导致瞬时腐蚀速率的相对阳极和阴极贡献的方法。然而,这种方法是短期的和破坏性的。因此,虽然动电位极化在理解腐蚀速率的机理上是不可缺少的,但它不能作为长期腐蚀速率的良好方法。
3.2 电化学阻抗谱
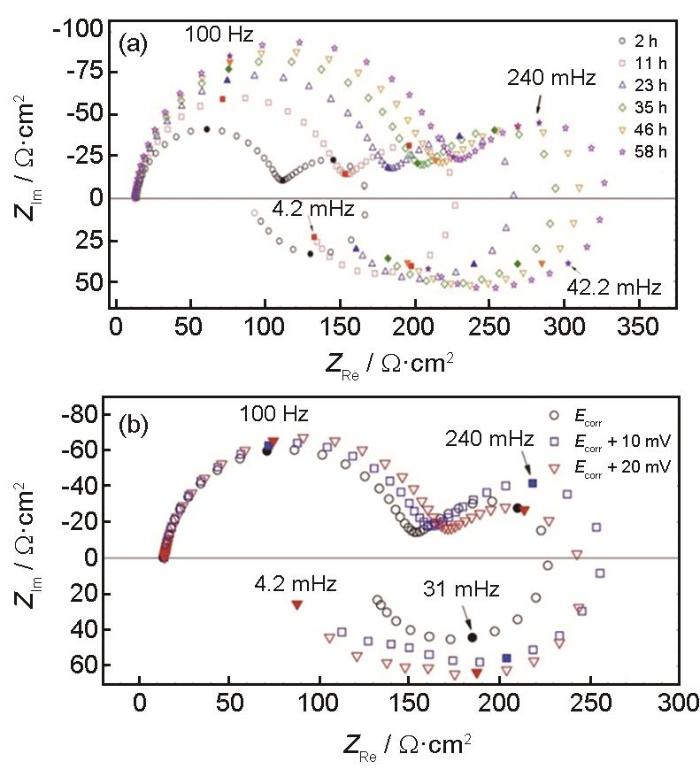
EIS是指在稳定体系中,给电极在不同频率下施加一个小振幅(通常为5~10 mV)正弦电位扰动产生的响应。可见,EIS作为一种无损监检测手段,可以长时间监测金属的腐蚀行为。在实验室应用中,电化学阻抗谱一般以Nyquist图和Bode图呈现,反映腐蚀系统的阻纳频谱特征。在阻抗谱图分析时,经常采用等效电路图来分析,即利用电阻、电容和电感等电子元件的串并联形式。电化学阻抗谱经常被用来分析腐蚀过程中的反应步骤,包括非Faraday步骤和Faraday步骤。如图3所示,一般Mg的电化学阻抗谱包括两个容抗弧和一个感抗弧[17~19]。Song等[17]在开路和阴极极化条件下测试了镁电极在稀NaCl和Na2SO4溶液中的EIS谱。结果分析认为,容抗弧主要由部分保护膜造成的;感抗弧与表面膜破裂处Mg+的浓度有关;阴极极化下,在低频率范围内感抗弧的消失可以解释为镁表面恢复了完整的表面膜的结果。
图3 纯镁在0.1 mol/L Na2SO4溶液中不同时间和不同阳极极化条件下的阻抗图[1]
3.3 恒电流/电位极化
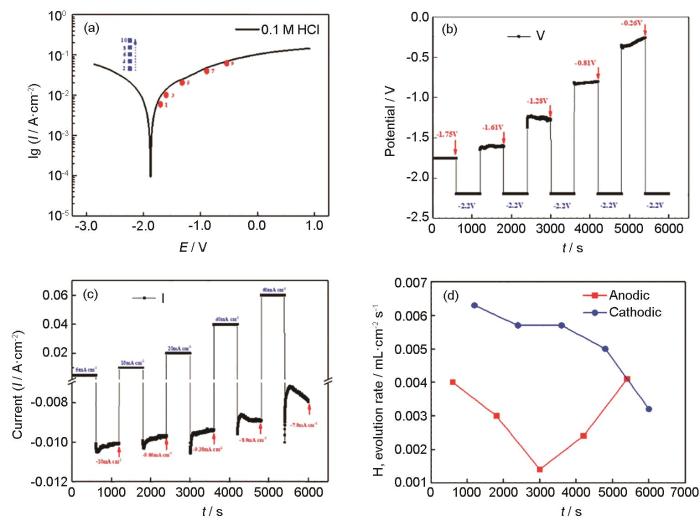
在镁合金阳极析氢或负差数效应的研究中,恒电流/电位极化结合析氢测试时最常用的方法[15,20,21]。恒电流/电位极化是给样品施加一个固定的电流密度/电位,测量腐蚀过程的电位/电流变化。当研究特定过程时,须使用恒电位极化测量,包括在镁表面电沉积不同物种形成保护涂层,以及在阳极极化过程中研究析氢速率,即负差数效应。Birbilis等[20]研究了在0.1 mol/L NaCl溶液中阳极极化后的纯Mg立即被阴极极化,表明与没有阳极极化的纯Mg相比,阳极极化后纯Mg的阴极电流密度显著增加,因此得出阳极极化导致产生的表面黑色腐蚀产物具有催化作用,增强了阴极析氢反应。如图4所示,Huang等[21]研究了在0.1 mol/L的HCl溶液中Mg的交替阴阳极极化析氢行为,可见在恒电流阳极极化过程中测得的阳极析氢速率随外加阳极电流密度的增大先减小后增大。紧接的恒电位阴极极化过程中测得的阴极析氢速率随着外加阳极电流密度的增大而减小。上述结果可见,阳极极化后的Mg表面并没有增强阴极析氢活性,阴极析氢和阴极电流都没有增加。
图4 在0.1 mol/L盐酸溶液中镁样品的极化曲线及在恒电流阳极-恒电位阴极交替极化下的电位、电流密度和析氢速率[21]
在Mg的腐蚀过程中,氢气作为阴极腐蚀产物将会产生并部分附着在Mg的表面,导致实验过程中Mg的有效活化面积发生改变。在恒电位极化条件下,不管氢气泡的存在与否,都会使Mg表面的每个点电位恒定不变。但是,在恒电流极化条件下,有无气泡覆盖的Mg表面区域的电流密度差别很大。
4 腐蚀速率的比较
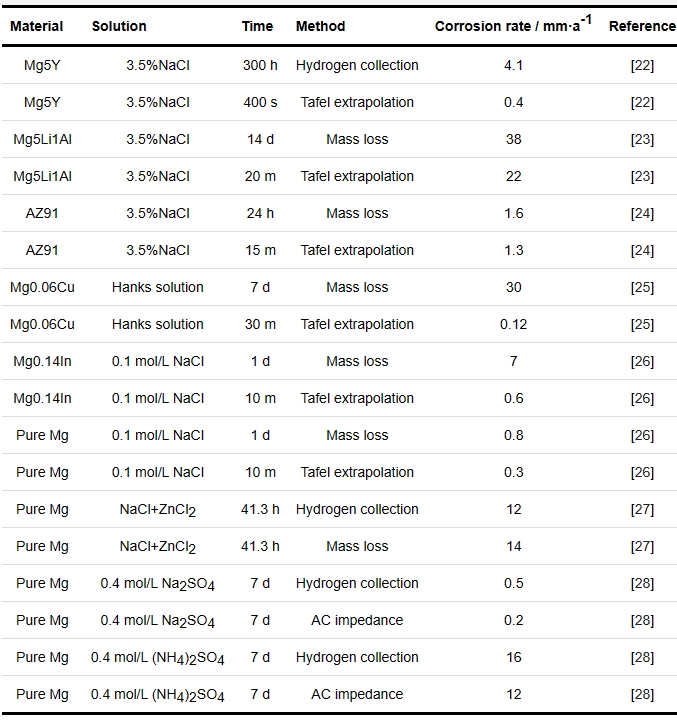
Mg的腐蚀速率是Mg腐蚀研究的一项重要指标。目前主要应用的腐蚀速率测试方式分为失重速率、析氢速率、Tafel外推法估算腐蚀速率和阻抗谱计算Mg的腐蚀速率等[6]。上述溶液法较为复杂、影响较多,并没有广泛采用。
失重腐蚀速率是通过浸泡期间镁合金的失重差来换算得到的,其具体计算公式为:
表1综述了不同研究方法表征的镁合金腐蚀速率。失重腐蚀速率与析氢腐蚀速率相差不大,而采用电化学方法测量的镁合金腐蚀速率通常比失重法测量的速率低(通常相差数量级),其中原因包括了浸泡时间、阴极析氢、非Faraday部分。因此,采用电化学方法测量表征镁合金的腐蚀速率不全面,还应测试失重速率或析氢速率表征镁合金的腐蚀性能。另外,试样浸入溶液后测量的腐蚀速率不能代表稳态腐蚀,初始腐蚀机制不能代表稳态腐蚀情况,应该根据腐蚀环境适当延长镁合金在溶液中的浸泡时间,使镁合金腐蚀稳定发展。
表1 不同镁合金腐蚀速率的比较
5 微区电化学技术
在水环境中的自腐蚀或弱阳极极化时,镁合金表面存在微纳米范围内的局部微电偶腐蚀,分布着阳极区域和阴极区域[29]。宏观电化学技术可以确定在金属表面发生的电极过程动力学,所测量电位和电流是整个电极表面的平均值。但是镁合金与溶液的微区电化学信息无法获得,恰恰这也是镁合金腐蚀过程中最重要的研究部分。因此,宏观电化学方法对于研究局部腐蚀等非均相电化学过程有很大的局限性。Song和Xu[30]利用自制针筒电解池(针尖的内径为1 mm)研究了不同取向的Mg晶粒具有不同的电化学活性和腐蚀行为,表明基面在中性氯化物溶液或碱性Mg(OH)2饱和溶液中棱柱面和其他晶体面更耐腐蚀。
随着电化学测试技术的发展,微区电化学技术使得在金属/溶液界面上获取微空间化学环境信息变得容易。目前,微区电化学技术主要有扫描振动电极技术(SVET)、扫描电化学显微镜技术(SECM)、局部电化学阻抗(LEIS)、扫描Kelvins探针(SKP)、扫描离子选择电极技术(SIET)等[31]。表2为不同微区电化学技术的功能及其优缺点。
表2 微区电化学技术的特性和优缺点[4]
5.1 扫描振动电极技术
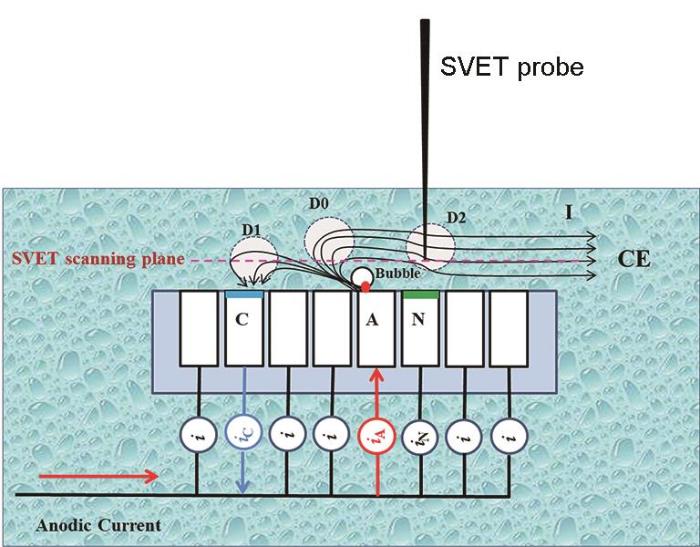
SVET是测量溶液中振动探针与腐蚀金属之间的电位差,可视化展示金属表面局部阴极和阳极反应的一种原位的电化学技术[32]。该技术在镁合金微区电化学研究领域的应用最多,广泛应用于镁合金自腐蚀、负差数效应和电偶腐蚀的研究中。但是SVET用于腐蚀机理的测试还值得商榷。Williams等[33]研究表明在2 mol/L的NaCl溶液中SVET测试纯Mg时Mg表面阴极区面积随着极化时间(0~2 h)和外加阳极电流密度的增加而增加,而Huang等[29]通过SVET测试了镁丝阵列电极研究表明纯Mg随着阳极电流增大,阴极电流逐渐减小直到消失。上述研究表明SVET技术的缺点,通常在电导率较高的溶液中变得不那么灵敏。只有那些高于仪器噪声的信号才能被检测并转换为电流密度。此外,SVET在距离真实Mg表面一定距离处测量的电流密度或电势分布可能在附着在Mg表面的氢气泡处发生扭曲(如图5所示)。
图5 气泡干扰SVET测试示意图[29]
SVET在镁合金电偶腐蚀研究中具有显著的优势,已经在Mg2Si与Al电偶、Mg-Mg2Ca电偶和Mg-MgZn2电偶得到应用[34,35]。Li等[34]利用SVET研究了金属间化合物Mg2Si与Al电偶在不同pH值的0.01 mol/L NaCl溶液中的电偶腐蚀。研究表明,Mg2Si在酸性条件下作为阳极,随着浸泡时间的延长,Mg2Si的阳极活性随着金属Al腐蚀的发生而降低。可见,SVET在镁合金的电偶腐蚀研究中有明显优势,可以直观表征出电偶之间的电流和电位之间的差别,且可以表征出各自之间电流和电位随时间的变化。另外,由于Mg腐蚀总有气泡的产生,对探针尖端的影响较大,因此该方法的适用条件上有所限制。
5.2 扫描电化学显微镜
SECM是一种利用超微探针电极表征浸泡在电解液中金属表面非均匀电化学反应,建立表面形貌和表面反应活性之间的关系的扫描探针技术[36]。通常情况下,SECM需要在电解质溶液中加入氧化还原活性介质,检测探针尖端活性物质电化学反应速率的空间变化。常见于检测镁合金表面膜的作用和变化来表征局部腐蚀,Liu等[37]在利用SECM监测了浸泡在NaCl溶液中的AM60和AMCe1镁合金的电化学过程时研究表明,镁合金的电化学行为受Cl-浓度和表面膜的影响,Cl-浓度增强了镁合金局部腐蚀,导致活性点的快速产生和生长,促进表面膜的破裂和水化。另外,SECM技术可以通过极化超微电极,以固定电位来区分不同电化学活性物质,测量感兴趣物种的氧化或还原所产生的电流,测量反应动力学和检测某些特定物质。Zhang等[38]利用扫描电化学显微镜采用改进的SG/TC模式,通过生成的Mg+与铁氰化钾(K3[Fe(CN)6])反应来检测Mg+的存在。表明Mg在+0.6 V阳极氧化120 s后,[Fe(CN)6]4-在超微碳纤维电极上的氧化电流明显增加,证实了Mg+的存在。
5.3 微区电化学阻抗谱
LEIS利用微型探针在电解液中提供材料局部阻抗谱的技术,当探针靠近金属表面,测量得到溶液中的局部电位差,进而求得局部电流密度。LEIS已经用于镁合金局部腐蚀动力学的研究。Galicia等[39]通过LEIS和EIS研究了Na2SO4溶液中AZ91镁合金的腐蚀行为。研究表明β相和α相的腐蚀机制都是由镁的溶解控制,同时分析了导致测定β相的溶出慢于α相的局部动力学的信息。另外,LEIS适合于绝缘衬底(金属涂层)的腐蚀测试研究,Calado等[40]采用LEIS测定了在0.005 mol/L的NaCl溶液中涂有自愈合涂层的镁合金AZ31表面人工缺陷处的的导纳情况,研究表面自愈合涂层的存在抑制了缺陷处导纳的增加,具有抑制腐蚀的作用。目前来说,该技术不需要在溶液中添加任何氧化还原介质,避免其影响,但是测量速度慢、易出现杂散电感。
5.4 扫描Kelvin探针
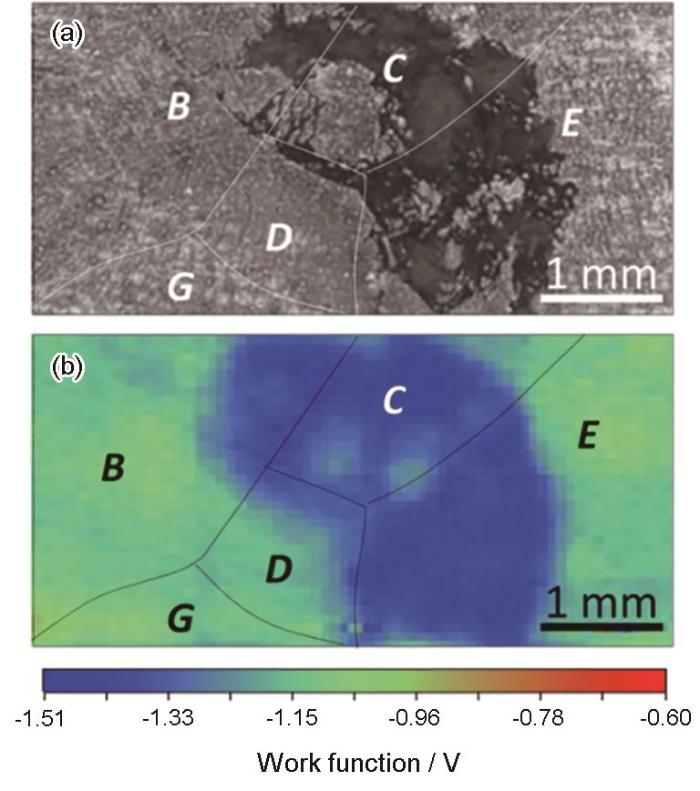
SKP是基于振动电容测试功函数的一种非破坏性、非接触的技术,可以提供金属表面的局部信息。SKP测量可以在真空、露天、潮湿的空气中进行,也可以在表面滴一滴电解液。为了克服分辨率低的问题,开发了扫描Kelvin探针显微镜(SKPFM),其空间分辨率可达约0.1 μm,然而SKPFM测量更容易受到针尖与表面距离、表面形貌和针尖表面污垢/氧化所产生的人为因素的影响。如图6所示,Song和Xu[30]利用SKP技术表征了在0.01 mol/L NaCl溶液中浸泡0.5 h后镁表面腐蚀的位置,但该位置与实际光学图片拍摄的发生腐蚀的并不完全一样,认为表面薄膜的存在降低了SKP测量检测衬底Mg伏特电位差的灵敏度。另外,该技术还用于测试异种金属间的电偶腐蚀情况,Wu等[41]采用SKPFM测试了磁控检测的纯Mg和中间相Mg-28Al之间的电位差,结果显示磁控溅射纯镁表面电势的平均值与Mg-28Al表面电势的平均值之间相差242 mV。
图6 腐蚀后的镁表面光学图和SKP图[32]
5.5 扫描离子选择电极技术
SIET以非侵入性方式实时测量pH值和/或表面电解质特定离子物种的存在,可以用来研究化学和电化学反应机制,量化腐蚀过程动力学和扩散速率。该技术可以用于检测pH值的变化或电极尖端的离子检测。例如,可以根据Cl-分布法提供阴极区和阳极区,因为镁合金腐蚀的阳极区的氯离子浓度总是高于阴极区。Mei等[42]利用SIET技术研究了有无pH缓冲液的模拟体液环境中镁腐蚀行为。表明无pH缓冲液的体系中,由于表面膜的生成,Mg表面局部pH值相对较低;而含有pH缓冲液的体系中,Mg的腐蚀速率更快,导致pH值相对较高,且由于氢气的产生使得pH测量出现了出现波动。Lamaka等[43]通过SIET技术成功应用在含氯化物水溶液中镁合金表面的Mg2+和H+的局部活性扫描,测量了人工缺陷下腐蚀溶解的Mg2+的局部浓度和pH值变化。
6 结语与展望
耐蚀镁合金和可溶镁合金的阳极溶解测试、腐蚀机理探究、防护措施评价需要依托镁合金的测试技术的发展与创新。不同的测试分析方法相互支撑,更好的理解镁合金腐蚀与防护的本质,同时针对镁合金溶解特性,需要合理选择不同测试环境和测试技术,有助于提供真实准确的实验数据,为镁合金腐蚀科学研究提供技术保障。
(1) 镁合金腐蚀速率的测量包括了失重法、析氢法、溶液法、极化曲线法以及阻抗法。失重法测量镁合金腐蚀速率比电化学方法测量的腐蚀速率高,且相差几个数量级。实际测试中失重法较为客观,而不应仅依赖电化学方法测量的腐蚀速率。
(2) 与碳钢、不锈钢等金属材料不同,由于负差数效应的存在,镁合金腐蚀的测试技术与分析方法需要加以甄别,例如电化学测试与失重方法的结合使用,析氢测试、溶液测试等特殊测试技术;微区电化学技术中气泡的影响;极化曲线阳极支和阻抗图谱中动力学分析方法的注意事项等等。
(3) 微区电化学技术提供了局部尺度的电化学信息,更好地明晰镁合金腐蚀机理,但是每种技术都具有各自优缺点,适用于不同测试环境。未来随着测试技术的发展和改进,使得多种测试数据集中测试,实时准确同步反映腐蚀信息。同时,也应进一步发展腐蚀测试标准化工作,使得大家测试数据具有可比性,避免系统性误差。
参考文献
1 Huang J F, Song G L, Atrens A, et al. What activates the Mg surface-A comparison of Mg dissolution mechanisms [J]. J. Mater. Sci. Technol., 2020, 57: 204
doi: 10.1016/j.jmst.2020.03.060
2 Esmaily M, Svensson J E, Fajardo S, et al. Fundamentals and advances in magnesium alloy corrosion [J]. Prog. Mater. Sci., 2017, 89: 92
doi: 10.1016/j.pmatsci.2017.04.011
3 King A D, Birbilis N, Scully J R. Accurate electrochemical measurement of magnesium corrosion rates; A combined impedance, mass-loss and hydrogen collection study [J]. Electrochim. Acta, 2014, 121: 394
doi: 10.1016/j.electacta.2013.12.124
4 Jadhav N, Gelling V J. Review-The use of localized electrochemical techniques for corrosion studies [J]. J. Electrochem. Soc., 2019, 166: C3461
doi: 10.1149/2.0541911jes
5 Wang Z Q, Xu C X, Yang L J, et al. Microstructure and corrosion resistance of medical degradable Mg-2Y-1Zn-x Zr alloy [J]. J. Chin. Soc. Corros. Prot., 2022, 42: 113
5 王中琪, 许春香, 杨丽景 等. 医用可降解Mg-2Y-1Zn-x Zr合金微观组织和耐蚀性能研究[J]. 中国腐蚀与防护学报, 2022, 42: 113
doi: 10.11902/1005.4537.2021.014
6 Atrens A, Shi Z M, Mehreen S U, et al. Review of Mg alloy corrosion rates [J]. J. Magnes. Alloy., 2020, 8: 989
doi: 10.1016/j.jma.2020.08.002
7 Shi Z M, Atrens A. An innovative specimen configuration for the study of Mg corrosion [J]. Corros. Sci., 2011, 53: 226
doi: 10.1016/j.corsci.2010.09.016
8 Huang J F, Song G L. Hydrogen evolution, efficiency and exacerbated galvanic corrosion damage of magnesium alloy anode [J]. J. Mater. Eng., 2021, 49(12): 48
8 黄居峰, 宋光铃. 镁合金阳极的析氢、效率与电偶腐蚀放大效应 [J]. 材料工程, 2021, 49(12): 48
doi: 10.11868/j.issn.1001-4381.2021.000287
9 Song G L, Atrens A, StJohn D. An hydrogen evolution method for the estimation of the corrosion rate of magnesium alloys [A]. Hryn J N. Magnesium Technology [M]. Warrendale: TMS, 2001: 255
10 Fajardo S, Frankel G S. Gravimetric method for hydrogen evolution measurements on dissolving magnesium [J]. J. Electrochem. Soc., 2015, 162: C693
doi: 10.1149/2.0241514jes
11 Lü X, Deng K K, Wang C J, et al. Effect of SiCp size on microstructure and corrosion properties of cast AZ91 Mg-alloys [J]. J. Chin. Soc. Corros. Prot., 2023, 43: 135
11 吕 鑫, 邓坤坤, 王翠菊 等. SiCp尺寸对铸态AZ91镁合金显微组织与腐蚀性能的影响 [J]. 中国腐蚀与防护学报, 2023, 43: 135
12 wiatowska J, Volovitch P, Ogle K. The anodic dissolution of Mg in NaCl and Na2SO4 electrolytes by atomic emission spectroelectrochemistry [J]. Corros. Sci., 2010, 52: 2372
doi: 10.1016/j.corsci.2010.02.038
13 Rybalka K V. Determination of metal corrosion rate using the pH-metry by the method of compensating additives [J]. Russ. J. Electrochem., 2014, 50: 500
doi: 10.1134/S1023193514050085
14 Liu Z Q, He X X, Qi K, et al. Galvanic corrosion behavior for galvanic couple of AZ91D Mg-alloy/2002 Al-alloy in 0.5 mg/L NaCl solution [J]. J. Chin. Soc. Corros. Prot., 2022, 42: 1016
14 刘泽琪, 何潇潇, 祁 康 等. AZ91D镁合金和2002铝合金在0.5 mg/L NaCl溶液中的电偶腐蚀行为研究 [J]. 中国腐蚀与防护学报, 2022, 42: 1016
doi: 10.11902/1005.4537.2021.355
15 Fajardo S, Frankel G S. A kinetic model explaining the enhanced rates of hydrogen evolution on anodically polarized magnesium in aqueous environments [J]. Electrochem. Commun., 2017, 84: 36
doi: 10.1016/j.elecom.2017.10.001
16 Song G L, Unocic K A. The anodic surface film and hydrogen evolution on Mg [J]. Corros. Sci., 2015, 98: 758
doi: 10.1016/j.corsci.2015.05.047
17 Song G, Atrens A, St John D, et al. The anodic dissolution of magnesium in chloride and sulphate solutions [J]. Corros. Sci., 1997, 39: 1981
doi: 10.1016/S0010-938X(97)00090-5
18 Baril G, Galicia G, Deslouis C, et al. An impedance investigation of the mechanism of pure magnesium corrosion in sodium sulfate solutions [J]. J. Electrochem. Soc., 2007, 154: C108
doi: 10.1149/1.2401056
19 Gomes M P, Costa I, Pébère N, et al. On the corrosion mechanism of Mg investigated by electrochemical impedance spectroscopy [J]. Electrochim. Acta, 2019, 306: 61
doi: 10.1016/j.electacta.2019.03.080
20 Birbilis N, King A D, Thomas S, et al. Evidence for enhanced catalytic activity of magnesium arising from anodic dissolution [J]. Electrochim. Acta, 2014, 132: 277
doi: 10.1016/j.electacta.2014.03.133
21 Huang J F, Song G L, Zhu Y X, et al. The anodically polarized Mg surface products and accelerated hydrogen evolution [J]. J. Magnes. Alloy., 2023, 11: 230
doi: 10.1016/j.jma.2021.05.008
22 Liu X B, Shan D Y, Song Y W, et al. Influence of yttrium element on the corrosion behaviors of Mg-Y binary magnesium alloy [J]. J. Magnes. Alloy., 2017, 5: 26
doi: 10.1016/j.jma.2016.12.002
23 Xiang Q, Jiang B, Zhang Y X, et al. Effect of rolling-induced microstructure on corrosion behaviour of an as-extruded Mg-5Li-1Al alloy sheet [J]. Corros. Sci., 2017, 119(5): 14
doi: 10.1016/j.corsci.2017.02.009
24 Turan M E, Sun Y, Aydin F, et al. Effects of carbonaceous reinforcements on microstructure and corrosion properties of magnesium matrix composites [J]. Mater. Chem. Phys., 2018, 218: 182
doi: 10.1016/j.matchemphys.2018.07.050
25 Yan X D, Zhao M C, Yang Y, et al. Improvement of biodegradable and antibacterial properties by solution treatment and micro-arc oxidation (MAO) of a magnesium alloy with a trace of copper [J]. Corros. Sci., 2019, 156: 125
doi: 10.1016/j.corsci.2019.05.015
26 Gore P, Cain T W, Laird J, et al. Enrichment efficiency of noble alloying elements on magnesium and effect on hydrogen evolution [J]. Corros. Sci., 2019, 151: 206
doi: 10.1016/j.corsci.2019.02.026
27 Huang J F, Song G L, Wang Z M, et al. ZnThe2+ destabilized surface film and accelerated corrosion of magnesium [J]. J. Electrochem. Soc., 2020, 167: 161508
doi: 10.1149/1945-7111/abd002
28 Cao F Y, Zhao C, Song G L, et al. The corrosion of pure Mg accelerated by haze pollutant ammonium sulphate [J]. Corros. Sci., 2019, 150: 161
doi: 10.1016/j.corsci.2019.01.042
29 Huang J F, Song G L, Wang Z M, et al. The real current density distribution on Mg surface [J]. J. Electrochem. Soc., 2021, 168: 077505
30 Song G L, Xu Z Q. Crystal orientation and electrochemical corrosion of polycrystalline Mg [J]. Corros. Sci., 2012, 63: 100
doi: 10.1016/j.corsci.2012.05.019
31 Zhang P H, Pang K, Ding K K, et al. Research progress of scanning vibrating electrode technique in field of corrosion [J]. J. Chin. Soc. Corros. Prot., 2017, 37: 315
31 张彭辉, 逄 昆, 丁康康 等. 扫描振动电极技术在腐蚀领域的应用进展 [J]. 中国腐蚀与防护学报, 2017, 37: 315
doi: 10.11902/1005.4537.2016.115
32 Bastos A C, Quevedo M C, Karavai O V, et al. Review—on the application of the scanning vibrating electrode technique (SVET) to corrosion research [J]. J. Electrochem. Soc., 2017, 164: C973
doi: 10.1149/2.0431714jes
33 Williams G, Birbilis N, McMurray H N. The source of hydrogen evolved from a magnesium anode [J]. Electrochem. Commun., 2013, 36: 1
doi: 10.1016/j.elecom.2013.08.023
34 Li L L, Zhang B, Tian B, et al. SVET study of galvanic corrosion of Al/Mg2Si couple in aqueous solutions at different pH [J]. J. Electrochem. Soc., 2017, 164: C240
doi: 10.1149/2.0671706jes
35 Liu Y, Liu X, Zhang Z C, et al. Comparative, real-time in situ monitoring of galvanic corrosion in Mg-Mg2Ca and Mg-MgZn2 couples in Hank’s solution [J]. Corros. Sci., 2019, 161: 108185
doi: 10.1016/j.corsci.2019.108185
36 Hampel M, Schenderlein M, Schary C, et al. Efficient detection of localized corrosion processes on stainless steel by means of scanning electrochemical microscopy (SECM) using a multi-electrode approach [J]. Electrochem. Commun., 2019, 101: 52
doi: 10.1016/j.elecom.2019.02.019
37 Liu W J, Cao F H, Xia Y, et al. Localized corrosion of magnesium alloys in NaCl solutions explored by scanning electrochemical microscopy in feedback mode [J]. Electrochim. Acta, 2014, 132: 377
doi: 10.1016/j.electacta.2014.04.044
38 Zhang Q H, Liu P, Zhu Z J, et al. Electrochemical detection of univalent Mg cation: A possible explanation for the negative difference effect during Mg anodic dissolution [J]. J. Electroanal. Chem., 2021, 880: 114837
doi: 10.1016/j.jelechem.2020.114837
39 Galicia G, Pébère N, Tribollet B, et al. Local and global electrochemical impedances applied to the corrosion behaviour of an AZ91 magnesium alloy [J]. Corros. Sci., 2009, 51: 1789
doi: 10.1016/j.corsci.2009.05.005
40 Calado L M, Taryba M G, Carmezim M J, et al. Self-healing ceria-modified coating for corrosion protection of AZ31 magnesium alloy [J]. Corros. Sci., 2018, 142: 12
doi: 10.1016/j.corsci.2018.06.013
41 Wu P P, Song G L, Zhu Y X, et al. The corrosion of Al-supersaturated Mg matrix and the galvanic effect of secondary phase nanoparticles [J]. Corros. Sci., 2021, 184: 109410
doi: 10.1016/j.corsci.2021.109410
42 Mei D, Lamaka S V, Feiler C, et al. The effect of small-molecule bio-relevant organic components at low concentration on the corrosion of commercially pure Mg and Mg-0.8Ca alloy: An overall perspective [J]. Corros. Sci., 2019, 153: 258
doi: 10.1016/j.corsci.2019.03.039
43 Lamaka S V, Karavai O V, Bastos A C, et al. Monitoring local spatial distribution of Mg2+, pH and ionic currents [J]. Electrochem. Commun., 2008, 10: 259
doi: 10.1016/j.elecom.2007.12.003
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414