摘要
1,2-丙二醇沸点184.8 ℃、闪点107.2 ℃,能与水和乙醇混溶且安全无毒,是一种绿色环保型溶剂,可能是目前常用硅烷处理液中高乙醇含量导致高安全风险的解决方案之一。本文采用质子核磁共振 (1H NMR) 和MALDI-TOF质谱技术对4种不同水解环境下四甲氧基硅烷的水解缩聚动力学进行了研究,主要考察丙二醇的影响。结果显示,在溶液中水含量较低或中性环境下,丙二醇的加入显著提高硅烷的水解和缩聚速度;当溶液中的水含量较高且酸性环境下,由于硅烷本身的水解和缩聚速度较高,其受丙二醇的影响变得不再明显。
关键词: 四甲氧基硅烷 ; 丙二醇 ; 溶剂 ; 水解 ; 缩聚
工业上对黑色和有色金属制品的防腐蚀主要采用各种表面处理工艺,后续进而涂覆聚合物涂层[1]。之前通常采用铬酸盐钝化或磷化技术进行涂装前的预处理,但由于对环境危害大,这两种技术已被明令禁止[2,3]。因此,迫切需要开发更高效、更环保的金属表面预处理方法。有机硅烷化预处理被认为是有望取代传统工艺的一种绿色高效预处理技术[4]。有机硅烷的通式可以描述为 (RO)3-Si-R1,其中R1为有机官能团,R为甲基或乙基。硅烷在水-醇 (通常采用甲醇或乙醇) 混合物中进行逐步水解,生成硅醇,硅醇进而发生缩聚生成Si-O-Si网络结构[5];在后续成膜过程中,硅醇单元不仅可以与羟基化的金属 (Me-OH) 发生反应生成Si-O-Me共价键[6],还能相互反应形成Si-O-Si网络结构[7-10]。
在有机硅烷处理液的基础上,四甲氧基硅烷 (TMOS) 或四乙氧基硅烷 (TEOS) 常用来制备无机SiO2薄膜。在该处理液中,SiO2的前驱体发生与有机硅烷处理液相似的水解缩聚反应,其醇水溶液也通常采用甲醇或乙醇作为分散剂和水解缩聚抑制剂。但基于自组装技术得到的薄膜厚度十分有限,最高也不过几百纳米,其应用受到了很大限制。近年来胡吉明团队[11-13]进而提出以TMOS或TEOS的醇/水溶液为处理液,通过阴极电沉积技术在结构金属表面制备得到SiO2薄膜,并以此薄膜为碳钢或镀锌钢表面涂装防护体系的预处理层,取得了令人欣喜的结果。
甲醇有一定的毒性,而且甲醇或乙醇的闪点较低,存在一定的安全隐患。虽然,上述醇溶剂在实验室研究中被广泛使用,但上述存在的问题,使得有机硅烷处理液或SiO2 (电) 沉积液在工业的大规模应用和推广面临困难。
基于上述应用上的背景,有必要研究和优化硅烷处理液的醇溶剂类型。另一方面,虽然人们对影响硅烷水解缩聚的相关因素 (如温度[14],硅烷浓度[15,16],溶液pH[17,18]等) 开展了广泛研究,得到了一般性的规律 (如:酸性条件有利于硅烷水解,中、碱性条件更利于硅烷缩聚[19,20]),但还未见甲醇或乙醇之外的其他醇类溶剂对硅烷水解缩聚行为的规律研究。可见,研究醇溶剂对硅烷水解缩聚行为的影响除了具有应用意义外还具有理论价值。
丙二醇沸点184.8 ℃、闪点107.2 ℃,能与水和乙醇混溶且安全无毒,是一种绿色环保型醇溶剂。基于此,本工作尝试选取丙二醇作为硅烷处理液的替代性醇溶剂,以结构简单的TMOS为研究对象,重点比较了在不同pH和不同水量环境下,丙二醇的加入对硅烷水解缩聚速率的影响规律。
1 实验方法
1.1 实验试剂
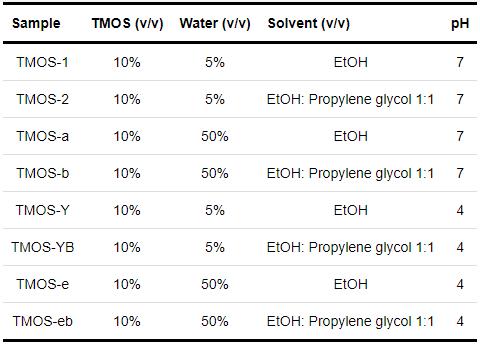
四甲氧基硅烷 (TMOS,98%),以及分析纯的无水乙醇、1,2-丙二醇、丙酮和硝酸等均购自国药集团化学试剂有限公司。氘代乙醇 (99%) 和氧化氘 (99.9%) 均来源于阿拉丁试剂有限公司。溶液中的水除核磁实验外均采用去离子水。所有试剂直接使用,未经进一步纯化。溶液pH用硝酸溶液进行调节,硅烷溶液配制比例参照表1。
表1 硅烷溶液组分
1.2 硅烷溶液的分析方法
采用Agilent DD2-600 光谱仪,核磁氢谱 (1H NMR) 对硅烷溶液进行分析。配制溶液时,用氘水、氘代乙醇代替原有溶剂,比例与表1一致,每次取0.5 mL溶液进行测试。化学位移以四甲基硅烷为内标进行定位标记。TMOS硅烷在水解缩聚过程中产物分子量的分布及变化采用基质辅助激光解析电离飞行时间串联质谱 (ulrafleXtreme,MALDI-TOF) 进行测试,基质为2,5-二羟基苯甲酸 (DHB)。
2 结果与讨论
影响TMOS水解缩聚的原因有很多,其中最主要为含水量和pH。水作为硅烷水解的直接反应物,其含量直接影响着硅烷的水解速率。而pH的高低除了显著影响硅烷水解速率外,还同时决定着硅烷的缩聚速率。例如,碱性条件下TMOS水解液会迅速发生缩聚生成SiO2凝胶。基于此,本文选择中性和酸性两种溶液环境,控制水量变化以研究丙二醇的加入对硅烷的水解缩聚的影响。
2.1 中性溶液中丙二醇对硅烷水解、缩聚行为的影响
考察了pH为7的醇水溶液中丙二醇对硅烷水解缩聚行为的影响规律。为研究方便,选取了两种含水量 (体积分数分别为5%和50%) 的硅烷水解溶液,与后者相比,硅烷在前者溶液中的水解速率明显较慢。
图1是含水量为5%的两种溶液 (TMOS-1和TMOS-2,其中后者的醇溶剂为1∶1的乙醇/丙二醇) 随水解时间变化的核磁谱图。选取了3个具有代表性时间点 (分别为1,48 和120 h) 进行分析。由于丙酮在核磁氢谱中只出现化学位移为2.09 mg/L附近的单峰,且峰面积不随硅烷水解而变化,因此选用丙酮作为内标物。由于溶剂均采用的是D2O和C2D5OD,故所有的活泼氢 (-OH) 均不出峰,只有TMOS的CH3O-Si上的H、生成物 (CH3OD) 的甲基上的H和丙二醇中与C原子直接相连的H可以出峰,分别对应化学位移为3.5 mg/L附近、3.3 mg/L附近和3.7、3.4及1.05 mg/L附近[21]。
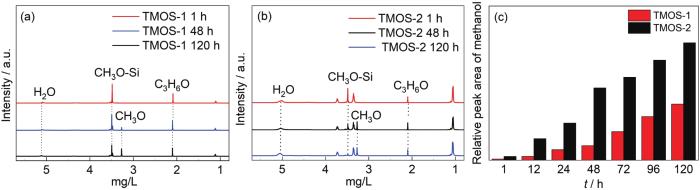
图1 不同水解时间后TMOS-1和TMOS-2溶液的1H NMR及甲醇峰的积分面积 (相对于丙酮内标)
由图1可以看出,在开始阶段 (1 h),硅烷在两种溶液中均未发生明显的水解,只有在3.5 mg/L附近的 (CH3-OSi) 峰。水解48 h后,两种溶液中均观察到明显的甲醇峰 (3.3 mg/L处),表明硅烷的水解已发生,但以乙醇为溶剂的水溶液中 (图1a) 硅烷只发生少量水解;而以乙醇/丙二醇为溶剂的水溶液 (图1b) 中硅烷水解已过半。120 h后,以混合醇为溶剂的溶液中只残留少部分的四甲基硅烷 (图1b),大部分硅烷已经完成水解;而以乙醇为溶剂的溶液中硅烷水解还未过半 (图1a)。由此可以看出,在上述溶液环境下丙二醇的加入,可以显著提高硅烷的水解速率。这一结论可通过丙二醇加入前后甲醇峰的定量积分面积随水解时间的变化规律 (图1c) 看得更清楚。图1c还显示,随着水解时间延长,丙二醇对硅烷水解的促进作用减弱,但至120 h,在以乙醇/丙二醇为醇溶剂的溶液中硅烷的水解速率仍比以纯乙醇为醇溶剂溶液中硅烷的水解速率高一倍。
图2是不同水解时间后含水量为5%的TMOS溶液的Maldi-Tof质谱图。需要说明的是,截至120 h,TMOS-1和TMOS-2仍呈现溶胶状态,并未形成高度聚合的凝胶。在开始阶段 (1 h),由于硅烷在此两种溶液中的水解程度均较小 (见图1),因此两种溶液中硅烷组分均以硅烷单体和二聚体为主。随着水解时间的延长 (48 h),硅烷单体峰强度明显减弱,硅烷主要以低聚体 (二聚、三聚、四聚) 为主,并出现了少量的九聚体;其中在以乙醇为醇溶剂的溶液中硅烷以二聚体和三聚体为主,而在以乙醇/丙二醇为醇溶剂的溶液中占主体的是硅烷的四聚体和九聚体。到了120 h时,硅烷的缩聚程度进一步加大,但在TMOS-1溶液中仍以低聚体为主,在TMOS-2溶液中更大分子量的多聚体 (十聚体以上) 的含量更高。结合图1的核磁数据可以看出,硅烷的水解缩聚过程是同时发生的,虽然TMOS-1的水解程度到120 h为止都没有过半,但是缩聚反应一直在进行。通过上述结果分析可清晰地看出,丙二醇的加入可促进硅烷在中性少水溶液环境中的缩聚。
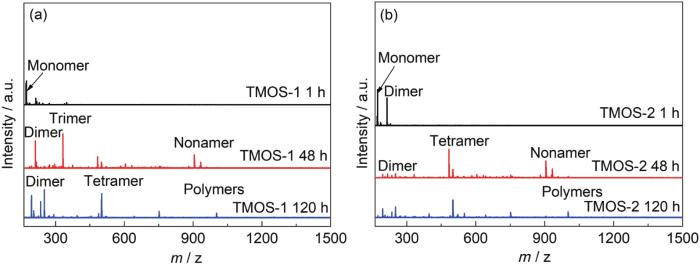
图2 不同水解时间后TMOS-1和TMOS-2溶液的Maldi-Tof质谱图
现保持中性环境不变,将水量从上述的5%增大到50% (即对应表一中的溶液TMOS-a、TMOS-b)。从核磁谱图结果 (图3) 可知,与含水5%的溶液相比,在含水量为50%的溶液中,四甲氧基硅烷的水解速率得到大幅度提升。图3b显示,水解12 h后,TMOS分子中的O-CH3基团几乎消耗殆尽,说明硅烷几乎全部完成了水解 (如反应式1所示),而TMOS-a中的硅烷也仅剩余不到四分之一 (图3a)。比较图3c和图1c的数据则可以清晰地看出,与5%含水量的溶液相比,在同一醇溶剂环境下 (即均为乙醇为溶剂,或均为乙醇/丙二醇为溶剂),水量提升10倍后,硅烷的水解速率也相应提升了约10倍。同时发现,与5%水含量类似,在50%水含量溶液中,丙二醇的加入同样促进硅烷的水解,但与前者相比,促进的程度有所下降,这是由于一方面随着水含量的提升,使得丙二醇的含量降低,另一方面水量的增加大幅度提升了硅烷的水解速率,使丙二醇的促进效果减弱。
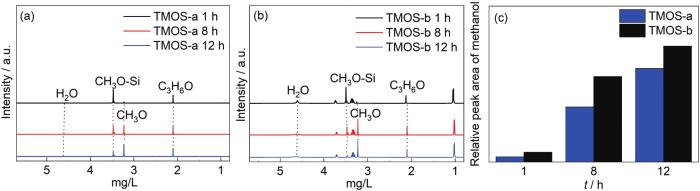
图3 不同水解时间后TMOS-a和TMOS-b溶液的1H NMR和甲醇峰的积分面积
图4是TMOS-a和TMOS-b溶液硅烷经水解1和12 h时的Maldi-Tof质谱图。1 h时,硅烷水解程度很小,以未水解的硅烷单体和二聚体为主;12 h时,TMOS-a中硅烷以三聚体为主,而TMOS-b中硅烷以六聚体为主,缩聚程度更高,说明溶剂中加入丙二醇促进了硅烷的缩聚。24 h时,TMOS-a和TMOS-b均已变成凝胶状态。
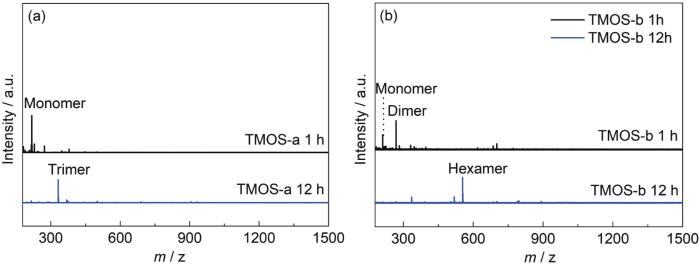
图4 不同水解时间后TMOS-a和TMOS-b溶液的Maldi-Tof质谱图
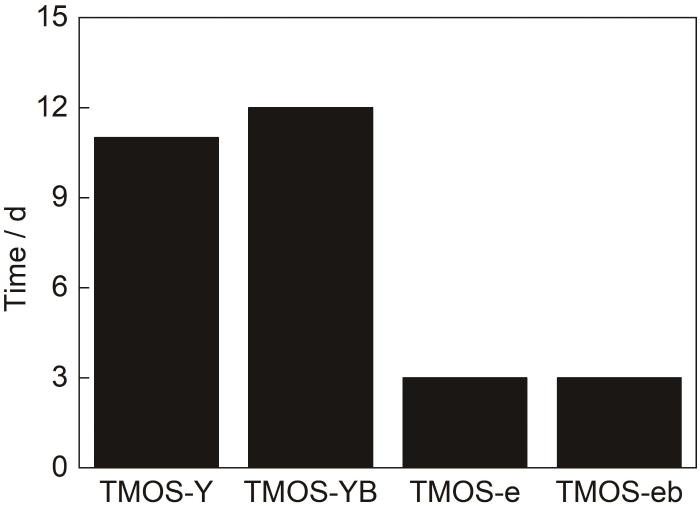
图5展示了中性环境下四组样品形成凝胶所需的时间,结合前面讨论的水解过程,可以看出,在中性环境下,丙二醇的加入在提高了硅烷水解速率的同时也加速了缩聚速率;水量的增加在显著加速硅烷水解速率的同时也使硅烷缩聚速率显著增加。
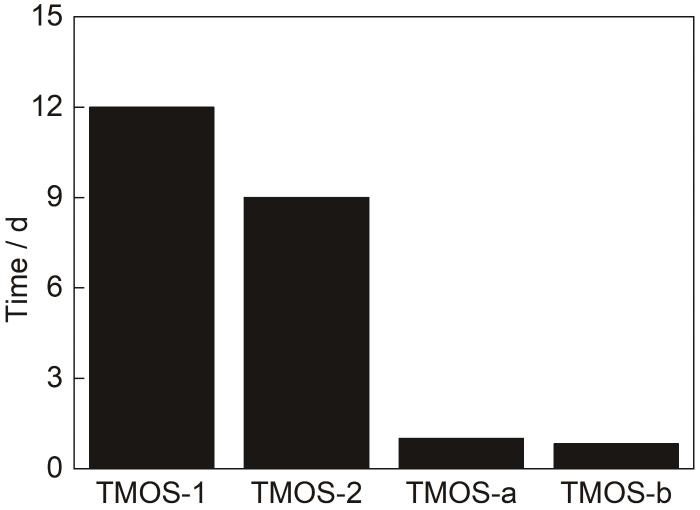
图5 pH为7时样品凝胶化所需时间
2.2 酸性溶液中丙二醇对硅烷水解、缩聚行为的影响
上面的实验结果显示,硅烷在中性且含水量较少环境下水解和缩聚速率是比较缓慢的,在这样的环境下丙二醇的加入显著加速硅烷的水解与缩聚速度,即便如此,在含1∶1乙醇/丙二醇的溶液中硅烷也需要120 h以上才能水解完全。增加含水量,可显著提高硅烷的水解缩聚速度,此时,丙二醇对硅烷水解缩聚速度的促进作用将变弱。基于上述结果,本文进一步通过改变溶液酸度研究丙二醇对硅烷水解缩聚行为的影响。
正如文献报道[19,20]和实验经验,硅烷的水解速率将随溶液pH降低而增大。与3.1节中的TMOS-1和TMOS-2溶液 (pH为7,含水量为5%,图1) 相比,TMOS-Y和TMOS-YB溶液 (pH为4,其余组分分别与TMOS-1及TMOS-2同) 中硅烷的水解速度显著提高。如图6所示,1 h 时,TMOS-Y (以乙醇作为醇溶剂) 溶液中1/4的硅烷已经完成水解 (而相同时间下,TMOS-1溶液中硅烷几乎没有开始水解),而以1∶1的乙醇/丙二醇作为醇溶剂的TMOS-YB溶液中近1/2的硅烷水解为硅醇。到4 h时,TMOS-Y中大约90%的硅烷水解为硅醇,而含丙二醇的TMOS-YB溶液几乎所有硅烷都已变成硅醇。可见,与中性相比 (图1),在酸性条件下硅烷的水解过程变得更为迅速,pH为4的溶液中硅烷的水解速率相比中性环境下提高了几十倍。与在中性环境中类似 (见3.1节),在pH为4、含水量为5%的酸性环境下,与乙醇相比,丙二醇可显著提高硅烷的水解速率。
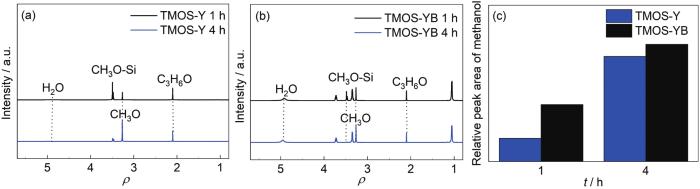
图6 不同水解时间后TMOS-Y和TMOS-YB溶液的1H NMR及甲醇峰的积分面积
图7是上述两种含水量为5%的酸性溶液 (TMOS-Y和TMOS-YB) 的Maldi-Tof质谱图。结果显示,虽然硅烷在此环境中仅用约4 h便基本完成水解,但在前48 h内,硅烷在两种溶液中的缩聚程度均较低,硅烷在溶液中均以低聚体的形式存在。对比可见,酸性条件促进硅烷的水解,但同时抑制硅烷的缩聚。在120 h时,两种溶液中的硅烷以三聚体、四聚体和八聚体为主,且两组样品均呈现溶胶状态,并未形成凝胶。可见,由于在上述酸性少水溶液中硅烷的缩聚反应均慢,丙二醇对硅烷的缩聚行为影响甚小。
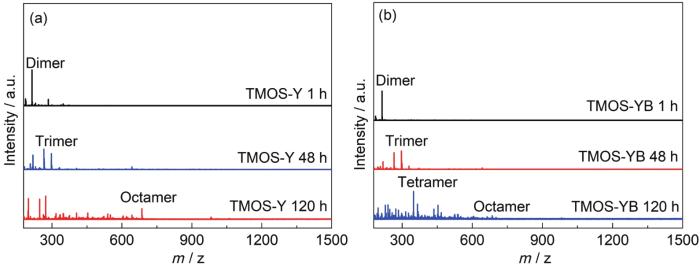
图7 不同水解时间后TMOS-Y和TMOS-YB溶液的Maldi-Tof质谱图
将含水量从5%提高至50%,进一步考察含水量对TMOS-e和TMOS-eb酸性溶液 (pH为4) 水解行为的影响,结果见图8。看出,TMOS在1~1.5 h内即可全部完成水解,由于水量的提高促进硅烷的水解,加之酸性条件下硅烷的水解速率进一步提升,丙二醇对硅烷水解的促进作用没有得到充分体现。
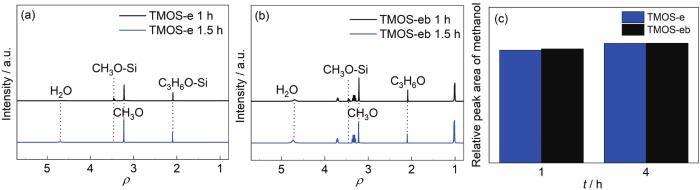
图8 水解1和1.5 h后TMOS-e和TMOS-eb溶液的1H NMR及甲醇峰的积分面积
质谱分析的结果显示,总体上说,即便是在含水量较高的情况下,调低溶液pH也能够抑制硅烷的缩聚,至48 h时,TMOS-e和TMOS-eb两组样品仍呈溶胶状态。对比来看,1 h时TMOS-e中硅烷以三聚体为主,TMOS-eb中硅烷以二聚体和四聚体为主;48 h时,TMOS-e和TMOS-eb中硅烷以三聚体和八聚体为主;72 h时,两组样品均已变成凝胶状态。可见,水量的提升会使硅烷的缩聚速率明显增加,但两组溶液中硅烷的缩聚程度相差不大,丙二醇的影响不明显。
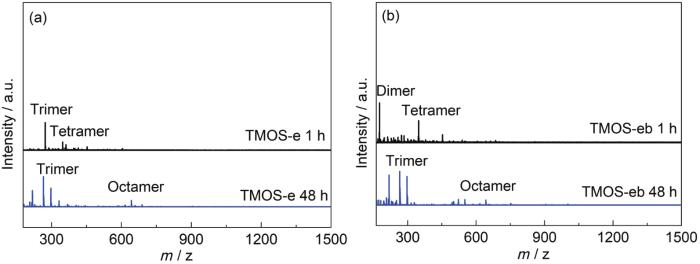
图9 不同水解时间后TMOS-e和TMOS-eb溶液的Maldi-Tof质谱图
图10展示了酸性环境下4组样品变为凝胶状态所需的时间。从图中可以看出,酸性环境下,丙二醇的加入对硅烷缩聚的影响可以忽略。另外,结合中性条件下的数据可以看出,酸性环境促进水解且抑制缩聚,而水量的提高对水解和缩聚的促进是同时的。
图10 pH为4时样品凝胶化所需时间
3 结论
TMOS在中性少水环境 (pH为7,含水量5%) 下的水解速度较为缓慢,丙二醇的加入可显著提高硅烷的水解速度。在此基础上,提高水量 (至50%) 可大幅度提高硅烷的水解速率,丙二醇的加入进一步加快硅烷的水解。总体而言,丙二醇的加入同时促进上述溶液中硅烷的缩聚。
与中性溶液相比,酸性环境可加速硅烷的水解,同时抑制硅烷的缩聚。在酸性 (pH为4)、低含水量 (5%) 的溶液中,丙二醇的加入显著提高硅烷的水解速率。在此溶液基础上进一步提高含水量 (至50%),由于硅烷自身的水解很快,丙二醇对硅烷水解的促进作用变得不太明显。由于在酸性溶液中硅烷的缩聚得到整体性的抑制,丙二醇的存在与否对硅烷的缩聚速度影响不大,即不会显著影响硅烷溶液的长效稳定性。
考虑到实际工业应用时硅烷处理液多数采用酸性环境,丙二醇作为一种硅烷醇溶剂具有替代低沸点、低闪点甲醇或乙醇溶剂的应用前景。
参考文献
1 Twite R L, Bierwagen G P. Review of alternatives to chromate for corrosion protection of aluminum aerospace alloys [J]. Prog. Org. Coat., 1998, 33: 91
doi: 10.1016/S0300-9440(98)00015-0
2 Osborne J H, Blohowiak K Y, Taylor S R, et al. Testing and evaluation of nonchromated coating systems for aerospace applications [J]. Prog. Org. Coat., 2001, 41: 217
doi: 10.1016/S0300-9440(01)00132-1
3 Child T F, van Ooij W J. Application of silane technology to prevent corrosion of metals and improve paint adhesion [J]. Trans. IMF, 1999, 77: 64
doi: 10.1080/00202967.1999.11871249
4 Petrunin M A, Gladkikh N A, Maleeva M A, et al. The use of organosilanes to inhibit metal corrosion. A review [J]. Int. J. Corros. Scale Inhib., 2019, 8: 882
5 Aramaki K. Prevention of iron corrosion at scratched surfaces in NaCl solutions by thin organosiloxane polymer films containing octylthiopropionate [J]. Corros. Sci., 2000, 42: 2023
doi: 10.1016/S0010-938X(00)00037-8
6 Liu L, Hu J M, Zhang J Q, et al. Progress in anti-corrosive treatment of metals by silanization [J]. J. Chin. Soc. Corros. Prot., 2006, 26: 59
6 刘倞, 胡吉明, 张鉴清 等. 金属表面硅烷化防护处理及其研究现状 [J]. 中国腐蚀与防护学报, 2006, 26: 59
7 Beccaria A M, Chiaruttini L. The inhibitive action of metacryloxypropylmethoxysilane (MAOS) on aluminium corrosion in NaCl solutions [J]. Corros. Sci., 1999, 41: 885
doi: 10.1016/S0010-938X(98)00161-9
8 Bexell U, Grehk T M. A corrosion study of hot-dip galvanized steel sheet pre-treated with γ-mercaptopropyltrimethoxysilane [J]. Surf. Coat. Technol., 2007, 201: 4734
doi: 10.1016/j.surfcoat.2006.10.014
9 Cabral A, Duarte R G, Montemor M F, et al. Analytical characterisation and corrosion behaviour of bis-[triethoxysilylpropyl]tetrasulphide pre-treated AA2024-T3 [J]. Corros. Sci., 2005, 47: 869
doi: 10.1016/j.corsci.2004.07.024
10 Zhu D Q, van Ooij W J. Corrosion protection of AA 2024-T3 by bis-[3-(triethoxysilyl) propyl]tetrasulfide in neutral sodium chloride solution. Part 1: corrosion of AA 2024-T3 [J]. Corros. Sci., 2003, 45: 2163
doi: 10.1016/S0010-938X(03)00060-X
11 Wang J, Wu L K, Zhou J H, et al. Construction of a novel painting system using electrodeposited SiO2 film as the pretreatment layer [J]. Corros. Sci., 2013, 68: 57
doi: 10.1016/j.corsci.2012.10.033
12 Liu Y H, Jin X H, Hu J M. Electrodeposited silica films post-treated with organosilane coupling agent as the pretreatment layers of organic coating system [J]. Corros. Sci., 2016, 106: 127
doi: 10.1016/j.corsci.2016.01.032
13 Liu Y H, Xu J B, Zhang J T, et al. Electrodeposited silica film interlayer for active corrosion protection [J]. Corros. Sci., 2017, 120: 61
doi: 10.1016/j.corsci.2017.01.017
14 Zhu D Q, vanOoij, W J. Corrosion protection of metals by water-based silane mixtures of bis-[trimethoxysilylpropyl]amine and vinyltriacetoxysilane [J]. Prog. Org. Coat., 2004, 49: 42
doi: 10.1016/j.porgcoat.2003.08.009
15 Zhu D Q, van Ooij W J. Enhanced corrosion resistance of AA 2024-T3 and hot-dip galvanized steel using a mixture of bis-[triethoxysilylpropyl]tetrasulfide and bis-[trimethoxysilylpropyl]amine [J]. Electrochim. Acta, 2004, 49: 1113
doi: 10.1016/j.electacta.2003.10.023
16 Harada Y, Girolami G S, Nuzzo R G. Growth kinetics and morphology of self-assembled monolayers formed by contact printing 7-octenyltrichlorosilane and octadecyltrichlorosilane on Si(100) wafers [J]. Langmuir, 2004, 20: 10878
17 Yuan W, van Ooij W J. Characterization of organofunctional silane films on zinc substrates [J]. J. Colloid Interface Sci., 1997, 185: 197
doi: 10.1006/jcis.1996.4604
18 Subramanian V, van Ooij W J. Silane based metal pretreatments as alternatives to chromating: shortlisted [J]. Surf. Eng., 1999, 15: 168
doi: 10.1179/026708499101516407
19 Wang Y M, Puomi P, van Ooij W J. Effect of substrate cleaning solution pH on the corrosion performance of silane-coated cold-rolled steel [J]. J. Adhes. Sci. Technol., 2007, 21: 935
doi: 10.1163/156856107781393901
20 Yang L X, Feng J, Zhang W G, et al. Experimental and computational study on hydrolysis and condensation kinetics of γ-glycidoxypropyltrimethoxysilane (γ-GPS) [J]. Appl. Surf. Sci., 2010, 257: 990
doi: 10.1016/j.apsusc.2010.07.102
21 Yang Y Q, Liu L, Hu J M, et al. Improved barrier performance of metal alkoxide-modified methyltrimethoxysilane films [J]. Thin Solid Films, 2012, 520: 2052
doi: 10.1016/j.tsf.2011.10.041
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414