摘要
采用电化学阻抗 (EIS)、石英晶体微天平 (QCM) 和铜箔电阻探针 (TER) 等多种大气腐蚀测量技术,以表面沉积不同比例 (NH4)2SO4和NaCl混合盐粒下的电路板铜箔为样本,在气候试验箱中模拟研究了电路板铜在模拟污染大气环境下的初期大气腐蚀行为。结果表明:在30 ℃ RH90%环境中且表面沉积量相同时,在腐蚀初期 (<30 h),(NH4)2SO4和NaCl混合盐粒对铜的腐蚀性比沉积单一NaCl盐粒的体系更强;但30 h后,情况发生反转,混合盐粒对铜的腐蚀相比单一NaCl盐粒体系反而显著降低,且当混合比例为1∶1时,(NH4)2SO4对NaCl腐蚀的抑制作用最强 (抑制比达84%)。通过腐蚀产物的SEM、XRD、XPS分析可知,在腐蚀前期,由于NH4+对Cu的腐蚀促进作用使铜表面快速形成了较为致密的Cu2O腐蚀产物,从而显著减缓了铜基底腐蚀。尽管沉积NaCl盐粒的铜表面也生成了Cu2O腐蚀产物,但相对比较疏松多孔,反而会因为腐蚀产物的阴极促进作用加速腐蚀产物层下的Cu腐蚀。
关键词: 大气腐蚀 ; 电路板铜 ; 污染物 ; 腐蚀监测 ; 电阻探针 ; 石英晶体微天平
随着电子设备日趋微型化,电路板 (PCB) 元器件尺寸也逐步降低,而PCB不仅承载着复杂的电学、力学和热载荷,而且还受温湿交替、污染气体 (如CO2、SO2、H2S、NO x 、O3) 以及固体颗粒 (如NaCl、PM2.5、PM10) 的影响[1-3]。一旦设备封装层受损,腐蚀性气体渗入,极易在PCB过孔、焊盘、以及污染物 (如助焊剂、盐粒、尘埃) 残留处形成吸附薄液膜[4-7],造成焊盘或者接插件腐蚀[8,9],甚至在阻焊层发生爬行腐蚀[10]。此外,电路板通电时,强的电场梯度还会影响薄液膜下离子扩散、电迁移等传质过程[11-13],促进电解腐蚀和枝晶生长,极易导致PCB短路[14,15]。工业大气是一种典型的大气腐蚀环境[16,17],在城市和工业地区,由于存在较多的硫酸盐和铵盐,所以 (NH4)2SO4颗粒是工业大气环境中主要的大气污染颗粒物,而对于沿海地区的海洋环境,大气污染颗粒物主要是由NaCl为主的海盐粒子组成[18-22]。滨海工业区的大气环境是海洋环境和工业大气环境的结合,对金属腐蚀效应尤为显著[23-25]。目前,对不同大气环境下NaCl沉积导致的铜大气腐蚀做过较多的研究[26-28],也有研究探讨过单独 (NH4)2SO4沉积对Cu大气腐蚀的影响[29,30],但对海洋工业大气环境中的NaCl和 (NH4)2SO4混合沉积的影响,尤其是二者之间是否存在协同作用以及相应的腐蚀机制还少见报道。
本文采用电化学阻抗谱 (EIS)、石英晶体微天平 (QCM)、铜薄膜电阻探针 (TER) 三种大气腐蚀研究方法,在高低温试验箱中对沉积不同比例 (NH4)2SO4和NaCl盐粒PCB板上铜导线的初期大气腐蚀行为进行了原位监测,探索了不同比例的盐粒对Cu初期大气腐蚀的影响规律,同时分析了腐蚀试样的表面形貌和化学组分,以期深入认识污染大气环境下电路板铜的大气腐蚀机理,这对电子设备在海洋大气环境中腐蚀在线监测、失效风险预报与防护技术优化有一定的指导意义。
1 实验方法
失重实验用材料为纯度99.9%紫铜板,然后将其加工为直径为10 mm,厚度为1 mm的圆形试片,除油干燥后用环氧树脂封装成型。待环氧树脂固化后,依次用800#、1000#、2000#的SiC砂纸打磨至光亮,然后用丙酮、无水乙醇、去离子水分别超声5 min进行清洗,最后用冷风吹干,放于干燥器中备用。腐蚀监测传感器采用印刷梳齿电极,通过线路板蚀刻技术在环氧树脂板上形成35 μm厚的铜箔带,电极制作过程参见我们以前的工作[32]。
加速腐蚀实验所用的 (NH4)2SO4先采用乙醇和水比为7∶3的溶液溶解,(NH4)2SO4浓度为0.03 mol/L,而NaCl则采用乙醇和水比为9∶1的乙醇水溶液溶解,浓度为0.06 mol/L。在红外灯下,在保证2种盐粒质量之和不变的情况下,将NaCl (40 g/cm2),(NH4)2SO4 (40 g/cm2) 以及不同比例的NaCl和 (NH4)2SO4混合盐溶液 (30 g/cm2 NaCl+10 g/cm2 (NH4)2SO4、20 g/cm2 NaCl+20 g/cm2 (NH4)2SO4、10 g/cm2 NaCl+30 g/cm2 (NH4)2SO4),即比例分别为3∶1、1∶1和1∶3混合盐的乙醇水溶液作为腐蚀介质,分别均匀喷洒在铜片、铜梳齿电极、镀铜石英晶片以及铜箔电阻片上,然后将样品在红外灯干燥10 min后置于干燥器中备用。
使用文献[31]介绍的电化学双梳齿平面电极,通过CS350电化学工作站测量电极间的电化学阻抗谱 (EIS)。实验前,将梳齿电极用2000#的SiC砂纸轻轻打磨以除去表面的氧化产物,然后依次使用丙酮、无水乙醇、去离子水超声5 min进行清洗,最后用冷风吹干,放于干燥器中备用。将沉积了不同比例盐粒的铜梳齿电极放入可程式恒温恒湿箱中,设置温度为30 ℃,RH为80%和90%,进行定时连续EIS监测,其交流幅值为10 mV,扫描频率范围为105~10-2 Hz。
本研究采用QCM200进行频率测量,选用基频为5 MHz的A-Cut石英晶片,使用前依次用无水乙醇和去离子水超声清洗,采用酸性电镀在晶片表面电镀一层500 nm厚光亮Cu,然后在石英晶片上分别沉积不同比例的盐粒,在30 ℃,RH80%和30 ℃,RH90%的条件下测试铜的增重曲线。
采用薄膜电阻探针技术,无需将探头浸没在溶液中,可直接于空气中测量金属的真实大气腐蚀速率。薄膜电阻探针 (TER) 采用标准电路板工艺印制,在环氧树脂板上镀上一层35 m厚铜箔用作腐蚀感受器。TER传感器制作及测量原理见文献[32]。通过测量腐蚀过程中铜箔厚度减薄引起导体电阻增量来计算腐蚀损耗和腐蚀速率。
大气腐蚀实验前,将TER表面的铜箔用2000# SiC砂纸轻轻打磨以除去表面的氧化物,然后依次使用丙酮、无水乙醇、去离子水超声5 min进行清洗,最后用冷风吹干,放于干燥器中备用。实验前在铜箔表面沉积不同比例盐粒,然后置于可程式恒温恒湿气候试验箱中,在30 ℃,RH80%和30 ℃,RH90%条件下分别进行加速腐蚀测试。
采用Quanta 200型ESEM对试片腐蚀产物进行观测,并采用Empyrean型XRD和AXIS-ULTRA DLD-600W型X射线光电子能谱 (XPS) 对腐蚀产物化学成分进行表征。表面分析前用去离子水对腐蚀样品进行充分清洗。
2 结果与讨论
2.1 盐粒比例的影响
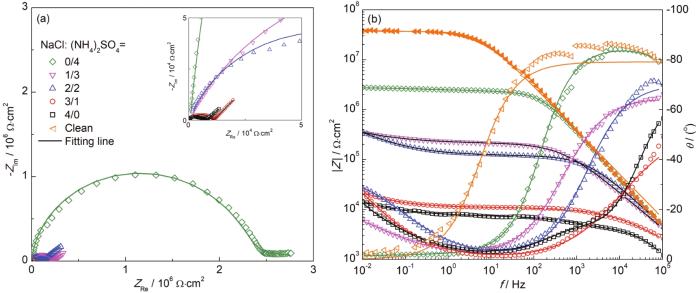
图1为双梳齿铜电极在30 ℃下RH80%气候试验箱中沉积不同比例盐粒72 h后的EIS图。由图可知,当梳齿电极表面仅有40 g/cm2 NaCl覆盖时,其容抗弧最小,低频阻抗模值|Z|0.01 Hz也最小,说明单纯NaCl盐粒所引起的腐蚀最为严重。随着 (NH4)2SO4盐粒的混入,容抗弧逐渐增大,低频阻抗|Z|0.01 Hz也逐渐增大,表明在相同沉积量下,(NH4)2SO4盐粒比例的增加减缓了Cu的大气腐蚀。当 (NH4)2SO4和NaCl沉积量相等时,|Z|0.01 Hz增大了一个数量级,而当电极表面仅有 (NH4)2SO4盐粒时,其|Z|0.01 Hz相比同沉积量下的NaCl覆盖时增大了两个数量级,这表明 (NH4)2SO4对NaCl引起的Cu大气腐蚀有一定的抑制作用。但相比清洁电极,(NH4)2SO4对Cu的初期大气腐蚀仍有促进作用。
图1 沉积不同比例混合盐粒的Cu梳齿电极在30 ℃下RH80%气候箱中暴露72 h后的EIS曲线
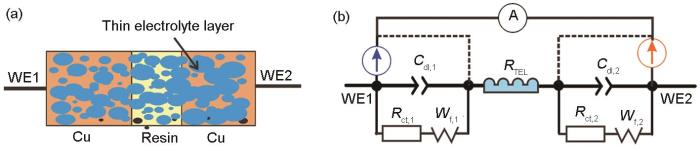
梳齿双电极探头属于对称同材质电极,其等效电路如图2所示。假定两电极 (WE1,WE2) 阻抗特性相同,因此单边Cu箔电极的阻抗应该是总阻抗值的一半。
图2 对称铜梳齿电极在盐粒下的吸附薄液膜模型及相应的等效电路图
当沉积盐粒中NaCl的量大于 (NH4)2SO4时,由于NaCl在铜电极表面的临界潮解湿度 (RH76%) 较低,容易形成较厚的薄液膜 (TEL),此时Cu的电化学溶解速度较快,而氧扩散速度成为了瓶颈,因而在低频区出现代表氧扩散控制的Warburg阻抗,薄液膜形成示意图见图2a。当试样表面TEL因为NaCl沉降量下降而减薄时,Warburg阻抗相比Rct逐步消失。图1中的EIS可采用图2b中的等效电路拟合,相应的拟合结果见表1。其中所有拟合结果均按对称电极等效电路进行修正,考虑到电容和电阻的串联特征,单边Cu电极的双电层电容Cdl=2Ct,电荷转移电阻Rct=Rt/2,扩散阻抗Wd=WT/2。其中Ct,Rt和Wd分别为梳齿双电极的总双电层电容、总电荷传递电阻和总Warburg扩散阻抗。
表1 沉积不同比例盐粒的梳齿铜电极在30 ℃,RH80%下暴露72 h后的EIS拟合结果
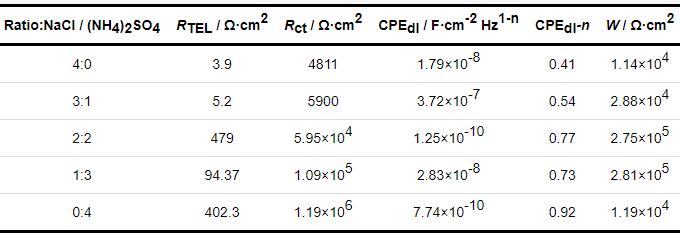
由表1可以看出,随着盐粒中NaCl比例下降,液膜电阻RTEL快速增加,表明TEL正在变薄,电极的Rct随 (NH4)2SO4比例增加而增加,说明 (NH4)2SO4盐粒的加入,使电化学腐蚀受到了一定的抑制效果。
2.2 相对湿度的影响
图3显示了在30 ℃、不同湿度气候试验箱中,表面沉积40 g/cm2 (NH4)2SO4或NaCl盐粒的Cu梳齿电极在2 h后的Bode图。
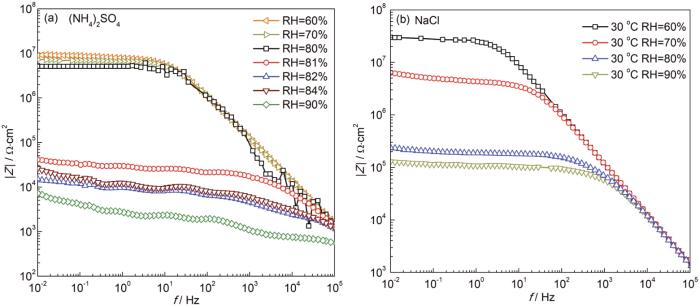
图3 沉积40 g/cm2 (NH4)2SO4或NaCl盐粒的铜梳齿电极在30 ℃,不同RH条件下暴露2 h后的Bode图
由图3a可以看出,当RH较低时,Cu电极阻抗较大,而当沉积 (NH4)2SO4盐粒的铜电极RH为81%时相比80%低频处对应的阻抗值下降了两个数量级,腐蚀速率急剧增大,这表明 (NH4)2SO4盐粒的临界RH可能是81%[18]。在RH为80%时,由于未达到 (NH4)2SO4的临界RH,梳齿电极表面仅存在岛状分布的微液滴,而不能形成连续薄液膜,从而导致在双电极间无法形成导电通路,如图2a。图3b表明沉积氯化钠盐粒的铜电极RH为80%时相比70%低频处对应的阻抗值下降了两个数量级,腐蚀速率急剧增大,电极表面形成连续薄液膜,促进了铜的大气腐蚀。所以在RH为80%的条件下,相同沉积量下,(NH4)2SO4盐粒的存在会减缓NaCl引起的Cu腐蚀,可能的原因之一就是 (NH4)2SO4的加入抑制了低湿度下NaCl的潮解。
为了验证高湿条件下 (NH4)2SO4是否对铜梳齿电极的大气腐蚀依然存在抑制作用,比较了高湿条件下沉积不同盐粒的铜梳齿电极的EIS。图4为铜梳齿电极在30 ℃,RH90%条件下暴露3 d后表面的EIS变化,相应的阻抗拟合结果见表2。可见在高湿 (RH90%) 条件下,即当空气的RH大于 (NH4)2SO4和NaCl盐粒的临界RH时,相比80%RH下的EIS (见图1),沉积相同比例混合盐粒的铜梳齿电极低频阻抗|Z|都下降了一个数量级,说明在高湿度条件下梳齿电极的大气腐蚀速率显著增大,这是由于当RH为90%时两种盐粒都会发生潮解,从而更易形成连续薄液膜,造成腐蚀加速。但与RH80%时的结果一样,在相同盐粒沉积量下,在NaCl中加入 (NH4)2SO4会导致低频阻抗模值|Z|增加,即 (NH4)2SO4抑制了NaCl盐粒对Cu大气腐蚀的促进作用。当RH<80%时,因为没有达到 (NH4)2SO4盐粒的临界潮解点 (81% RH),(NH4)2SO4加入反而使Cu电极表面无法形成连续薄液膜,从而抑制Cu的大气腐蚀。然而在90%RH高湿条件下,NaCl和 (NH4)2SO4混合盐粒能快速吸潮,使铜电极表面形成连续薄液膜,促进大气腐蚀。但和RH=80%时的现象类似,(NH4)2SO4的加入依然一定程度上抑制了Cu的大气腐蚀。
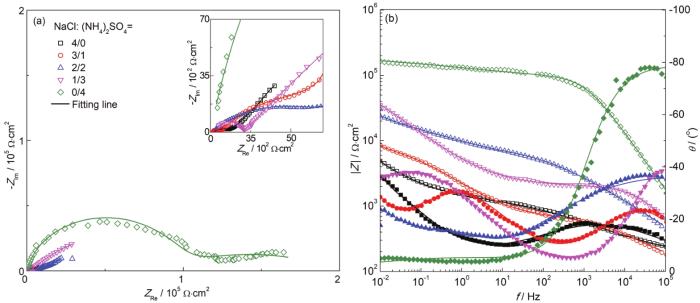
图4 沉积不同比例混合盐粒的铜梳齿电极在30 ℃,RH90%气候箱中暴露72 h后的EIS曲线
表2 30 ℃,RH90%条件下表面沉积不同比例盐粒72 h时铜梳齿电极的EIS拟合结果
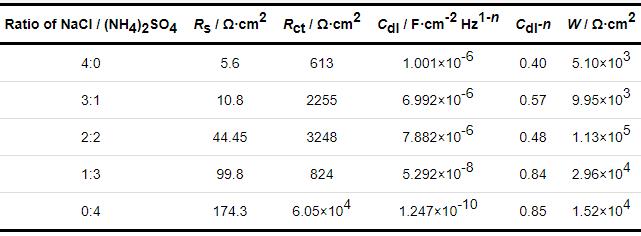
为了解释这一现象,我们在30 ℃,RH90%的条件下,将沉积不同比例盐粒的梳齿电极每隔2 h测量一次EIS,研究其腐蚀演变过程。图5为不同时刻的低频阻抗|Z|0.01 Hz的曲线图。由图可见,24 h前,沉积40 g/cm2 (NH4)2SO4盐粒的梳齿电极的|Z|0.01 Hz值很低,接近于沉积40 g/cm2 NaCl盐粒的体系,说明在24 h之前沉积 (NH4)2SO4盐粒的铜电极腐蚀速率也较大,但24 h后,仅沉积有 (NH4)2SO4盐粒的Cu电极的|Z|0.01 Hz迅速以指数增大,表明 (NH4)2SO4显著抑制NaCl引起的大气腐蚀。下面对相同条件下,沉积不同比例Na2SO4和NaCl盐粒的铜梳齿电极进行EIS测试,结果如图6。可见同样比例下,相比沉积NaCl与 (NH4)2SO4的混合盐粒,沉积Na2SO4和NaCl混合盐粒的铜梳齿电极的|Z|0.01 Hz基本保持在一个数量级上,这说明SO42-并不是产生这种抑制作用主因,很可能是由于NH4+的影响。由于薄液膜中NH4+会发生水解,解离后形成的NH3·H2O分子与Cu+之间存在较强的络合作用,再加上H+导致的薄液膜酸化,二者共同造成Cu2(OH)Cl腐蚀产物层溶解,促进了Cu的初期电化学腐蚀,后期随着Cu(NH3)2+络离子水解而在电极表面形成致密的Cu2O层,使铜基底受到保护。所以在相同沉积量下,(NH4)2SO4的存在会抑制NaCl对Cu的腐蚀。从表2拟合结果可见,随着 (NH4)2SO4盐粒的增加相应地弥散系数变大,说明电极表面电流更均匀,或者说腐蚀产物层变得更致密[33]。
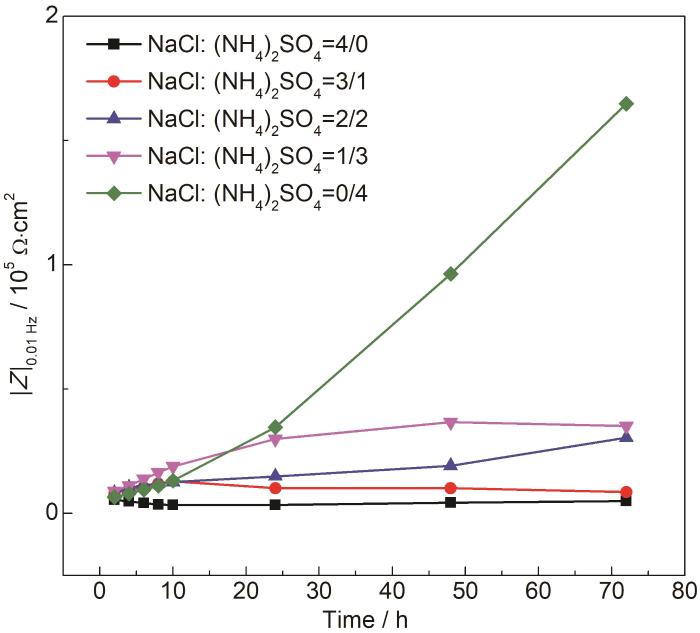
图5 沉积不同比例盐粒下铜梳齿电极在30 ℃,RH90%气候箱中暴露时低频阻抗随时间的变化
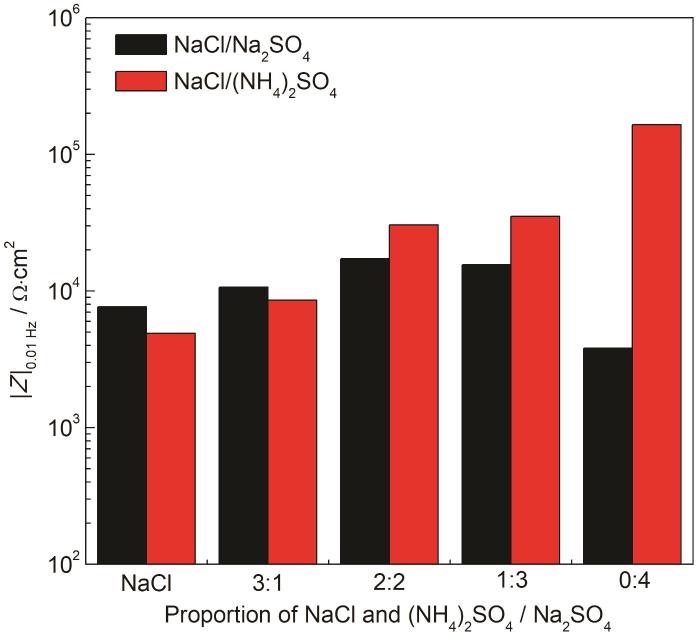
图6 沉积不同比例硫酸钠,硫酸铵和NaCl盐粒的铜梳齿电极在30 ℃,RH90%条件下暴露时的|Z|0.01 Hz对比图
2.3 QCM增重曲线
QCM具有较高的重量感知精度,可以检测到石英晶片表面ng/cm2级的质量变化,被广泛应用于原位腐蚀动力学过程研究[34-37]。本文采用QCM研究了30 ℃,RH90%条件下沉积不同比例盐粒的镀铜晶片的增重曲线 (图7),可以看出,无论是NaCl或 (NH4)2SO4单独沉积时对Cu造成的腐蚀增重最大,且NaCl造成的腐蚀增重远大于 (NH4)2SO4盐粒造成的,说明NaCl盐粒对铜的腐蚀促进作用更强。由图7a可知,沉积 (NH4)2SO4盐粒的镀铜晶片在前期腐蚀速率很大,尤其是单独沉积 (NH4)2SO4盐粒的体系,20 h后腐蚀增重就到了平台区,随后趋于平稳,说明 (NH4)2SO4盐粒的存在会迅速促进Cu的初期腐蚀,但随后Cu面就生成具有保护性的腐蚀产物层,腐蚀速率迅速下降,这与图5中20 h后沉积 (NH4)2SO4盐粒的铜电极低频阻抗突然增加的现象一致。
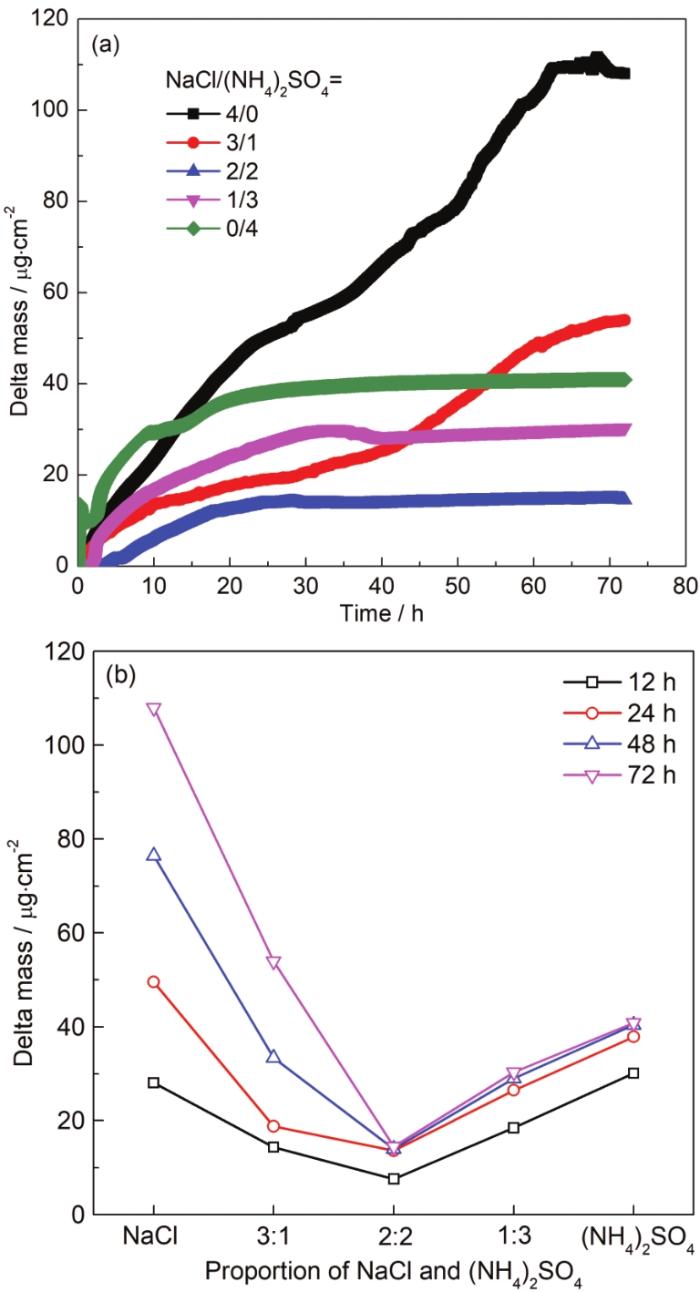
图7 沉积不同比例盐粒的QCM镀铜晶片在30 ℃,RH 90%条件下暴露时的增重曲线
当两种盐粒共同沉积时,如沉积30 g/cm2 (NH4)2SO4和10 g/cm2 NaCl盐粒所造成的腐蚀增重相比单独沉积40 g/cm2 (NH4)2SO4盐粒时增重量减少,而同比沉积20 g/cm2 (NH4)2SO4和20 g/cm2 NaCl的腐蚀增重最小 (图7b),这说明NaCl和 (NH4)2SO4盐粒共存时,相比单独盐粒存在时反而会减缓铜的大气腐蚀,尤其是当这两种盐粒沉积量相同时腐蚀抑制作用最强。即相同沉积量下,腐蚀性由高到低顺序为:NaCl>(NH4)2SO4>(NH4)2SO4+NaCl,分析原因可能有两个因素:(NH4)2SO4盐粒沉积会促进铜表面生成具有保护性的腐蚀产物层,从而减缓腐蚀;其次是混合盐粒占比相近时,会提高其潮解点即临界相对湿度,导致薄液膜不容易形成,因而腐蚀速率下降。图7b表明在相同时间段内,NaCl占比大的混合盐粒对Cu的腐蚀性比 (NH4)2SO4占比大的混合盐粒强,其中当两种盐粒占比相同时其腐蚀性最小,相对于单纯NaCl体系,腐蚀速率下降了84%。
2.4 TER测试分析
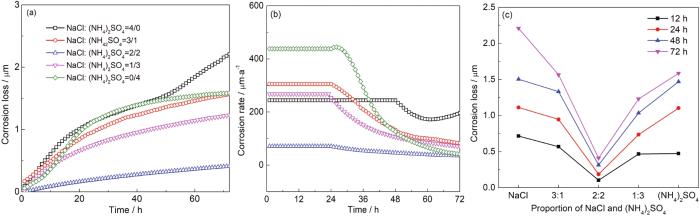
30 ℃,RH90%条件下,沉积不同比例盐粒铜试样的厚度损失和腐蚀速率变化情况,结果如图8所示,由图8a可见,当沉积量相同时,沉积单一盐粒的Cu腐蚀减薄量最大,且NaCl盐粒的腐蚀性大于 (NH4)2SO4盐粒。当两种盐粒共同存在时,Cu腐蚀主要受占比较大的组份影响,比如当沉积30 g/cm2 NaCl和10 g/cm2 (NH4)2SO4时,相当于减少了NaCl的沉积量,即 (NH4)2SO4盐粒的存在抑制了NaCl盐粒的腐蚀,使Cu箔厚度损失量下降;同样3∶1比例下,当NaCl占主导时Cu箔厚度损失大于 (NH4)2SO4占主导时的状态。当两种盐粒比例相同 (2∶2) 时,Cu箔的厚度损失最小,这与QCM测量的腐蚀增重曲线规律基本一致。
图8 在30 ℃和RH90%条件下暴露时Cu箔的厚度损失以及腐蚀速率随时间及盐粒比例的变化曲线
由图8b可见,前24 h单独沉积 (NH4)2SO4盐粒的腐蚀速率最高,这是由于腐蚀初期NH4+水解产生的氨分子与Cu形成配合物促进了其溶解[30]:
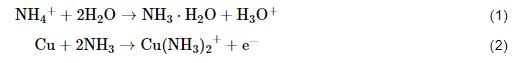
然后 反应生成的Cu(I) 离子与水分子发生反应生成腐蚀产物Cu2O:
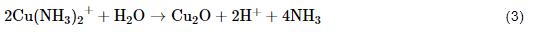
而在24 h后,单独沉积NaCl的铜箔腐蚀速率变得最高,与QCM增重结果一致,这可能是由于 (NH4)2SO4盐粒的存在使铜表面迅速生成具有保护性的腐蚀产物层,从而降低了Cu的腐蚀速率,此外随着NH4+的消耗,(NH4)2SO4对Cu初期大气腐蚀的促进作用也随之下降。
当两种盐粒混合存在时,如沉积30 g/cm2 NaCl和10 g/cm2 (NH4)2SO4时,在30 h前,该混合盐粒对铜的腐蚀比单一40 g/cm2 NaCl盐粒高,说明在腐蚀前期 (NH4)2SO4与NaCl协同促进了Cu腐蚀,而30 h后,情况发生反转,混合盐粒的腐蚀性反而低于单一NaCl盐粒,表明此时 (NH4)2SO4盐粒抑制了NaCl对Cu的腐蚀,这还是由于 (NH4)2SO4存在促使铜表面生成了保护性腐蚀产物膜。图8c为腐蚀深度随不同比例盐粒的变化情况,可以看出两种盐粒的比例对其腐蚀性影响呈“V”型变化,在沉积相同量盐粒时,当两种盐粒比例相等时腐蚀性最低,任何一种盐粒浓度增加都会造成腐蚀性增加,且NaCl增量加大的一侧对Cu的腐蚀性更强,这与QCM (图8b) 结果基本一致。
2.5 腐蚀产物的表征
30 ℃,RH90%条件下,沉积不同比例盐粒的Cu在腐蚀72 h之后腐蚀产物的XRD如图9所示。不同试样在43.4°、50.3°和74.0°均出现了典型单质Cu的峰信号,对应着铜基底,且在29.6°、36.5°、42.4°、61.5°处均存在Cu2O的特征峰,这是由于铜基底上不同比例盐粒的存在促进了Cu的腐蚀,在沉积NaCl或混合盐粒Cu试样表面的腐蚀产物成分不随盐粒成分而改变,但在沉积 (NH4)2SO4盐粒的铜试样表面,除了Cu峰和Cu2O的特征峰,在16.5°、24.8°处还出现了Cu5(SO4)2(OH)6·5H2O的特征峰,说明 (NH4)2SO4盐粒会促使Cu生成羟基硫酸铜类的腐蚀产物。
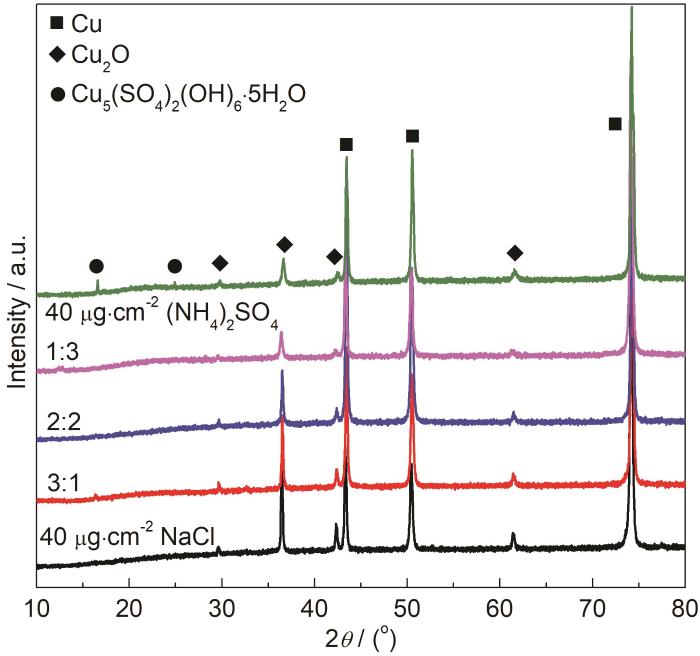
图9 表面沉积不同比例盐粒的铜片在30 ℃,RH90%条件下暴露72 h后的腐蚀产物XRD图
在Cu的大气腐蚀过程中,NH4+的存在会促使铜生成Cu2O腐蚀产物,而随着腐蚀过程的进行,Cu试样表面逐渐会形成以CuSO4为溶质的薄液膜,最后与OH-反应生成碱式硫酸铜腐蚀产物。
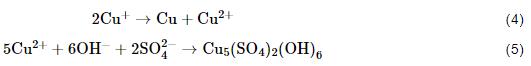
Cu大气腐蚀的阴极反应为氧的还原:
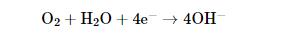 (6)
(6)
Cl-对Cu具有很强的腐蚀催化作用:
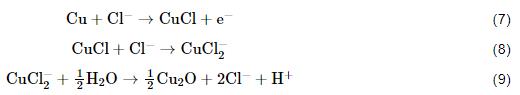
沉积不同比例盐粒铜试样表面腐蚀产物的XRD结果进一步证明了上述Cu初期大气腐蚀的机制。
为了进一步确定沉积不同盐粒Cu表面腐蚀产物的成分,通过XPS对其分析,如图10所示。可见在不同铜试样的Cu 2p谱中,932.6和952.6 eV处的峰为Cu 2p3/2和Cu 2p1/2的Cu+特征峰,表明腐蚀产物中Cu2O的存在,位于934.9和955.2 eV处的峰为Cu 2p3/2和Cu 2p1/2的Cu2+特征峰,在C 1s谱中,沉积不同盐粒铜试样表面在288.6 eV处都出现了CO32-的特征峰,说明腐蚀产物中可能有微量碱式碳酸铜的存在,这是由于空气中的少量CO2吸附在薄液膜中导致的。在S 2p谱中,沉积NaCl和混合盐粒的铜试样表面均未出现特征峰,而在沉积 (NH4)2SO4的铜试样表面在168.9 eV处出现了SO42-的特征峰,其与Cu2+形成碱式硫酸铜,这与XRD结果一致。
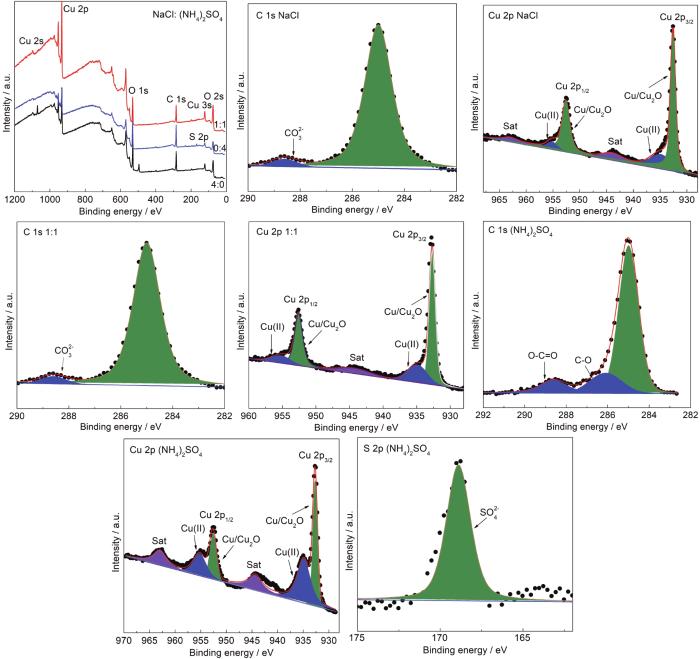
图10 沉积40 g/cm2 NaCl,NaCl: (NH4)2SO4 (1:1),(NH4)2SO4的Cu在30 ℃和RH90%条件下暴露3 d后表面XPS谱图
图11分别为未沉积盐粒的洁净铜表面和沉积不同比例盐粒铜表面在30 ℃,RH90%条件下,腐蚀3 d后的ESEM形貌图。未沉积盐粒的铜表面在3 d后表面只有因打磨产生的划痕,未见明显腐蚀产物,而沉积不同比例盐粒的铜在暴露3 d后,其表面产生了大量的腐蚀产物。如图11b和c,尤其是在NaCl盐粒沉积为主的铜表面生成了许多颗粒状的腐蚀产物,这种松散的腐蚀产物层显然无法形成良好阻隔层,而如图11e和f是以 (NH4)2SO4盐粒为主的铜表面形貌,可见形成了比较致密的腐蚀产物层,这可能对NaCl盐粒腐蚀有一定的阻隔作用。
图11 未沉积和沉积不同比例盐粒的铜试样在30 ℃和RH90%条件下暴露3 d后的微观腐蚀形貌
3 结论
(1) 采用电化学阻抗梳齿探头、薄膜电阻探针和石英晶体微天平等技术,在环境试验箱中研究了不同温湿度大气环境下电路板铜的加速腐蚀过程,相比传统人工液膜下的模拟大气腐蚀研究,直接大气腐蚀测量更能反映电路板铜在真实大气环境下的腐蚀行为。
(2) NaCl和 (NH4)2SO4盐粒对Cu的大气腐蚀加速作用有显著差异,当二者共存时,相比单独组分盐粒,相同沉积量下混合盐粒对Cu的大气腐蚀加速作用会减弱,尤其是当两种盐粒沉积量相同时,对铜的腐蚀性最弱,表明 (NH4)2SO4盐粒可以抑制NaCl盐粒的腐蚀。
(3) 由TER可知,在30 h前,(NH4)2SO4和NaCl混合盐粒对Cu的大气腐蚀具有协同促进作用,其腐蚀速率大于单一沉积NaCl盐粒的铜试样;30 h后,沉积混合盐粒铜大气腐蚀速率相比单独沉积NaCl盐粒时受到抑制。
(4) 微观形貌与分析表明,(NH4)2SO4水解产生的NH3·H2O对Cu初期腐蚀有强烈促进作用,随后Cu(NH3)2+的水解有助于生成致密的Cu2O腐蚀产物层,从而抑制Cu的大气腐蚀;单纯NaCl盐粒存在时,生成的Cu(OH)Cl腐蚀产物不具有保护性,而当沉积等量的 (NH4)2SO4和NaCl的等比例混合盐粒时,有助于生成致密Cu2O保护层,从而表现出最低腐蚀性。
参考文献
1 Gil H, Calderón J A, Buitrago C P, et al. Indoor atmospheric corrosion of electronic materials in tropical-mountain environments [J]. Corros. Sci., 2010, 52: 327
doi: 10.1016/j.corsci.2009.09.019
2 Xiao K, Gao X, Yan L D, et al. Atmospheric corrosion factors of printed circuit boards in a dry-heat desert environment: salty dust and diurnal temperature difference [J]. Chem. Eng. J., 2018, 336: 92
doi: 10.1016/j.cej.2017.11.017
3 Pei Z B, Cheng X Q, Yang X J, et al. Understanding environmental impacts on initial atmospheric corrosion based on corrosion monitoring sensors [J]. J. Mater. Sci. Technol., 2021, 64: 214
doi: 10.1016/j.jmst.2020.01.023
4 Huang H L, Guo X P, Zhang G A, et al. The effects of temperature and electric field on atmospheric corrosion behaviour of PCB-Cu under absorbed thin electrolyte layer [J]. Corros. Sci., 2011, 53: 1700
doi: 10.1016/j.corsci.2011.01.031
5 Yan L D, Xiao K, Yi P, et al. The corrosion behavior of PCB-ImAg in industry polluted marine atmosphere environment [J]. Mater. Des., 2017, 115: 404
doi: 10.1016/j.matdes.2016.11.074
6 Ding K K, Li X G, Xiao K, et al. Electrochemical migration behavior and mechanism of PCB-ImAg and PCB-HASL under adsorbed thin liquid films [J]. Trans. Nonferrous Met. Soc. China, 2015, 25: 2446
doi: 10.1016/S1003-6326(15)63861-4
7 Xiao K, Dong C F, Li X G, et al. Effect of deposition of NaCl on the initial atmospheric corrosion of Q235 [J]. J. Chin. Soc. Corros. Prot., 2006, 26: 26
7 肖葵, 董超芳, 李晓刚 等. NaCl颗粒沉积对Q235钢早期大气腐蚀的影响 [J]. 中国腐蚀与防护学报, 2006, 26: 26
8 Badilla G L, Samaniego E R, Perea S L T, et al. Characterization of copper sulfides formed in MEMS connections by atmospheric corrosion in indoor of electronics industry of arid and marine environments [J]. IFAC Proceed. Vol., 2013, 46: 24
9 Sonawane P D, Raja V K B, Gupta M. Mechanical properties and corrosion analysis of lead-free Sn-0.7Cu solder CSI joints on Cu substrate [J]. Mater. Today: Proceed., 2021, 46: 1101
10 Perveen K, Bridges G E, Bhadra S, et al. Corrosion potential sensor for remote monitoring of civil structure based on printed circuit board sensor [J]. IEEE Trans. Instrum. Meas., 2014, 63: 2422
11 Minzari D, Jellesen M S, M ller P, et al. On the electrochemical migration mechanism of tin in electronics [J]. Corros. Sci., 2011, 53: 3366
doi: 10.1016/j.corsci.2011.06.015
12 Yu X Y, Wang Z H, Lu Z H. In situ investigation of atmospheric corrosion behavior of copper under thin electrolyte layer and static magnetic field [J]. Microelectron. Reliab., 2020, 108: 113630
doi: 10.1016/j.microrel.2020.113630
13 Yu X Y, Wang Z H, Lu Z H. Atmospheric corrosion behavior of copper under static magnetic field environment [J]. Mater. Lett., 2020, 266: 127472
doi: 10.1016/j.matlet.2020.127472
14 Zhong X K. The corrosion and electrochemical migration of tin under thin electrolyte layers [D]. Wuhan: Huazhong University of Science and Technology, 2014
14 钟显康. 薄液膜下锡的腐蚀和电化学迁移行为及机理 [D]. 武汉: 华中科技大学, 2014
15 Zhong X K, Zhang G A, Qiu Y B, et al. In situ study the dependence of electrochemical migration of tin on chloride [J]. Electrochem. Commun., 2013, 27: 63
doi: 10.1016/j.elecom.2012.11.010
16 Zhang L, Wang Z Y, Zhao C Y, et al. Corrosion behavior of Q235 steel and weathering steel in simulated marine industry atmosphere [J]. Mater. Protect., 2015, 48(2): 19
16 张琳, 王振尧, 赵春英 等. 模拟海洋工业大气环境中Q235钢及耐候钢的腐蚀行为 [J]. 材料保护, 2015, 48(2): 19
17 Guo M X, Pan C, Wang Z Y, et al. A study on the initial corrosion behavior of carbon steel exposed to a simulated coastal-industrial atmosphere [J]. Acta Metall. Sin., 2018, 54: 65
17 郭明晓, 潘晨, 王振尧 等. 碳钢在模拟海洋工业大气环境中初期腐蚀行为研究 [J]. 金属学报, 2018, 54: 65
doi: 10.11900/0412.1961.2017.00142
18 Li K. Study on the corrosion mechanism of pure copper in the presence of ammonium sulfate [D]. Beijing: University of Chinese Academy of Sciences, 2018
18 李坤. 硫酸铵对纯铜腐蚀过程影响机理的研究 [D]. 北京: 中国科学院大学, 2018
19 Fan Y M, Liu W, Li S M, et al. Evolution of rust layers on carbon steel and weathering steel in high humidity and heat marine atmospheric corrosion [J]. J. Mater. Sci. Technol., 2020, 39: 190
doi: 10.1016/j.jmst.2019.07.054
20 Wang M N, Qiao C, Jiang X L, et al. Microstructure induced galvanic corrosion evolution of SAC305 solder alloys in simulated marine atmosphere [J]. J. Mater. Sci. Technol., 2020, 51: 40
doi: 10.1016/j.jmst.2020.03.024
21 Hu Y T, Dong P F, Jiang L, et al. Corrosion behavior of riveted joints of TC4 Ti-alloy and 316L stainless steel in simulated marine atmosphere [J]. J. Chin. Soc. Corros. Prot., 2020, 40: 167
21 胡玉婷, 董鹏飞, 蒋立 等. 海洋大气环境下TC4钛合金与316L不锈钢铆接件腐蚀行为研究 [J]. 中国腐蚀与防护学报, 2020, 40: 167
22 Qi D M, Cheng R Y, Du X Q, et al. Review on atmospheric corrosion of copper and copper alloys [J]. J. Chin. Soc. Corros. Prot., 2014, 34: 389
22 齐东梅, 成若义, 杜小青 等. Cu及其合金的大气腐蚀研究现状 [J]. 中国腐蚀与防护学报, 2014, 34: 389
23 Liu Y W, Wang Z Y, Cao G W, et al. Study on corrosion behavior of zinc exposed in coastal-industrial atmospheric environment [J]. Mater. Chem. Phys., 2017, 198: 243
doi: 10.1016/j.matchemphys.2017.05.043
24 Pan C, Lv W Y, Wang Z Y, et al. Atmospheric corrosion of copper exposed in a simulated coastal-industrial atmosphere [J]. J. Mater. Sci. Technol., 2017, 33: 587
doi: 10.1016/j.jmst.2016.03.024
25 Hao L, Zhang S X, Dong J H, et al. Evolution of atmospheric corrosion of MnCuP weathering steel in a simulated coastal-industrial atmosphere [J]. Corros. Sci., 2012, 59: 270
doi: 10.1016/j.corsci.2012.03.010
26 Schindelholz E J, Cong H, Jove-Colon C F, et al. Electrochemical aspects of copper atmospheric corrosion in the presence of sodium chloride [J]. Electrochim. Acta, 2018, 276: 194
doi: 10.1016/j.electacta.2018.04.184
27 Wan S, Ma X Z, Miao C H, et al. Inhibition of 2-phenyl imidazoline on chloride-induced initial atmospheric corrosion of copper by quartz crystal microbalance and electrochemical impedance [J]. Corros. Sci., 2020, 170: 108692
doi: 10.1016/j.corsci.2020.108692
28 Chen Z Y, Zakipour S, Persson D, et al. Effect of sodium chloride particles on the atmospheric corrosion of pure copper [J]. Corrosion, 2004, 60: 479
doi: 10.5006/1.3299244
29 Lobnig R E, Frankenthal R P, Siconolfi D J, et al. The effect of submicron ammonium sulfate particles on the corrosion of copper [J]. J. Electrochem. Soc., 1993, 140: 1902
doi: 10.1149/1.2220736
30 Lobnig R E, Frankenthal R P, Siconolfi D J, et al. Mechanism of atmospheric corrosion of copper in the presence of submicron ammonium sulfate particles at 300 and 373 K [J]. J. Electrochem. Soc., 1994, 141: 2935
doi: 10.1149/1.2059261
31 Wan S, Hou J, Zhang Z F, et al. Monitoring of atmospheric corrosion and dewing process by interlacing copper electrode sensor [J]. Corros. Sci., 2019, 150: 246
doi: 10.1016/j.corsci.2019.02.008
32 Wan S, Dong Z H, Guo X P. Investigation on initial atmospheric corrosion of copper and inhibition performance of 2-phenyl imidazoline based on electrical resistance sensors [J]. Mater. Chem. Phys., 2021, 262: 124321
doi: 10.1016/j.matchemphys.2021.124321
33 Qiao C, Wang M N, Hao L, et al. In-situ EIS study on the initial corrosion evolution behavior of SAC305 solder alloy covered with NaCl solution [J]. J. Alloy. Compd., 2021, 852: 156953
doi: 10.1016/j.jallcom.2020.156953
34 Qu Q, Li L, Bai W, et al. Initial atmospheric corrosion of zinc in presence of Na2SO4 and (NH4)2SO4 [J]. Trans. Nonferrous Met. Soc. China, 2006, 16: 887
doi: 10.1016/S1003-6326(06)60345-2
35 Qu Q, Li L, Bai W, et al. Effects of NaCl and NH4Cl on the initial atmospheric corrosion of zinc [J]. Corros. Sci., 2005, 47: 2832
doi: 10.1016/j.corsci.2004.11.010
36 Wadsak M, Schreiner M, Aastrup T, et al. Combined in-situ investigations of atmospheric corrosion of copper with SFM and IRAS coupled with QCM [J]. Surf. Sci., 2000, 454-456: 246
doi: 10.1016/S0039-6028(00)00081-9
37 Wiesinger R, Schreiner M, Kleber C. Investigations of the interactions of CO2, O3 and UV light with silver surfaces by in situ IRRAS/QCM and ex situ TOF-SIMS [J]. Appl. Surf. Sci., 2010, 256: 2735
doi: 10.1016/j.apsusc.2009.11.019
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414