摘要
介绍了硫酸盐还原菌 (SRB) 的生态和生理特征及在含SRB的环境中金属材料阴极保护的可靠性;重点综述了阴极极化对SRB腐蚀的影响,包括阴极极化对金属材料氢脆和力学性能、金属构筑物周围环境和微生物的影响;最后展望了微生物腐蚀研究的近期发展趋势。
关键词: 阴极极化 ; 硫酸盐还原菌 ; 微生物腐蚀
微生物腐蚀是微生物通过自身的生命活动直接或者通过其代谢产物间接的影响金属材料腐蚀过程的现象。全世界每年因腐蚀造成的损失约占国民生产总值的3%~5%以上。硫酸盐还原菌 (SRB)、铁细菌、铁氧化细菌、硫氧化细菌等微生物为重要元凶,一半以上 (50%~80%) 的地下管线腐蚀由微生物引起[,许多国家将15%~20%的工程费用用于防腐。2016年,全国腐蚀调查显示,我国腐蚀成本占全部GDP的3.34%,总额超过21000亿元人民币。
微生物附着在工程材料表面形成生物膜,在材料和微生物膜界面处pH值、溶解氧、有机物和无机物等因素都与海洋本体环境完全不同。微生物活性可通过以下方式控制材料表面电化学腐蚀过程:(1) 微生物代谢过程影响材料的阴、阳极反应过程;(2) 微生物的代谢产物影响材料的阴阳极反应;(3)微生物通过在材料表面生成生物膜改变材料表面腐蚀环境;(4) 微生物直接参与金属的腐蚀过程。阴极保护技术作为最有效的腐蚀防护方法已经得到世界范围的承认,它被广泛地作为油气管道、船舶、海洋钻井平台等钢铁构筑物的腐蚀防护技术。阴极极化电位的施加改变了已有金属与微生物之间的平衡,引起金属-溶液界面性质变化,同时也影响着微生物的活动和金属的腐蚀行为。本文结合SRB的生理特征和金属材料阴极保护的可靠性,从阴极极化电位和 SRB 相互作用关系方面系统阐述和总结了施加阴极极化电位对SRB腐蚀的影响。
1 SRB的生态和生理特征
SRB是指一类能够把硫酸盐、亚硫酸盐、硫代硫酸盐等硫化物以及 S 还原成 H2S 的细菌的统称。SRB广泛存在于土壤、海水、河水、地下管道、油气井等处。由于各地土壤类型、气候状况、地理位置等因素的差异,土壤中的SRB含量差别较大。我国库尔勒、格尔木、拉萨、成都、大庆、沈阳、大港、鹰潭8个土壤试验站的表层土壤的SRB含量小于或等于10~1800 cell·g-1不等。浙江省象山港海域表层海水和上覆水的 SRB 含量的年度均值分别为 173 和1000 cell·mL-1,沉积物中为 1440 cell·g-1;胶州湾潮间带和沿岸区、克莱德海表层沉积物中的SRB含量则分别高达4.1×107和2.7×107 cell·g-1。大部分陆生SRB是中温菌,其最适宜生长温度为30~40 ℃;海洋中SRB的最适宜生长温度稍低一些。SRB并不是严格的厌氧菌,分离自长庆油田采油回收污水水样的 SRB 可耐受 4.5 mg·L- 1浓度的溶解氧。适合SRB生长的pH值范围较广,在5.5~9.0的酸碱度范围内均能生长繁殖,其中7.5是比较合适的酸碱度条件。
SRB是最早的通过电子传递耦合磷化作用而非光合作用来产生三磷酸腺苷 (ATP) 的厌氧细菌,在此过程中SRB利用SO42-作为最终电子受体,从H或者有机酸的活化来获得电子,同时产生腐蚀性S2-和有机酸等代谢产物。SRB 还原 SO42-的过程由一系列酶促反应组成。在这些酶促反应中,S得到8个电子,产生多个中间产物。硫酸盐在硫酸腺苷转移酶的作用下,以消耗ATP为代价激活硫酸盐,使之生成腺嘌呤磷酰硫酸盐 (APS)。反应生成的焦磷酸可被继续水解,并由此促进整个反应的进行。相应的反应式如下:

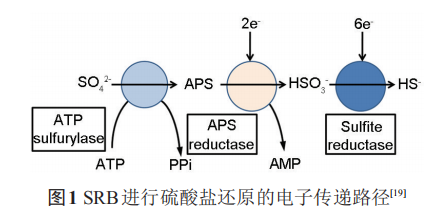
2 含SRB环境中金属材料阴极保护的可靠性
要达到基本的保护需要-0.85 VCSE的保护电位(英国阴极保护标准)。Horvarth 和Novak于1964年提出,若水溶液中存在 SRB,则其阴极保护电位需要降低到-0.95 VCSE (即-1.022 VSCE) 的阴极保护标准。1981年,Fisher进行了实验证实。通常随着阴极极化电位的增加,腐蚀速率降低。要达到零腐蚀,理想的状态是极化阳极达到它的可逆电位。在可逆电位状态下,阳极溶解速率等于阳极沉积速率,没有金属的损失。但从实践和经济的角度看,腐蚀速率降低到10 mA/m2 (即11.6 μm/a) 时就可以被认为是得到了充分保护。保护不足和过保护都是不希望得到的状态。过保护状态下,可能引起快速的氢析出,从而导致钢结构的氢脆。
阴极极化对金属的SRB腐蚀行为的影响一直是研究的重点。在SRB存在条件下,最佳阴极保护电位负移。在铁细菌中,负于-0.85 VCSE的阴极极化电位能明显减少铁细菌的数目,并达到较好的阴极保护效果。但是,在含SRB的介质中,阴极极化电位需达到-1.35 VCSE才能获得相同的阴极保护效果。在含SRB的海泥中,对应-0.95,-1.03和-1.16 VCSE的阴极极化电流密度分别是5,11和82 mA/m2,相应的剩余腐蚀速率分别为12.4,8.9和5.5 mA/m2。在含SRB介质中,硫化铁产物的不稳定保护作用是导致最佳阴极保护电位降低的重要原因。在Starosvetsky等研究中,在-0.1 VSCE的电位下,阴极表面的铁硫化物沉积即可被还原。作者认为,若Fe的腐蚀发生在低于该电位的条件下,那么铁硫化物的还原可能提供了一种新型的阴极去极化机理。阴极极化条件下,金属表面的电位远远低于该电位,经由铁硫化物还原导致的阴极去极化作用可能在金属的腐蚀中发挥了重要作用。
3 阴极极化技术对SRB腐蚀的影响
3.1 阴极极化对金属材料氢脆和力学性能的影响
在苛刻的海洋腐蚀环境中,对金属构筑物进行阴极保护的腐蚀控制时,在金属和海水界面会发生氧化还原反应,阴极反应为吸氧反应还是析氢反应取决于溶液中溶解氧含量、电位、pH值等。目前,设计时采用不正于-0.85 VCSE的阴极保护判据;当金属所处环境中含有SRB时,则需要-0.95 VCSE甚至更负的电位。在更负的阴极极化过程中,金属表面会逐渐形成钙镁沉积层,从而使材料的氢扩散系数降低,然而较高的阴极保护电位可能会对金属产生过保护:
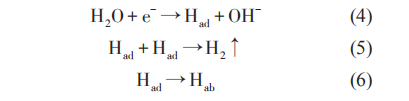
式中,Had和 Hab分别代表吸附在金属表面和扩散到金属内部中的H。
阴极反应所产生的H部分以H2的形式逸出,部分则吸附在材料表面,逐渐渗透到金属的内部,从而引起氢脆,导致材料性能骤减而失效。常娥等对921A钢的氢脆敏感性研究表明,在-0.96 VSCE极化电位下,阴极反应产生的Had进入材料内部,材料强度增加,韧性降低,耐氢脆应力腐蚀性能降低。当负于-1.01 VSCE以后,析氢反应加剧,出现了脆性断裂。Yu 等研究认为,当金属表面有 SRB 出现时,SRB 生物膜可以从极化电极中获得电子传递给 H+催化产氢。此种情况下,吸附的H含量通常显着增加,SRB存在时氢渗透电流密度是无SRB存在时氢渗透电流密度的3~4倍。
同时,一系列研究表明,SRB代谢产生的硫化物能增加金属对H的吸附和渗透作用,进而导致氢脆的产生,但该促进作用因金属的不同而存在一定的差异。相较于无菌和无H2S 的条件,SRB存在时低合金钢的氢渗透略微增加;但对高强钢和低合金钢,SRB能显着增加金属表面生物膜中的硫化物浓度,从而促进金属对H的吸收。Lunarska等的研究进一步证实,在含 SRB 的环境中,阴极保护条件下金属表面弱保护性沉积物的形成、S2-的产生可能促进了钢铁材料的氢吸收。阴极极化条件下,SRB 对不同钢材腐蚀行为的影响不同,其促进作用与 S2-的形成和硫化物沉积的形成有关。相同极化电位下,相较于波来铁,糙斑铁能吸收更多的H,且劣化也更为严重。总体来说,当海水中存在SRB 时,阴极保护应避免钢材构筑物的某些部分处于-1.1~-1.2 VNCE的极化电位下。
国内一些学者研究了不同阴极极化电位对咸水环境 (3.5%(质量分数) NaCl溶液) 中Q235钢氢脆敏感性的影响,并对断口形貌进行了分析。结果表明,随着阴极保护电位的负移,Q235钢的力学性能 (最大抗拉强度和屈服强度) 并没有呈现规律性变化,但断面收缩率减小,材料发生氢脆的可能性加大。在-1.1 VSCE的阴极保护电位下,断口出现了准解理断裂特征形貌。
3.2 阴极极化对金属构筑物周围环境的影响
海洋环境中的金属设施通常处于阴极保护状态下。所施加阴极电流的大小与金属表面所形成膜的厚度、结构、组成等有关。在阴极极化状态下形成的腐蚀产物组成、钙质沉积层和生物膜等性质与阴极电位大小有关。阴极极化使被保护金属的电位整体负移,避免不同相间发生原电池腐蚀,从而导致在金属表面形成钙镁沉积层和微生物膜。沉积层出现后可以抑制海水中的氧扩散到钢表面,并提高阴极保护效率。然而,生物膜的附着和钙质层的形成也使得极化电阻增大,要达到相同的电位所需极化电流增大。
当对被保护金属施加阴极电位时,在阴极极化的初始阶段,O2被还原,生成OH-:
在更负的阴极极化电位下,H2O 被还原生成OH-和H2。
以上反应表明,随着阴极极化电位的负移,金属材料周围环境中的pH值升高,环境逐渐变为碱性,并导致钙质层的沉积。
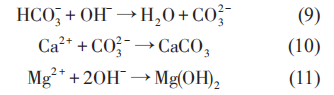
阴极极化条件下生物膜的结构特点和腐蚀产物 (无机沉积) 发生了变化。Sun等研究了阴极极化条件下,土壤中 SRB 对 Q235 钢腐蚀行为的影响,认为当阴极极化电位从开路电位 (约-0.82 VCSE)负移至-0.85 VCSE时,其 pH 值约升高 1;但随着阴极极化电位继续负移时,SRB 数量减少,但由于 CO32-和Ca2+的缓冲作用,pH值变化不大。同时,Ca2+浓度减小和pH值升高可以显着抑制细菌的附着。使用X射线能谱 (EDX) 对阴极保护条件下Q235钢表面的腐蚀产物组成进行分析表明,在不含SRB的土壤中,Q235 钢表面的腐蚀产物中没有 FeS;而在含SRB 的土壤中,Q235 钢表面则覆盖有一层黑色的FeS。在自腐蚀电位下,腐蚀产物中不含C;而在极化电位下,由于阴极极化电流降低了HCO3-与Ca2+反应生成CaCO3的活化能,无论有无SRB存在,腐蚀产物中都含C。
当钢铁材料浸泡在细菌介质中时,表面可能形成各种类型的铁硫化物。研究表明,腐蚀产物Fe1+xS开始时能为金属提供保护,但是当该种产物层变厚时,有可能发生开裂,导致腐蚀速率增加。同时亦有研究表明,FeS 在细菌的胞外电子传递中起着重要的作用,HS-和可溶性聚硫化物在将电子从希瓦氏菌 (Shewanella oneidensis) MR-1胞外传递到与细菌接触的FeS中起着重要作用。在含有SRB介质中,阴极极化电位的增加,使铁的腐蚀产物由硫酸盐向碳酸盐发生转变,并且随着阴极极化电位的负移,转化的碳酸盐含量增加。
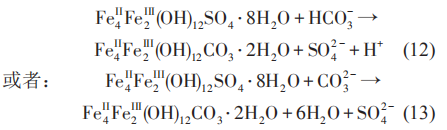
3.3 阴极保护对SRB的影响
在天然海水中,阴极极化电位的施加可有效抑制生物膜的附着,阴极氧还原是阴极极化抑菌的主要机制。然而对于无氧环境中,阴极极化作用未能有效抑制厌氧微生物的附着。阴极极化条件下,不锈钢表面附着的SRB的数量未减少,该特点与好氧细菌生物膜不同。-0.95 VCSE的阴极极化电位下,微生物的活动未受影响,种群生长 (电解液环境中,非试片表面) 反而略微增强。虽然已有很多研究表明阴极保护下的生物膜和钙质层之间有密切联系,但是由于实验室环境和实际海洋环境存在差异,海水中有机物的差异造成了电流密度、形成的钙质层和生物膜的不同,要探究生物膜和阴极极化的关系并不容易。
阴极极化对SRB代谢影响可以分为以下几种:
3.3.1 阴极极化抑制 SRB 代谢 阴极保护条件下,在极化电极表面产生自由H的速率高于SRB去极化过程中的速率。有活性SRB存在时,外加保护电位会降低0.1 V,即降到-0.95 VCSE,才可以产生保护作用。甚至有研究结果表明,由于阴极极化导致金属腐蚀电位改变,从而在无菌环境中的阴极极化电位在SRB环境中变为阳极极化,即在SRB介质中金属的开路电位比无菌环境中最佳阴极保护电位更负。
当金属构筑物浸泡在海水中,微生物附着在金属表面,吸附作用在微生物附着的初期 (约当浸泡在海水中之后的前 100 min 之内) 起主导作用。阴极电位施加之后,附着的细菌数目明显减少,特别是细菌附着初期,这说明阴极极化电位的施加通过静电作用影响了微生物的吸附过程,同时施加极化后在界面上产生H2O2以及多余的OH-等,抑制了微生物的附着。
阴极极化下 SRB 的代谢活性一直是研究者探讨的热点。Lunarska等研究在人工海水中阴极极化下SRB对金属力学性能的影响时认为,在低弱阴极极化时,SRB 在电极表面产生 H2S,使得界面 pH值降低,抑制钙质层的出现。但是在强阴极极化时,由于界面产生的强碱性区 (反应式 (6) 和 (7)) 使得界面pH值升高,抑制了SRB的生长。李国华等研究含SRB土壤中阴极极化对Q235钢腐蚀的影响时认为,随着阴极极化电位不断负移,Q235钢件周围的土壤中SRB数量逐渐减少,但在-1.05 VCSE的阴极极化电位下,Q235钢试件周围土壤中SRB仍能够存活;在相同的外加电位下,Q235钢在有菌土壤中所需要的阴极极化电流密度较大。Dhar 等认为负于-1024 mV的阴极极化电位可以使微生物浓度降低1~2个数量级。施加脉冲阴极极化可同样抑制微生物的活性,5~20µA·cm-2的阴极电流密度可以使微生物浓度降低2~3个数量级。将施加阴极极化的不锈钢浸泡在 Vibrio alginolyticu 溶液中,阴极极化3 h能明显减少微生物的附着,但是在浸泡时间超过9 h以后,在极化和未极化体系中微生物的差异消失。
3.3.2 阴极极化促进 SRB 代谢 SRB 代谢活性与阴极极化电位密切相关,随着阴极极化电位的负移,SRB的数目呈现先增加后减小的趋势,FeS的含量变化趋势与 SRB 细菌数目一致。强阴极极化电位下SRB数目的减少与其界面pH值的升高密切相关,而弱阴极极化下SRB数目增加说明弱阴极极化电位促进了SRB的代谢活性。赵晓栋等研究了含有 SRB 的海泥中阴极极化电位对碳钢腐蚀的影响,通过最大概率计数法结合不同阴极极化电位下的 Bode 图得出,在低电位(-0.85 VCSE) 下细菌的生长活性与稳定性高于在较高阴极极化电位 (-0.95 和-1.05 VCSE) 下的,且高于无施加阴极极化电位下的细菌数目。对硫还原地杆菌 (Geobactersulfurreducens) 的研究表明,生物膜形态和结构对金属表面的电流密度具有重要影响,离散的、稀疏的菌膜产生的电流密度高于致密的菌膜。因此不同阴极极化电位下,细菌生物膜形态和结构的改变及活性的变化都会对金属的腐蚀产生一定的影响。SRB 作为一种电活性微生物,其与极化金属间电子传递方式可分为直接电子传递 (DET) 和间接电子传递 (MET)。图3显示了SRB在与极化电极之间的DET和MET方式。
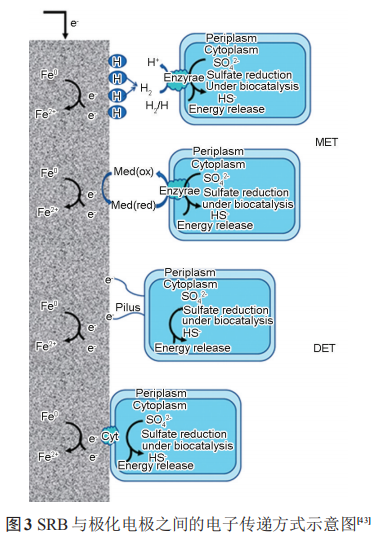
(1) 间接电子传递Fe 失去的电子须借助电子传递介质才能传递到SRB中。在微生物燃料电池中,电子传递介质的使用可以增加细菌的产电能力。电子传递介质从阴极极化的电极中获得电子,通过电子传递通道,将电子传递到SRB中。H可以作为SRB与极化电极之间间接电子传递的介质。施加阴极极化后,H+向电极表面移动并在电极表面上还原成[H];而[H]在SRB中氢化酶的催化下还原SO42-并为SRB的代谢提供能量,从而促进SRB的生长代谢。同时,在此过程溶液的pH值升高。研究表明,Desulfitobacterium 可以通过在极化-0.7 VSHE电极上进行H的活化。产电微生物Geobacter sulfurreducens可以利用极化电极上H的氧化还原进行产电,其反应如下:
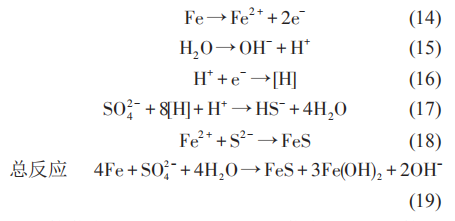
核黄素、奎宁胡敏酸、吩嗪和黄素腺嘌呤二核苷酸 (FAD) 等是常见的内生电子传递介质。SRB 可以利用维生素B12等与极化的电极进行间接的电子传递。在SRB介质中,铁硫化物也可以作为SRB的电子传递通道。在这个过程中,硫酸铁 (Fe2(SO4)3)可以作为 SRB 的电子传递受体,从而将铁的腐蚀产物转化为碳酸铁 (Fe2(CO3)3)、蓝铁矿 (Fe3(PO4)2·(H2O)8)、硫化铁 (Fe2S3) 等,同时促进 SRB 的代谢活性,如图4所示。
(2) 直接电子传递直接电子传递为SRB利用细胞色素c等电子传递蛋白或者自身形成的纳米线与电极直接进行电子传递。Sherar 等和Xu等的研究表明,在碳源不足的条件下,SRB会形成纳米线从金属基体中直接获得电子。
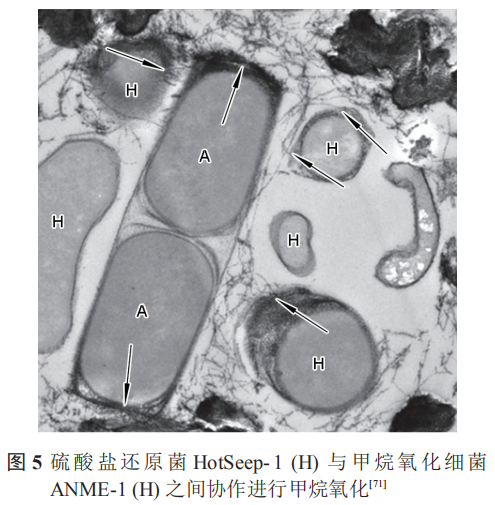
除此之外,在共生的细菌中,非产电细菌亦可为产电细菌提供电子通道。Wegener等证明甲烷氧化细菌 (ANME-1) 与 SRB (HotSeep-1) 之间可以通过形成纳米线进行电子传递,图5中箭头明确指出了电子传递的纳米线。
阴极极化电位影响SRB的电子传递方式,并影响着 SRB 的代谢活性。在合适的阴极极化电位下(如-0.4 VSCE或-0.7 VHSE等),SRB 可以从极化的电极中直接或间接获得电子用于自身的代谢,即较低的阴极极化可以促进SRB的代谢,而强阴极极化电位则会抑制SRB的代谢和生长。极化作用所在电极表面产生的强碱性环境,并不利于细菌附着,这反而抑制了SRB的活性;此外,已有研究证明,金属表面形成的FeS等腐蚀产物也为SRB从溶液铁金属中直接获得电子提供了通道 (图6)。
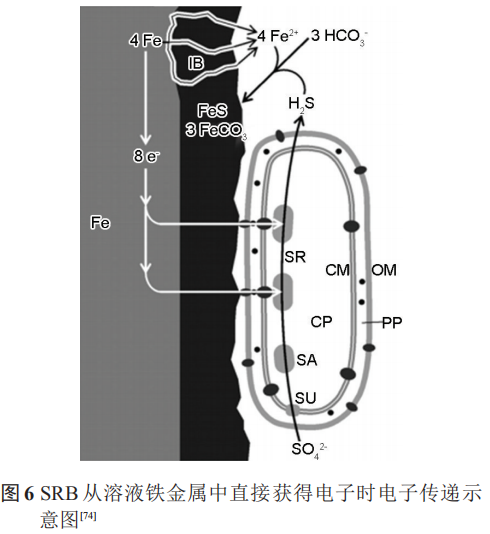
Nekoksa等研究认为,-1 VSCE的阴极极化使金属表面pH值降低,金属表面SRB数目增多。当电位低于-1 VSCE时,pH值逐渐呈现碱性,SRB数目降低。利用电化学测试和生物分析方法探究阴极极化下的微生物活动结果表明,-0.9 VAg/AgCl的阴极极化可以在短期内为海洋金属设施提供保护;但是当极化终止后,厌氧SRB将通过消耗阴极极化过程中产生的H来促进自身的生长代谢,从而加速金属的腐蚀。
4 问题与展望
近几十年来,微生物腐蚀已经成为国内外腐蚀与防护研究的重点,人们在研究阴极极化与微生物间的相互作用方面也取得了很大的进步。但要全面深入地认识微生物腐蚀与腐蚀防护技术 (如阴极保护) 的相互作用,仍有诸多问题需要解决。如近些年的研究表明,生物膜内细菌群落组成的差异和细菌代谢活动产生的差异对微生物腐蚀具有重要影响,然而在评估生物膜对金属腐蚀的影响时很少考虑到SRB的代谢特异性。2004年,Dinh等在只有Fe为电子受体的培养基中分离出脱硫弧菌属 (Desulfobacterium) 的一个新种,相较于传统的耗氢型菌株,该菌株还原硫酸盐的速度更快,作者推测此类菌株能够从金属中直接获得电子。Venzlaff等从实验验证了以上推测。Yu等从铁锈中分离纯化了Desulfovibrio caledoniensis,并证实其能够从-0.74 VSHE的极化电极中获得电子,即利用阴极作为电子供体,这种直接电子传递的通路在生物代谢和加速金属腐蚀中有重要作用。其他的一些研究也表明,同一个属的不同菌株对金属腐蚀行为存在很大的不同。因此,在将来有关微生物腐蚀的研究中,加强物种多样性的调查是非常必要的。对于那些能够直接从金属中获得电子的SRB菌株,有关其腐蚀过程中电子传递机理方面的研究甚少。利用分子生物学、光谱电化学及微区腐蚀观察等技术手段研究 SRB 菌株的直接电子传递途径及其呼吸代谢机制,对未来微生物腐蚀研究探索有重要意义。
参考文献
[1] Buchanan R A, Kovacs A L, Lundin C D, et al.Microbially influenced corrosion of Fe-, Ni-, Cu-, Al-, and Ti-based weldments[J]. Mater. Perform., 1997, 36(6): 46
[2] Koch G H,Brongers M P H,Thompson N G,et al.Corrosion cost and preventive strategies in the United States[J]. J. Endocrinol., 2002, 122(1): 23
[3] Zhang F, Liu H W, Chen B, et al.Corrosion inhibition of imidazoline for carbon steel in CO2-saturated artificial sewages with sulfate reduction bacteria[J]. J. Chin. Soc. Corros. Prot., 2015, 35: 156(张帆, 刘宏伟, 陈碧等. CO2和SRB共存产出水中咪唑啉衍生物的环境行为及缓蚀长效性研究[J]. 中国腐蚀与防护学报, 2015, 35: 156)
[4] Liu H W, Zhang F, Wu Y N, et al.Inhibition behavior of dodecylamine inhibitor in oilfield produced water containing saturated CO2 and SRB[J]. Corros. Prot., 2015, 36: 137(刘宏伟, 张帆, 吴亚楠等. 油田产出水中饱和CO2和SRB共存条件下十二胺缓蚀剂的缓蚀行为[J]. 腐蚀与防护, 2015, 36: 137)
[5] Liu H W, Liu H F, Qin S, et al.Investigation of biomineralization induced by sulfate reducing bacteria in sewage gathering pipelines in oilfield[J]. Corros. Sci. Prot. Technol., 2015, 27: 7(刘宏伟, 刘宏芳, 秦双等. 集输管线硫酸盐还原菌诱导生物矿化作用调查[J]. 腐蚀科学与防护技术, 2015, 27: 7)
[6] Liu H W, Xu D K, Dao A Q, et al.Study of corrosion behavior and mechanism of carbon steel in the presence of Chlorella vulgaris[J]. Corros. Sci., 2015, 101: 84
[7] Liu H F, Gu T Y, Asif M, et al.The corrosion behavior and mechanism of carbon steel induced by extracellular polymeric substances of iron-oxidizing bacteria[J]. Corros. Sci., 2017, 114: 102
[8] Liu H W, Gu T Y, Zhang G A, et al.Corrosion inhibition of carbon steel in CO2-containing oilfield produced water in the presence of iron-oxidizing bacteria and inhibitors[J]. Corros. Sci., 2016, 105: 149
[9] Liu H W, Gu T Y, Zhang G A, et al.The effect of magneticfield on biomineralization and corrosion behavior of carbon steel induced by iron-oxidizing bacteria[J]. Corros. Sci., 2016, 102: 93
[10] Liu H W, Xu D K, Wu Y N, et al.Research progress in corrosion of steels induced by sulfate reducing bacteria[J]. Corros. Sci. Prot. Technol., 2015, 27: 409(刘宏伟, 徐大可, 吴亚楠等. 微生物生物膜下的钢铁材料腐蚀研究进展[J]. 腐蚀科学与防护技术, 2015, 27: 409)
[11] Chen H W.The economic importance and activities of marine sulfate-reducing bactria[J]. J. Oceanogr. Huanghai Bohai Seas, 1998,16(4): 64(陈皓文. 海洋硫酸盐还原菌及其活动的经济重要性[J]. 黄渤海海洋, 1998, 16(4): 64)
[12] Liu H F, Fu C Y, Gu T Y, et al.Corrosion behavior of carbon steel in the presence of sulfate reducing bacteria and iron oxidizing bacteria cultured in oilfield produced water[J]. Corros. Sci., 2015, 100: 484
[13] Barton L L.Sulfate-Reducing Bacteria[M]. New York: Springer Science & Business Media, 1995
[14] Li Q.Molecular ecological characterization of different treatments on microbial community structure in acid sulfate soil [D]. Hangzhou: Zhejiang University, 2014(李琼. 不同处理方式对酸性硫酸盐土中微生物群落结构的生态学研究 [D]. 杭州: 浙江大学, 2014)
[15] Jiang B, Gong A J, Li X G, et al.The distribution laws of sulfate-reducing bacteria in eight soil corrosion test stations in China[J]. Chem. Bioerg., 2008, 25(4): 54(蒋波, 弓爱君, 李晓刚等. 硫酸盐还原菌在8个土壤试验站中的分布规律研究[J]. 化学与生物工程, 2008, 25(4): 54)
[16] Wang H L, Yang J F.Spatiotemporal distribution of sulfate-reducing bacteria in Xiangshan Bay and related affecting factors[J]. Chin. J. Ecol., 2011, 30: 2857(王海丽, 杨季芳. 象山港海域硫酸盐还原菌的时空分布及其影响因素[J]. 生态学杂志, 2011, 30: 2857)
[17] Zhang X L, Chen Z X, Liu H H, et al.Effect of environment factors on the growth of sulfate-reducing bacteria[J]. J. Chin. Soc. Corros. Prot., 2000, 20: 224(张小里, 陈志昕, 刘海洪等. 环境因素对硫酸盐还原菌生长的影响[J]. 中国腐蚀与防护学报, 2000, 20: 224)
[18] Cai J, Zheng P, Zhang L.Sulfate-reducing bacteria and their metabolic pathway[J]. Bull. Sci. Technol., 2009, 25: 427(蔡靖, 郑平, 张蕾. 硫酸盐还原菌及其代谢途径[J]. 科技通报, 2009, 25: 427)
[19] Zhang P Y, Xu D K, Li Y C, et al.Electron mediators accelerate the microbiologically influenced corrosion of 304 stainless steel by the Desulfovibrio vulgaris biofilm[J]. Bioelectrochemistry, 2015, 101: 14
[20] Horváth J, Novák M.Potential/pH equilibrium diagrams of some Me-S-H2O ternary systems and their interpretation from the point of view of metallic corrosion[J]. Corros. Sci., 1964, 4: 159
[21] Fischer K P.Cathodic protection in saline mud containing sulfate reducing bacteria[J]. Mater. Perform., 1981, 20(10): 41
[22] Kajiyama F, Okamura K.Evaluating cathodic protection reliability on steel pipe in microbially active soils[J]. Corrosion, 1999, 55: 74
[23] Duan J Z.Microbiologically influenced corrosion of steels in seawater and seamud containing sulfate-reducing bacteria [D]. Qingdao: Institute of Oceanology,Chinese Academy of Sciences, 2003(段继周. 海水和海泥环境中厌氧细菌对海洋用钢微生物腐蚀行为的影响 [D]. 青岛: 中国科学院研究生院 (海洋研究所), 2003)
[24] Starosvetsky D, Starosvetsky J, Armon R, et al.A peculiar cathodic process during iron and steel corrosion in sulfate reducing bacteria (SRB) media[J]. Corros. Sci., 2010, 52: 1536
[25] General Administration of Quality Supervision,Inspection and Quarantine of the People's Republic of China,Standardization Administration of the People's Republic of China. GB/T 21448-2008 Specification of cathodic protection for underground steel pipelines [S]. Beijing: Standards Press of China, 2008(中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 21448-2008 埋地钢质管道阴极保护技术规范 [S]. 北京: 中国标准出版社, 2008)
[26] Zhang T M, Zhao W M, Guo W, et al.Susceptibility to hydrogen embrittlement of X65 steel under cathodic protection in artificial sea water[J]. J. Chin. Soc. Corros. Prot., 2014, 34: 315(张体明, 赵卫民, 郭望等. 阴极保护下X65钢在模拟海水中的氢脆敏感性研究[J]. 中国腐蚀与防护学报, 2014, 34: 315)
[27] Chang E, Yan Y G, Li Q F, et al.Effects of cathodic polarization on the hydrogen embrittlement sensitivity of 921A steel in sea water[J]. J. Chin. Soc. Corros. Prot., 2010, 30: 83(常娥, 闫永贵, 李庆芬等. 阴极极化对921A钢海水中氢脆敏感性的影响[J]. 中国腐蚀与防护学报, 2010, 30: 83)
[28] Yu L, Duan J Z, Zhao W, et al.Characteristics of hydrogen evolution and oxidation catalyzed by Desulfovibrio caledoniensis biofilm on pyrolytic graphite electrode[J]. Electrochim. Acta, 2011, 56: 9041
[29] Zhu Y Y.The effects of sulfate reducing bacteria and polarization potential on the stress corrosion cracking sensitivity of 16Mn and API X56 steel in Sea-mud [D]. Qingdao: Institute of Oceanology,Chinese Academy of Sciences, 2007(朱永艳. 硫酸盐还原菌和极化电位对海洋结构用钢在海泥中的应力腐蚀开裂敏感性的影响[D].青岛: 中国科学院研究生院(海洋研究所), 2007)
[30] Edyvean R G J, Benson J, Thomas C J, et al. Biological influences on hydrogen effects in steel in seawater [R]. New Orleans,Louisiana: NACE International, 1997
[31] Grobe S, Prinz W, Sch?neich H G, et al.Influence of sulfate-reducing bacteria on cathodic protection[J]. Werk. Korros., 1996, 47: 413
[32] Robinson M J, Kilgallon P J.Hydrogen embrittlement of cathodically protected high-strength, low-alloy steels exposed to sulfate-reducing bacteria[J]. Corrosion, 1994, 50: 626
[33] Dom?alicki P, Lunarska E, Birn J.Effect of cathodic polarization and sulfate reducing bacteria on mechanical properties of different steels in synthetic sea water[J]. Mater. Corros., 2007, 58: 413
[34] Lunarska E, Birn J, Dom?alicki P.Hydrogen uptake by structural steels at cathodic protection in sea water inoculated with sulfate reducing bacteria[J]. Mater. Corros., 2007, 58: 13
[35] Wen L J, Gao Z M, Liu Y Y, et al.Effects of applied cathodic potential on susceptibility to hydrogen embrittlement and mechanical properties of Q235 steel[J]. J. Chin. Soc. Corros. Prot., 2013, 33: 271(文丽娟, 高志明, 刘洋洋等. 阴极保护电位对Q235钢氢脆敏感性和力学性能的影响[J]. 中国腐蚀与防护学报, 2013, 33: 271)
[36] De Saravia S G G, De Mele M F L, Videla H A. Scanning electron microscopy study of SRB adherence on cathodically protected stainless steel[J]. Int. Biodeterior. Biodegrad., 1996, 37: 129
[37] Sun C, Xu J, Wang F H, et al.Effects of SRB on cathodic protection of Q235 steel in soils[J]. Mater. Corros., 2010, 61: 762
[38] Li Y.Study on the antibacterial mechanism of cathodic polarization[D]. Dalian: Dalian University of Technology, 2013(李雨. 阴极极化的抑菌机理研究 [D]. 大连: 大连理工大学, 2013)
[39] Morris D R, Sampaleanu L P, Veysey D N.The corrosion of steel by aqueous solutions of hydrogen sulfide[J]. J. Electrochem. Soc., 1980, 127: 1228
[40] Shoesmith D W, Taylor P, Bailey M G, et al.The formation of ferrous monosulfide polymorphs during the corrosion of iron by aqueous hydrogen sulfide at 21 ℃[J]. J. Electrochem. Soc., 1980, 127: 1007
[41] Kondo K, Okamoto A, Hashimoto K, et al.Sulfur-mediated electron shuttling sustains microbial long-distance extracellular electron transfer with the aid of metallic iron sulfides[J]. Langmuir, 2015, 31: 7427
[42] Refait P, Jeannin M, Sabot R, et al.Electrochemical formation and transformation of corrosion products on carbon steel under cathodic protection in seawater[J]. Corros. Sci., 2013, 71: 32
[43] Guan F, Zhai X F, Duan J Z, et al.Influence of sulfate-reducing bacteria on the corrosion behavior of high strength steel EQ70 under cathodic polarization[J]. PLoS One, 2016, 11: e0162315
[44] Sun D J.Study on the inhibition mechanism of biofilm adhesion under cathodic polarization [D]. Dalian: Dalian University of Technology, 2014(孙东菊. 阴极极化对生物膜附着的抑制机制的研究 [D]. 大连: 大连理工大学, 2014)
[45] Esquivel R G, Olivares G Z, Gayosso M J H, et al. Cathodic protection of XL 52 steel under the influence of sulfate reducing bacteria[J]. Mater. Corros., 2011, 62: 61
[46] Chen X, Wang G F, Gao F J, et al.Effects of sulphate-reducing bacteria on crevice corrosion in X70 pipeline steel under disbonded coatings[J]. Corros. Sci., 2015, 101: 1
[47] Li G H, Sun C, Qi W Y, et al.Effects of cathodic protection on corrosion of Q235 steel in SRB containing soils[J]. Corros. Sci. Prot. Technol., 2005, 17: 379(李国华, 孙成, 齐文元等. 含硫酸盐还原菌土壤中阴极保护对Q235钢腐蚀的影响[J]. 腐蚀科学与防护技术, 2005, 17: 379)
[48] Dhar H P, Bockris J O, Lewis D H.Cathodic electrochemical process for preventing or retarding microbial and calcareous fouling[P]. U.S. Pat, 4440611, 1984
[49] Littauer E, Jennings D M.Prevention of marine fouling by electrical currents [A]. Proceedings of the 2nd International Congress on Marine Corrosion and Fouling[C]. Athen, 1968: 527
[50] De Mele M F L. Influence of cathodic protection on the initial stages of bacterial fouling [A]. Proceedings of NSF-CONICET Workshop Biocorrosion, Metal/Microbe Interaction[C]. Mar del Plata, Argentina, 1992: 181
[51] Zhao X D, Duan J Z, Yu L, et al.Influence of cathodic protection potential on corrosion of carbon steel in seamud containing SRB[J]. Dev. Appl. Mater., 2008, 23(3): 43(赵晓栋, 段继周, 于林等. 含有硫酸盐还原菌的海泥中阴极保护电位对碳钢腐蚀的影响[J]. 材料开发与应用, 2008, 23(3): 43)
[52] Pons L, Délia M L, Bergel A.Effect of surface roughness, biofilm coverage and biofilm structure on the electrochemical efficiency of microbial cathodes[J]. Bioresour. Technol., 2011, 102: 2678
[53] Zhao W.The selection and application of electrochemically active microorganisms from marine sediments [D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2011(赵伟. 海洋沉积物中产电微生物筛选及其应用基础研究 [D]. 青岛: 中国科学院研究生院(海洋研究所), 2011)
[54] Yu L, Duan J Z, Du X Q, et al.Accelerated anaerobic corrosion of electroactive sulfate-reducing bacteria by electrochemical impedance spectroscopy and chronoamperometry[J]. Electrochem. Commun., 2013, 26: 101
[55] Yu L.The electro-active characteristics of sulfate-reducing bacteria and its influence on the anaerobic corrosion of carbon steels[D]. Qingdao: Institute of Oceanology,Chinese Academy of Sciences, 2011(于林. 硫酸盐还原菌生物膜电活性及腐蚀机理研究 [D]. 青岛: 中国科学院研究生院(海洋研究所), 2011)
[56] Lovley D R.The microbe electric: Conversion of organic matter to electricity[J]. Curr. Opin. Biotechnol., 2008, 19: 564
[57] Vincent K A, Parkin A, Armstrong F A.Investigating and exploiting the electrocatalytic properties of hydrogenases[J]. Chem. Rev., 2007, 107: 4366
[58] Guezennec J, Therene M.A study of the influence of cathodic protection on the growth of SRB and corrosion in marine sediments by electrochemical techniques [A]. Sequeira C A C, Tiller A K. Microbial Corrosion 1[M]. London: Elsevier Applied Science, 1988: 256
[59] Hernandez G, Hart W H, Videla H A.Marine biofilms and their influence on cathodic protection: A literature survey[J]. Corros. Rev., 1994, 12: 29
[60] Guezennec J.Influence of cathodic protection of mild steel on the growth of sulphate-reducing bacteria at 35 ℃ in marine sediments[J]. Biofouling, 1991, 3: 339
[61] Villano M, De Bonis L, Rossetti S, et al.Bioelectrochemical hydrogen production with hydrogenophilic dechlorinating bacteria as electrocatalytic agents[J]. Bioresour. Technol., 2011, 102: 3193
[62] Geelhoed J S, Stams A J M. Electricity-assisted biological hydrogen production from acetate by Geobacter sulfurreducens[J]. Environ. Sci. Technol., 2011, 45: 815
[63] Parot S, Vandecandelaere I, Cournet A, et al.Catalysis of the electrochemical reduction of oxygen by bacteria isolated from electro-active biofilms formed in seawater[J]. Bioresour. Technol., 2011, 102: 304
[64] Kakooei S, Ismail M C, Ariwahjoedi B.Mechanisms of microbiologically influenced corrosion: A review[J]. World Appl. Sci. J., 2012, 17: 524
[65] Zegeye A, Huguet L, Abdelmoula M, et al.Biogenic hydroxysulfate green rust, a potential electron acceptor for SRB activity[J]. Geochim. Cosmochim. Acta, 2007, 71(22): 5450
[66] Beese-Vasbender P F, Nayak S, Erbe A, et al. Electrochemical characterization of direct electron uptake in electrical microbially influenced corrosion of iron by the lithoautotrophic SRB Desulfopila corrodens strain IS4[J]. Electrochim. Acta, 2015, 167: 321
[67] Xu D K, Gu T Y.Carbon source starvation triggered more aggressive corrosion against carbon steel by the Desulfovibrio vulgaris biofilm[J]. Int. Biodeterior. Biodegrad., 2014, 91: 74
[68] Sherar B W A, Power I M, Keech P G, et al. Characterizing the effect of carbon steel exposure in sulfide containing solutions to microbially induced corrosion[J]. Corros. Sci., 2011, 53: 955
[69] Zhou M H, Wang H Y, Hassett D J, et al.Recent advances in microbial fuel cells (MFCs) and microbial electrolysis cells (MECs) for wastewater treatment, bioenergy and bioproducts[J]. J. Chem. Technol. Biotechnol., 2013, 88: 508
[70] Logan B E, Regan J M.Microbial fuel cells—challenges and applications[J]. Environ. Sci. Technol., 2006, 40: 5172
[71] Wegener G, Krukenberg V, Riedel D, et al.Intercellular wiring enables electron transfer between methanotrophic archaea and bacteria[J]. Nature, 2015, 526: 587
[72] Cordas C M, Guerra L T, Xavier C, et al.Electroactive biofilms of sulphate reducing bacteria[J]. Electrochim. Acta, 2008, 54: 29
[73] Little B J, Wagner P A.The interrelationship between marine biofouling and cathodic protection [A]. Proceedings of NACE Corrosion 1993[C]. Houston, 1993
[74] Venzlaff H, Enning D, Srinivasan J, et al.Accelerated cathodic reaction in microbial corrosion of iron due to direct electron uptake by sulfate-reducing bacteria[J]. Corros. Sci., 2013, 66: 88
[75] Nekoksa G, Gutherman B.Cathodic protection criteria for controlling microbially influenced corrosion in power plants [R]. Palo Alto, CA: EPRI, 1991
[76] Dinh H T, Kuever J, Mu?mann M, et al.Iron corrosion by novel anaerobic microorganisms[J]. Nature, 2004, 427: 829
[77] Lens P, O'flaherty V, Moran A P, et al. Biofilms in Medicine, Industry and Environmental Biotechnology: Characteristics, Analysis and Control [M]. London, UK: IWA Publishing, 2003: 11
[78] Hotter P.Encyclopaedia of Environmental Microbiology[M]. New Delhi: Ivy, 2002
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
相关文章

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414
点击排行
PPT新闻
“海洋金属”——钛合金在舰船的
点击数:7130
腐蚀与“海上丝绸之路”
点击数:5741





