摘要:
采用电化学阻抗谱、开路电位测试和阴极极化曲线,结合扫描电镜成像分析,研究了模拟大气环境不同液膜厚度和交流电场对A6082-T6铝合金腐蚀行为的影响。结果表明:降低液膜厚度加速了铝合金A6082-T6的腐蚀,交流电场显著改变了铝合金局部腐蚀形态,从大量点蚀转变成出现严重的剥蚀。
关键词 : 交流电场, 液膜厚度, 铝合金, 腐蚀行为, 电化学阻抗谱, 微观形貌
铝合金广泛应用于常规工业、航天航空、机械零件等领域,其中A6082-T6铝合金属于Al-Mg-Si系热处理可强化金属合金,具有良好的可成型性,强度高,易于加工,耐蚀性和抗氧化性好等特点[1,2,3]。进入21世纪,我国经济高速发展,电网建设越来越多,金属的用量也大幅增加,其中铝合金在输电网中也有应用。这些大型构件服役于大气环境中,经过风吹日晒、雨水浸蚀、应力和电磁场等作用,加速了其性能退化,容易导致输电网的安全隐患。目前,对铝合金在大气环境下失效行为的研究主要是温度、湿度和大气污染物等因素的影响[4,5,6,7],而输电构件一直服役于电场环境下,一般在500 kV交流电网输电杆塔周围分布的电场强度为10~100 kV/m,电场因素愈加凸显,因此铝合金在交变电场下的腐蚀研究刻不容缓。
在大气环境下,铝合金的环境失效行为以局部腐蚀为主,如孔蚀、晶间腐蚀、剥蚀和缝隙腐蚀等,其中剥蚀是对铝合金有较大危害的一种腐蚀形态[8,9]。许多学者研究了铝合金在NaCl溶液和薄液膜下的腐蚀行为[10,11,12],表明在含有Cl-溶液中,Cl-容易进入铝合金的氧化膜进而诱发铝合金发生晶间腐蚀、剥蚀等局部腐蚀。随着工业的发展,大气中的SO2越来越多。含硫污染物沉积在铝合金表面,会诱发局部腐蚀,其主要腐蚀产物为Al3(SO4)2(OH)5·9H2O,Al2O3以及Al(OH)3。这些腐蚀产物会对铝合金起到一定的保护作用,但是随着SO2的增多,由于其溶解产生H+,导致电解液的pH值下降,腐蚀产物慢慢会溶解,对铝合金的保护能力下降。这些研究表明,铝合金局部腐蚀形态和腐蚀产物对铝合金腐蚀行为,继而对其服役性能具有重要影响。
目前,已经有学者针对外加电场对金属腐蚀行为的影响进行了相关研究[13,14,15,16,17]。Dai等[17]研究了直流电场作用下碳钢在模拟海洋大气环境中的腐蚀行为,结果表明,直流电场加快了碳钢在模拟海洋大气中的腐蚀速率。Huang等[18]研究表明,直流电场对薄液膜下Cu的腐蚀速率有减缓作用。已有报道主要关注直流电场对钢材等腐蚀行为的影响,而鲜有针对铝合金在交流电场作用下的大气腐蚀行为开展研究。针对以上现状,本文设计一套电场加载下大气腐蚀行为实验装置,研究了交流电场对A6082-T6铝合金模拟大气腐蚀行为的影响;结合电化学阻抗谱、阴极极化曲线和形貌分析,探讨了液膜厚度和交流电场强度对A6082-T6铝合金在3.5% (质量分数) NaCl溶液中腐蚀行为的影响机制。
1 实验方法
本实验所用材料为A6082-T6铝合金,化学成分 (质量分数,%) 为:Si 0.7~1.3,Fe 0.50,Cu 0.10,Mn 0.6~1.2,Cr 0.25,Zn 0.20,Ti 0.10,Al余量。
实验前将每个作为工作电极的铝合金样品依次用400~2000#的砂纸进行逐级打磨,接着用1.0 μm金刚石粉末在抛光机上抛光至镜面。因薄液膜厚度的测定以及液膜在工作电极上均匀性和稳定性的要求很高,故打磨电极时要求受力均匀,保持电极表面水平。最后,去离子水清洗,并浸泡在无水乙醇中超声10 min除油后用冷风吹干待用。测试溶液为3.5% (质量分数) NaCl水溶液。在本实验中,采用课题组前期搭建的模拟大气环境中薄液膜装置,控制并测量铝合金表面液膜厚度[19,20]。待工作电极表面形成稳定的预设薄液膜厚度后,测量不同薄液膜厚度下腐蚀不同时间的铝合金电化学阻抗谱。为了实现不同液膜下铝合金大气腐蚀的连续监控,只采用电化学阻抗谱技术研究铝合金在不同液膜厚度下的腐蚀行为。
研究外加交流电场强度对铝合金A6082-T6在不同薄液膜厚度下的腐蚀行为所用装置如图1所示。在课题组原有薄液膜装置的基础上,上下加载两个距离为5 cm的不锈钢板,通过高压电源装置引入不同的交流电压 (1,3和5 kV),从而在工作电极和不锈钢板之间形成不同强度 (20,60和100 kV/m) 的电场。另外,需要特别注意的是底部电极与不锈钢极板需要接地,模拟电网中大型构件接地的环境。由于交变电场的存在 (不管是正在加载,还是停止加载) 会严重干扰电化学阻抗谱的测量,因此外加电场下的铝合金腐蚀电化学测试只针对极化曲线和开路电位,未测试电化学阻抗谱。还需要指出的是,由于外加电场下薄液膜很容易破裂,继而影响电化学测试,因此在外加电场下薄液膜厚度最大只能到150 μm。
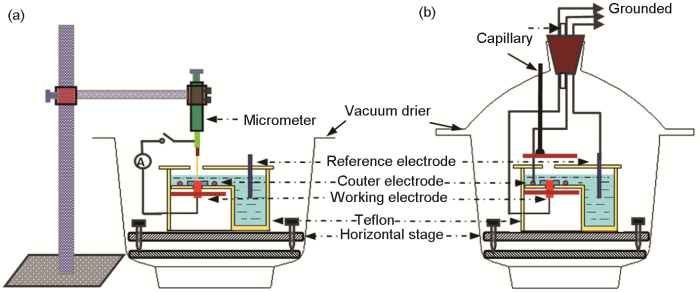
图1 外加交流电场的薄液膜装置示意图
电化学阻抗谱采用VMP2多通道恒电位仪进行测定。测试过程中,外加正弦波的扰动振幅为5 mV,扫描频率范围是105~10-2 Hz。阴极极化曲线和开路电位曲线采用CHI630C电化学工作站进行测定,不同条件下的阴极极化曲线的扫描速率是1 mV/s。由于阳极极化会引起电极的溶解而改变薄液膜厚度以及电流分布,因此研究薄液膜下的腐蚀过程主要采用阴极极化曲线。电化学测试采用三电极系统,其中铝合金A6082-T6为工作电极,大面积Pt丝网为辅助电极,Ag/AgCl (KCl浓度为3 mol/L) 为参比电极。若无特别说明,本文所有电位均相对于该参比电极。腐蚀产物形貌采用SU-8010场发射扫描电镜 (SEM) 观察,通过SEM附带能谱仪 (EDS) 分析元素组成。实验温度25 ℃。
2 结果与讨论
2.1 未加电场下的铝合金腐蚀行为
A6082-T6铝合金在本体溶液和典型液膜厚度下的电化学阻抗谱以及对应拟合结果如图2所示。对照各Nyquist和Bode图可看出,A6082-T6铝合金在本体溶液中,高频区和中频区分别出现一个容抗弧,在低频区出现扩散;液膜厚度较厚 (图中为256 μm,346和160 μm的薄液膜规律类似,图略去) 时,出现两个容抗弧。结合课题组之前的研究结果,认为这两个容抗弧分别对应表面膜和电荷转移电化学过程。液膜厚度减薄至70 μm时,随时间的演化,在腐蚀后期低频区出现感抗。许多合金腐蚀时电化学阻抗谱中都出现了低频区的感抗行为[21,22,23,24],主要原因有两个方面,一是与腐蚀过程中电极表面被吸附物质的弛豫行为有关,二是与局部腐蚀有关。结合电化学阻抗谱数据拟合和表面腐蚀形貌观察结果,认为感抗弧的出现与局部腐蚀的形成有关。图3为铝合金A6082-T6在NaCl本体和薄液膜溶液中电化学阻抗谱拟合所用等效电路[9,21],图3a用于拟合低频无感抗的电化学阻抗谱,图3b用于拟合出现低频感抗的电化学阻抗谱。其中,Rs表示溶液电阻,Rf表示电极表面腐蚀产物膜电阻,Rct表示电荷转移电阻,R表示电感电阻,Zo为有限层扩散阻抗,L表示感抗,CPEsurf和CPEdl分别表示表面腐蚀产物膜电容和双电层电容 (用恒相位角元件CPE表示)。根据等效电路进行拟合得到的Rct和Rct+Rf数据如图4所示。A6082-T6铝合金的初期腐蚀速率是在薄液膜下的较大,在较厚液膜和本体溶液中的较小。这是由于在NaCl溶液中,液膜越薄,O2越容易进入电极/液膜界面,溶解氧越容易供给。但是另一方面,整体数据分布零散,表明腐蚀速率波动严重。随浸泡时间延长,不同液膜厚度下的腐蚀速率差异明显,但是仍然表明在70和90 μm下,A6082-T6铝合金的腐蚀速率最大,而在较厚液膜下的腐蚀速率较小。在本体溶液中的腐蚀速率介于薄液膜与厚液膜下的之间。
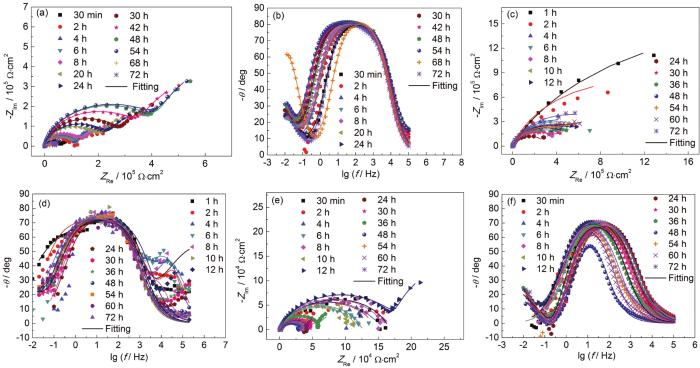
图2 A6082-T6铝合金在本体溶液以及典型薄液膜厚度溶液中浸泡72 h的Nyquist和Bode图
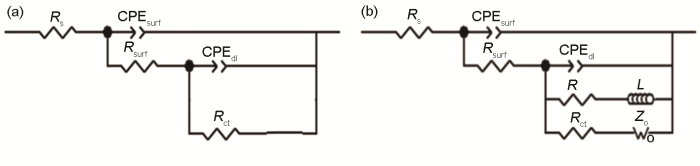
图3 铝合金A6082-T6在3.5%NaCl溶液中电化学阻抗谱拟合用等效电路图
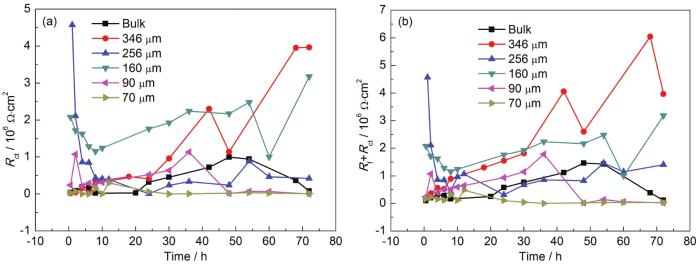
图4 A6082-T6铝合金在含3.5%NaCl不同厚度薄液膜下电化学阻抗谱拟合的Rct及Rf+Rct的变化曲线
2.2 外加电场下的铝合金腐蚀行为
由于外加电场的存在,电化学阻抗谱测试的稳定性与因果性条件很难满足,应用开路电位方法和极化曲线技术测试A6082-T6铝合金在外加电场的薄液膜下的腐蚀行为。外加电场和液膜厚度协同作用下的铝合金A6082-T6开路电位和阴极极化曲线分别如图5和6所示。铝合金在3.5%NaCl本体溶液及不同厚度液膜下浸泡20 min,达到相对稳定电位后测得阴极极化曲线。图5结果表明,薄液膜的厚度对阴极极化曲线的开路电位影响不大,稳定的开路电位约在-0.73~-0.74 V。施加交流电场后,开路电位有一定程度的负移,约在5~10 mV范围,但是与交流电场的强度没有显著关联性。在外加交流电场的作用下,铝合金电极的开路电位发生一定幅度的负移,这是因为在外加电场作用下,液膜中的正电荷会向铝合金/液膜界面迁移,这样电极和溶液界面的双电层电容的电荷密度会增加,促进了阴极的还原反应。结果也表明,交流电场影响电极腐蚀的阴、阳极耦合反应进而影响开路电位的作用机制较为复杂,没有简单的对应关系。图6所示的不同厚度液膜和电场强度下阴极极化曲线均可以分成两个区域:区域I是弱极化区;区域II是在阴极电位下氧的扩散控制区。阴极极化曲线结果也表明,液膜厚度和电场强度对阴极极限电流密度影响较大。A6082-T6铝合金在薄液膜下的电流密度都比在本体溶液中的高,在任何一个电场强度下,随着薄液膜厚度变薄,阴极极限扩散电流密度增加;而在同一个液膜厚度下,电场强度的增加并没有显著改变极限扩散电流密度,表明液膜减薄提高了阴极极限电流密度,从而加速了腐蚀,但电场的存在并没有显著改变腐蚀速率。
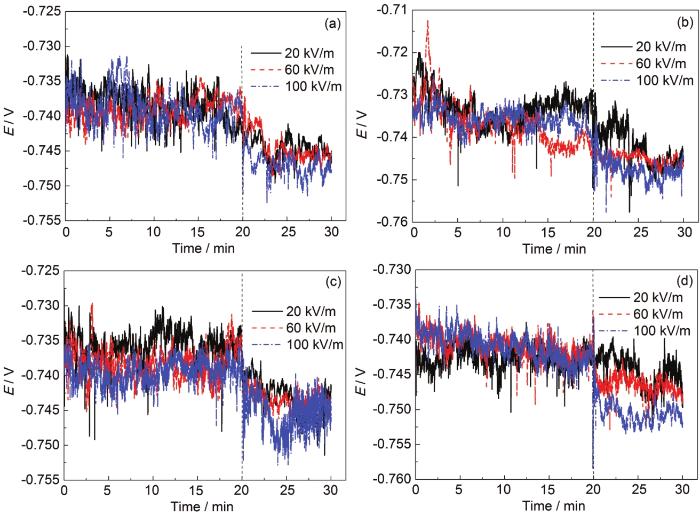
图5 在本体3.5%NaCl溶液及不同厚度薄液膜体系中浸泡20 min后施加不同交流电场对A6082-T6铝合金开路电位的影响
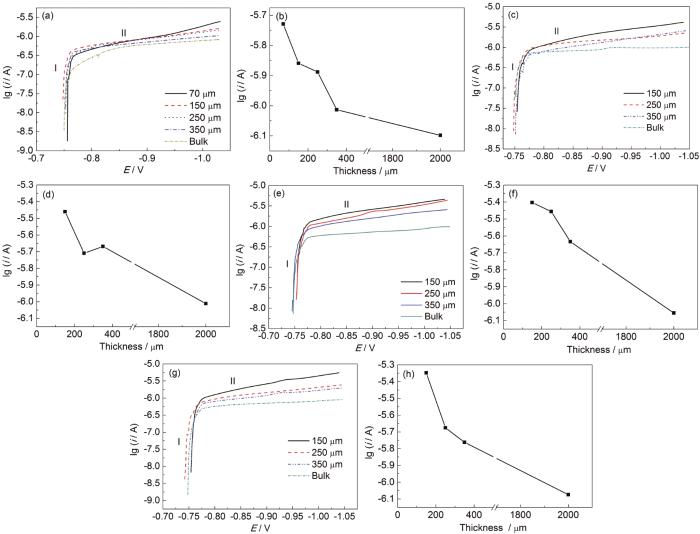
图6 不同交流电场下铝合金在3.5%NaCl本体溶液和不同厚度薄液膜下的阴极极化曲线和-1.0 V极限扩散电流
2.3 微观形貌和组成分析
浸泡72 h后,未加交流电场试样的表面形貌和EDS结果如图7所示。结果表明,A6082-T6铝合金在浸泡72 h后,发生明显的局部腐蚀,在薄液膜厚度为160 μm时,出现了大量的蚀孔和少量剥蚀,点蚀密集且多,蚀孔里布满白色颗粒状的腐蚀产物,EDS测得主要元素包括Si,O和Al,而孔外不包括Si,这也表明铝合金在薄液膜厚度为160 μm时腐蚀速率较快。当薄液膜厚度为90和70 μm时,发生严重的剥蚀和开裂,形成大量片状的腐蚀产物,这可能是电化学阻抗谱低频出现感抗的原因;而腐蚀产物的大量存在表明极薄液膜下腐蚀速率加快,与电化学阻抗谱的测试结果一致。
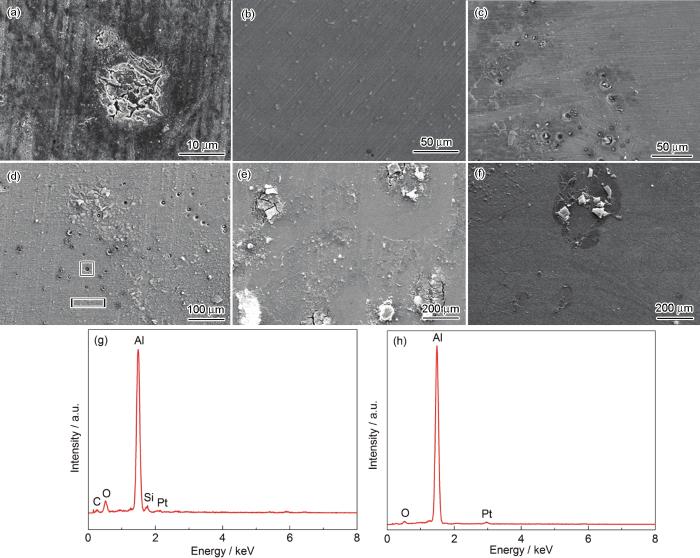
图7 A6082-T6铝合金在3.5%NaCl本体溶液及不同厚度薄液膜下浸泡72 h后的SEM像和薄液膜厚度为160 μm下的EDS结果
A6082-T6铝合金在外加20 kV/m交流电场的3.5%NaCl本体溶液及不同厚度薄液膜下浸泡12 h后的SEM形貌和液膜厚度为250 μm时样品的EDS结果如图8所示。A6082-T6铝合金在外加20 kV/m的交流电场下浸泡12 h后,随着薄液膜厚度变薄,电极表面腐蚀变得更严重;在薄液膜厚度为250 μm时,出现大量的点蚀,蚀孔里布满白色的腐蚀产物,通过EDS测得含有Si的腐蚀产物;在薄液膜厚度为150 μm时,发生轻微的剥蚀,有片状的腐蚀产物。图8所示的形貌与EDS数据与未加电场条件下的图7结果没有显著区别。

图8 A6082-T6铝合金在外加20 kV/m的交流电场下3.5%NaCl本体溶液及不同厚度薄液膜下浸泡12 h后的SEM像和液膜厚度为250 μm时样品的EDS结果
从图9中可以看出,A6082-T6铝合金在外加60 kV/m的交流电场下浸泡12 h后,电极表面发生明显的局部腐蚀。在本体溶液中时,出现少量蚀孔和大量的白色腐蚀产物。随薄液膜厚度变薄,电极表面腐蚀变得越严重,点蚀越多且越大;在薄液膜厚度为150 μm时,在大量点蚀蚀孔附近出现轻微的剥蚀,且表面凸起处产物呈瘤状,EDS分析结果表明腐蚀产物含氧量较之前两种电场强度下的腐蚀产物要高。

图9 A6082-T6铝合金在外加60 kV/m交流电场的3.5%NaCl本体溶液及不同厚度薄液膜下浸泡12 h后的SEM像和液膜厚度为150 μm时样品的EDS结果
如图10所示,A6082-T6铝合金在外加100 kV/m的交流电场下在本体溶液中浸泡12 h后出现大量点蚀,蚀孔中布满大量的白色腐蚀产物;随薄液膜厚度变薄,电极表面腐蚀变得越严重,出现严重的剥蚀,剥蚀附近伴随点蚀。剥蚀是对铝合金有较大危害的一种腐蚀,在薄液膜厚度为250和150 μm时,表面局部区域有严重的剥落。结合图8,9,10可见,外加交流电场显著改变了腐蚀形态以及腐蚀产物分布,但液膜厚度仍是影响腐蚀速率的主要因素。有研究[25]表明,在外加交流电下,金属材料的电极电位会有瞬间的波动,从而引起一种复杂的电流波动,这种波动会破坏金属的钝化,增加孔蚀。在交流电场存在的环境中,溶解氧在薄液膜中的传质加强,加快溶解氧到达铝合金表面的速度,加快了铝合金的腐蚀反应,这是液膜厚度影响腐蚀速率的核心原因。溶解氧的还原反应生成的OH-虽然会受外加电场的影响而发生迁移,并有可能影响腐蚀产物的吸附状态等,但是在本实验中交流电场的作用下,无论是电化学实验结果还是形貌观察结果,均无法表明交流电场显著改变了铝合金A6082-T6的腐蚀速率。

图10 A6082-T6铝合金在外加100 kV/m的交流电场下3.5%NaCl本体溶液及不同厚度薄液膜下浸泡12 h后的SEM像和在本体溶液中浸泡样品的EDS结果
3 结论
(1) 薄液膜厚度是影响A6082-T6铝合金腐蚀速率的主要因素,液膜越薄,腐蚀速率越高;交流电场对在模拟大气环境下的铝合金腐蚀速率有影响,但不显著。
(2) 有交流电场存在时,铝合金的腐蚀形态从出现点蚀到发展成严重剥蚀。因此,工业设计时应充分考虑环境中交流电场对铝合金腐蚀的影响。
参考文献
[1] Trdan U, Grum J. Evaluation of corrosion resistance of AA6082-T651 aluminium alloy after laser shock peening by means of cyclic polarisation and ElS methods [J]. Corros. Sci., 2012, 59: 324
doi: 10.1016/j.corsci.2012.03.019
[2] Panagopoulos C N, Georgiou E P, Gavras A G. Corrosion and wear of 6082 aluminum alloy [J]. Tribol. Int., 2009, 42: 886
doi: 10.1016/j.triboint.2008.12.002
[3] Shang B D, Shi Z M, Wang G, et al. Investigation of quench sensitivity and transformation kinetics during isothermal treatment in 6082 aluminum alloy [J]. Mater. Des., 2011, 32: 3818
doi: 10.1016/j.matdes.2011.03.016
[4] Ralston K D, Fabijanic D, Birbilis N. Effect of grain size on corrosion of high purity aluminium [J]. Electrochim. Acta, 2011, 56: 1729
doi: 10.1016/j.electacta.2010.09.023
[5] Chen S Y, Chen K H, Peng G S, et al. Effect of heat treatment on strength, exfoliation corrosion and electrochemical behavior of 7085 aluminum alloy [J]. Mater. Des., 2012, 35: 93
doi: 10.1016/j.matdes.2011.09.033
[6] Zaid B, Saidi D, Benzaid A, et al. Effects of pH and chloride concentration on pitting corrosion of AA6061 aluminum alloy [J]. Corros. Sci., 2008, 50: 1841
doi: 10.1016/j.corsci.2008.03.006
[7] Szklarska-Smialowska Z. Pitting corrosion of aluminum [J]. Corros. Sci., 1999, 41: 1743
doi: 10.1016/S0010-938X(99)00012-8
[8] Deepa P, Padmalatha R. Corrosion behaviour of 6063 aluminium alloy in acidic and in alkaline media [J]. Arab. J. Chem., 2017, 10 (Suppl.2): S2234
doi: 10.1016/j.arabjc.2013.07.059
[9] Tian W M, Li S M, Wang B, et alPitting corrosion of naturally aged AA 7075 aluminum alloys with bimodal grain size [J]. Corros. Sci., 2016, 113: 1
[10] Cao M, Liu L, Yu Z F, et al. Electrochemical corrosion behavior of 2A02 Al alloy under an accelerated simulation marine atmospheric environment [J]. J. Mater. Sci. Technol., 2019, 35: 651
doi: 10.1016/j.jmst.2018.09.060
[11] Qu Q, Yan C W, Wan W, et al. Effects of NaCl and SO2 on the initial atmospheric corrosion of zinc [J]. Corros. Sci., 2002, 44: 2789
doi: 10.1016/S0010-938X(02)00076-8
[12] ?ekularac G, Milo?ev I. Corrosion of aluminium alloy AlSi7Mg0.3 in artificial sea water with added sodium sulphide [J]. Corros. Sci., 2018, 144: 54
doi: 10.1016/j.corsci.2018.08.038
[13] Tan T, Chen T, Zhang J X, et al. Corrosion behavior of galvanized steel in different simulated service environments [J]. Corros. Prot., 2014, 35: 307
[13] (谈天, 陈彤, 张俊喜等. 镀锌钢在模拟不同服役环境中的腐蚀行为 [J]. 腐蚀与防护, 2014, 35: 307)
[14] Huang H L, Tian J, Zhang G A. Atmospheric corrosion behavior of tin under an alternating current electric field [J]. J. Electr. Mater., 2017, 46: 4359
doi: 10.1007/s11664-017-5395-y
[15] Luo X, Li X Q, Dong C L. Effect of corrosion products on corrosion process of 6061 aluminium alloy in marine atmosphere [J]. Corros. Prot., 2018, 39: 587
[15] (罗雪, 李小强, 董重里. 腐蚀产物对6061铝合金海洋大气腐蚀过程的影响 [J]. 腐蚀与防护, 2018, 39: 587)
[16] Zhang X, Dai N W, Yang Y, et al. Effect of direct current electric field on corrosion mechanism of Zn exposed to simulated industrial environment [J]. J. Chin. Soc. Corros. Prot., 2017, 37: 451
[16] (张鑫, 戴念维, 杨燕等. 模拟工业环境下直流电场对金属Zn腐蚀机理的影响 [J]. 中国腐蚀与防护学报, 2017, 37: 451)
doi: 10.11902/1005.4537.2017.159
[17] Dai N W, Zhang J X, Chen Q M, et al. Effect of the direct current electric field on the initial corrosion of steel in simulated industrial atmospheric environment [J]. Corros. Sci., 2015, 99: 295
doi: 10.1016/j.corsci.2015.07.029
[18] Huang H L, Guo X P, Zhang G A, et al. Effect of direct current electric field on atmospheric corrosion behavior of copper under thin electrolyte layer [J]. Corros. Sci., 2011, 53: 3446
doi: 10.1016/j.corsci.2011.04.017
[19] Cheng Y L, Zhang Z, Cao F H, et al. A study of the corrosion of aluminum alloy 2024-T3 under thin electrolyte layers [J]. Corros. Sci., 2004, 46: 1649
doi: 10.1016/j.corsci.2003.10.005
[20] Liu W J, Cao F H, Chen A N, et al. Corrosion behaviour of AM60 magnesium alloys containing Ce or La under thin electrolyte layers. Part 1: Microstructural characterization and electrochemical behaviour [J]. Corros. Sci., 2010, 52: 627
doi: 10.1016/j.corsci.2009.10.031
[21] Arenas M A, De Damborenea J. Interference by cerium cations during the multi-step zinc dissolution process in a chloride-containing electrolyte [J]. Corros. Sci., 2006, 48: 3196
doi: 10.1016/j.corsci.2005.10.015
[22] Nguyen T H, Foley R T. The chemical nature of aluminum corrosion: II. The initial dissolution step [J]. J. Electrochem. Soc., 1982, 129: 27
doi: 10.1149/1.2123768
[23] Hu G Y, Chen S Y, Jiang H L, et al. Effect of RE Ce on microstructure and properties of 7A52 aluminum alloy [J]. Chin. J. Nonferrous Met., 2016, 26: 1372
[23] (胡桂云, 陈送义, 姜慧丽等. 稀土Ce对7A52铝合金组织与性能的影响 [J]. 中国有色金属学报, 2016, 26: 1372)
[24] Li J F, Zhang Z, Cao F H, et al. Exfoliation corrosion and electrochemical impedance behavior of LC4 alloy [J]. Chin. J. Nonferrous Met., 2002, 12: 1189
[24] (李劲风, 张昭, 曹发和等. LC4铝合金剥蚀及其电化学阻抗行为 [J]. 中国有色金属学报, 2002, 12: 1189)
[25] Cao C N. Principle of Electrochemistry of Corrosion [M]. Beijing: Chemical Industry Press, 2008: 158
[25] (曹楚南. 腐蚀电化学原理 [M]. 北京: 化学工业出版社, 2008: 158)
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





