摘要
针对3A21铝合金在乙二醇冷却液中的腐蚀问题,采用浸泡实验和表面分析技术系统研究了痕量Cl-和Cu2+对3A21铝合金在50 ℃乙二醇-水冷却液中腐蚀行为的影响。结果表明,Cl-引发了铝合金的点腐蚀,随着Cl-浓度增大,铝合金点蚀敏感性增大。Cu2+促进铝合金钝化膜的破裂,并与Al发生置换反应沉积在铝合金表面,电偶作用加速了铝合金的腐蚀。Cl-和Cu2+共存时,钝化膜破裂和电偶作用导致铝合金腐蚀加剧。
关键词: 3A21铝合金 ; 乙二醇 ; 痕量离子 ; 点蚀
乙二醇型冷却液广泛应用于交通、能源、仪表、无线通讯等工业领域铝合金设备的冷却。在使用中,铝合金的腐蚀造成流道穿孔和堵塞等问题[1,2],严重影响设备的正常工作。
铝合金在水介质中的腐蚀主要表现为点蚀[3-6],但铝合金在乙二醇冷却液中的腐蚀缺乏系统的研究。铝合金在乙二醇冷却液中的腐蚀除受本身影响外[7,8],其腐蚀行为更依赖于离子种类及浓度[9-13]。通常,水质原因造成Cl-污染,铜材腐蚀导致Cu2+污染[14-16]。对于高功率雷达冷却器,离子浓度低至mg/L级,研究痕量离子对铝合金腐蚀行为的影响对预测设备寿命及冷却液的运维具有重要意义。
本文系统研究了痕量Cl-和Cu2+对3A21铝合金腐蚀行为的影响,确定影响铝合金腐蚀的关键因素,为乙二醇型冷却液的使用和维护提供一定的参考。
1 实验方法
实验材料为厚度为3 mm的3A21铝合金板材,其化学成分 (质量分数,%) 为:Mn 1.13,Fe 0.50,Si 0.32,Cu 0.06,Zn 0.05,Mg 0.02,Ti 0.01,Al余量。
采用线切割将3A21铝合金板材切割成20 mm×20 mm试样,用耐水砂纸逐级打磨至800#后,再用丙酮和乙醇混合液超声波清洗10 min,取出并用冷风吹干后放在干燥器中待用。
冰点为-45 ℃的冷却液由分析纯乙二醇和去离子水按57∶43的体积比配制而成。冷却液中的痕量污染物Cl-和Cu2+分别由分析纯NaCl和CuSO4·5H2O配制。首先分别称取1.65 g NaCl和3.93 g CuSO4·5H2O,配制Cl-和Cu2+浓度均为1000 mg/L的溶液,然后分别量取10,20,50和100 mL溶液并稀释至1000 mL,即制得Cl-和Cu2+浓度为10,20,50和100 mg/L的溶液。
将预处理后的3A21铝合金样品放入预加热到 (50±2) ℃的冷却液中,浸泡385 h后将样品取出并用去离子水冲洗干净,冷风吹干。按下式计算腐蚀速度。测试采用3片平行样品。

式中:v为腐蚀速度,mg/cm2,mt为浸泡后试样质量,g,m0为浸泡前试样质量,g,S为试样总表面积,cm2。
采用FEI INSPECT F 50扫描电镜 (SEM) 和OXFORD X-Max X射线能谱仪 (EDS) 研究铝合金腐蚀后的微观形貌和成分,采用PANalytical X' Pert PRO X射线衍射仪 (XRD) 分析铝合金的腐蚀产物。
2 结果与讨论
2.1 3A21铝合金腐蚀形貌
2.1.1 Cl-的影响
图1是3A21铝合金在50 ℃含不同浓度Cl-的乙二醇-水冷却液中腐蚀后的SEM形貌。铝合金在乙二醇-水冷却液中腐蚀后 (图1a),表面没有出现明显的腐蚀产物,EDS定性分析检测到Al、O和C及少量的Mn,表明铝合金在乙二醇-水冷却液中生成了Al的氧化物或氢氧化物,与铝合金在水溶液中的情况类似[17],并伴随乙二醇的吸附[18],或与Al反应形成稳定的醇化铝膜[19]。

图1 3A21铝合金在含Cl-的冷却液中腐蚀后的微观SEM形貌
当冷却液中含有10 mg/L Cl-时,绝大部分铝合金表面保持完好 (图1b),但存在少量腐蚀点 (图1c),表明Cl-引发了铝合金的点蚀。白色腐蚀产物主要由Al、O、C构成,并含有少量的Fe、Mn、Si和Zn。XRD分析表明3A21铝合金主要由α-Al基体和Al6Mn第二相构成 (图2),铝合金的腐蚀起源于第二相,第二相Al6Mn的电位高于基体α-Al的电位[20],基体优先腐蚀造成第二相沉积。当冷却液中Cl-浓度进一步增大为20 mg/L时,腐蚀产物数量明显增多、尺寸增大 (图1d),表明铝合金的腐蚀更严重,白色的腐蚀产物元素构成没有发生变化。当冷却液中的Cl-浓度达到50和100 mg/L时,腐蚀形态没有发生显著改变,但腐蚀产物数量更多、尺寸更大,腐蚀进一步加剧 (图1e和f)。
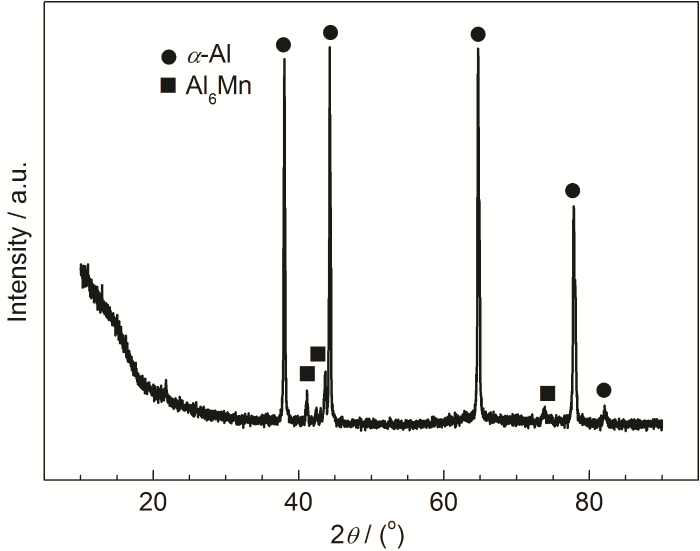
图2 3A21铝合金XRD谱
2.1.2 Cu2+的影响
图3是3A21铝合金在50 ℃含不同浓度Cu2+的乙二醇-水冷却液中腐蚀后的SEM形貌。当冷却液中含有10 mg/L Cu2+时,铝合金表面膜破裂 (图3a),EDS结果表明腐蚀产物主要由Al、O和C构成,并检测到Si、Mn和Cu,Si和Mn来源于铝合金基体。Cu的出现表明Cu2+与Al发生置换反应,腐蚀产物中Cu的含量约为1% (质量分数)。当冷却液中Cu2+浓度为20 mg/L时,铝合金发生局部腐蚀 (图3b),在未发生局部腐蚀区域 (图3c),铝合金表面沉积了数量众多、尺寸较大的金属Cu颗粒,并夹杂大量细小、絮状腐蚀产物。当冷却液中Cu2+浓度为50 mg/L时,铝合金同样发生局部腐蚀,腐蚀产物存在大量裂纹 (图3d),并伴随更大尺寸Cu颗粒的沉积 (图3e)。当冷却液中的Cu2+浓度为100 mg/L时,铝合金发生严重局部腐蚀 (图3f),并沉积更多金属Cu颗粒 (图3g)。

图3 3A21铝合金在含Cu2+的冷却液中腐蚀后的微观SEM形貌
2.1.3 Cl-和Cu2+的影响
图4是3A21铝合金在同时含Cl-和10 mg/L Cu2+的冷却液中腐蚀后的SEM形貌。铝合金在所有溶液中均发生严重的点蚀,点蚀周围的氧化膜破裂,腐蚀坑边缘堆积了大量的腐蚀产物,随Cl-浓度增大,腐蚀产物逐渐由颗粒状转变为絮状,当Cl-浓度高于50 mg/L时尤为明显,表明铝合金的腐蚀加剧。EDS分析表明,腐蚀坑边缘的腐蚀产物中Cu的质量分数约为0.5%~6%,沉积Cu的部位Cu含量超过60%,表明发生了严重的金属Cu沉积。

图4 3A21铝合金在含Cl-和10 mg/L Cu2+的冷却液中腐蚀后的微观SEM形貌
2.2 3A21铝合金重量变化
图5a是3A21铝合金在50 ℃含Cl-和Cu2+的冷却液中腐蚀385 h后的重量变化。当冷却液中只含有Cl-时,3A21铝合金表现为增重,随Cl-浓度的增大增重量增大 (图5b)。在含Cu2+的冷却液中表现为增重,随Cu2+浓度的增加,增重量增大,但到高浓度时重量变化较稳定。铝合金在含Cu2+的冷却液中腐蚀增重大于在只含Cl-的冷却液中的增重源于溶液中Cu2+与Al发生置换反应生成金属Cu沉积在铝合金表面,如图6中XRD所示,在含Cu2+的冷却液中腐蚀后检测到金属Cu。Cu2+浓度越大,反应生成的Cu越多,故增重越多。3A21铝合金在同时含不同浓度Cl-和10 mg/L Cu2+的冷却液中同样表现为增重,当Cl-的浓度小于20 mg/L时,铝合金的增重随Cl-浓度的增大而增大,而后降低,是由于铝合金发生更严重的腐蚀溶解造成的。相比于在只含Cu2+的冷却液中,铝合金在含Cl-和Cu2+的冷却液中腐蚀增重较少,一方面是由于溶液的腐蚀性增强,形成的腐蚀产物溶于溶液造成的。另一方面是由于溶液中Cu2+浓度低 (10 mg/L) 造成沉积的金属Cu较少。相比于在只含10 mg/L Cu2+溶液中,当溶液同时含有10 mg/L Cl-时,铝合金的增重量明显增大,表明Cl-首先破坏铝合金表面钝化膜,暴露更多的新鲜表面,加剧了Al与Cu2+之间的置换反应,导致增重量增大。3A21铝合金的增重一部分源于溶液中Cu2+与铝发生置换反应生成金属Cu的沉积,另一部分来源于铝合金的腐蚀而生成的粘附的铝氧化物或氢氧化物 (铝合金在不含离子的乙二醇-水溶液中表现为增重)。
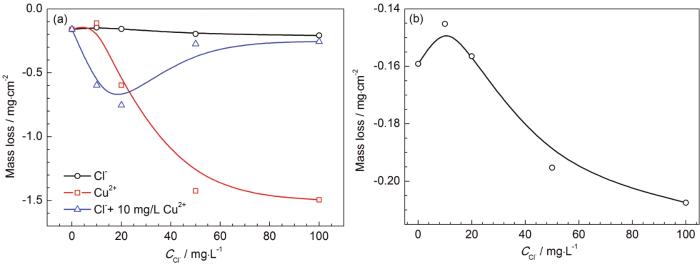
图5 3A21铝合金腐蚀质量变化
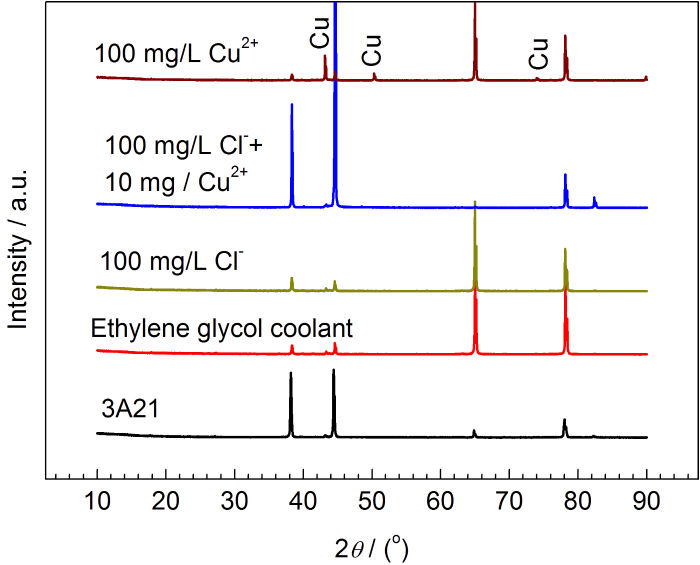
图6 3A21铝合金腐蚀产物XRD谱
2.3 3A21铝合金腐蚀机理
以上研究结果表明,Cl-引发3A21铝合金的点腐蚀,Cu2+促进铝合金钝化膜破裂,而在含Cl-和Cu2+的冷却液中发生严重的点蚀,铝合金的腐蚀更严重。
铝合金在中性水溶液和非水溶液中常发生点蚀[19,21],通常以方程式 (2) 和 (3) 发生Al的阳极溶解和阴极氧还原反应。

在含Cl-介质中,根据点蚀形成和生长机制[22],Cl-优先于O2吸附于铝合金表面,导致钝化膜破坏。Cl-的吸附降低了铝合金表面O2的吸附,导致铝合金钝化膜不能修复。
在含Cl-介质中,铝合金的阳极反应以方程式 (4)~(6) 进行[23]。
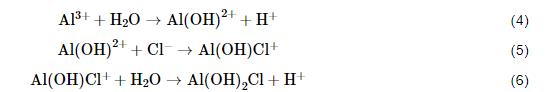
随着Cl-浓度增大,反应 (5) 加快,造成中间反应产物Al(OH)2+不断消耗,根据质量作用定律反应 (4) 和 (6) 速度加快,致使铝合金的阳极反应加速、钝化膜溶解,最终形成点蚀。
Cu2+对3A21铝合金加速腐蚀作用一方面由于Cu2+以方程式 (7) 发生水解反应,造成局部酸性环境,促进了铝合金表面钝化膜的溶解以及Al的腐蚀,如方程式 (8) 和 (9) 所示。Cu2+浓度越大,水解作用越强,H+浓度越大,pH值越低,铝合金氧化膜和铝基体溶解加快。
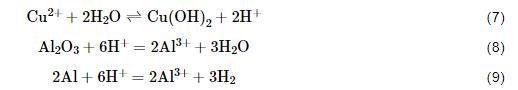
XRD结果表明,腐蚀后铝合金表面存在金属Cu,表明Cu2+与Al发生了置换反应,如方程式 (10) 所示,由于Cu的电极电位远远高于Al的电极电位[24],二者之间的巨大电位差引起的电偶作用加速了铝合金的腐蚀,在沉积Cu颗粒部位形成点蚀,Cu2+的浓度越大,沉积的金属Cu越多,腐蚀越显著。

当Cl-和Cu2+在冷却液中共存时,Cl-破坏铝合金表面钝化膜导致更多新鲜表面暴露于溶液中,Cu2+与Al发生反应的几率增大,造成铝合金加速腐蚀。加之Cu2+本身即可造成铝合金表面钝化膜破裂,因此,在Cl-和Cu2+共存时,铝合金的腐蚀尤为严重。
3 结论
(1) Cl-的浓度越大,3A21铝合金的点敏感性越大,腐蚀越严重。
(2) 铝合金在只含痕量Cu2+的冷却液中,Cu2+破坏了铝合金表面钝化膜,并与Al发生置换反应生成金属Cu沉积在铝合金表面,Cu与铝之间的电偶作用加速了铝合金的腐蚀。
(3) 当Cl-和Cu2+共存时,即使二者的浓度低至10 mg/L,由于铝合金钝化膜的破裂协同Cu-Al电偶作用,促进了铝合金点蚀的发生和发展,大大加速了铝合金的腐蚀。
参考文献
1 Wang C, Yao Y, Zhong J F. Research survey of corrosion resistance techniques for aluminum alloy flow channel [J]. Electro-Mech. Eng., 2014, 30(2): 1
1 王超, 姚晔, 钟剑锋. 铝合金流道防腐蚀技术研究概况 [J]. 电子机械工程, 2014, 30(2): 1
2 Zhao T L, Zhang L J, Qian J Y, et al. Corrosion behavior of Al-alloys 3A21, 5A05 and 6063 in low-conductive ethylene glycol coolant [J]. Corros. Sci. Prot. Technol., 2017, 29: 507
2 赵天亮, 张梁娟, 钱吉裕等. 3A21、5A05和6063铝合金在低电导率乙二醇冷却液中的腐蚀行为 [J]. 腐蚀科学与防护技术, 2017, 29: 507
3 Alodan M A, Smyrl W H. Detection of localized corrosion of aluminum alloys using fluorescence microscopy [J]. J. Electrochem. Soc., 1998, 145: 1571
4 Fole R T. Localized corrosion of aluminum alloys-a review [J]. Corrosion, 1986, 42: 277
5 Lenderink H J W, Linden M V D, De Wit J H W. Corrosion of aluminium in acidic and neutral solutions [J]. Electrochim. Acta, 1993, 38: 1989
6 Davoodi A, Pan J, Leygraf C, et al. In situ investigation of localized corrosion of aluminum alloys in chloride solution using integrated EC-AFM/SECM techniques [J]. Electrochem. Solid State Lett., 2005, 8: B21
7 Fan J L, Gong M, Hou X, et al. Corrosion behavior of 3A21 aluminum alloy in ethylene glycol-water solution [J]. Corros. Prot., 2014, 35: 1116
7 范金龙, 龚敏, 侯肖等. 3A21铝合金在乙二醇水溶液中的腐蚀行为 [J]. 腐蚀与防护, 2014, 35: 1116
8 Hu G G, Yang J, Zheng X W. Corrosion behavior of aluminum cold plate in ethylene glycol coolant [J]. Corros. Prot., 2017, 38: 871
8 胡国高, 杨俊, 郑兴文. 铝制冷板在乙二醇冷却液中的腐蚀行为 [J]. 腐蚀与防护, 2017, 38: 871
9 Mazhar A A, Arab S T, Noor E A. Electrochemical behaviour of Al-Si alloys in acid and alkaline media [J]. Bull. Electrochem., 2001, 17: 449
10 Liu D Q, He X, Guo X L, et al. Research progress of corrosion of aluminum alloys in ethylene glycol solution [J]. Hot-Work. Technol., 2019, 48(2): 36
10 刘德庆, 何潇, 郭新良等. 铝合金在乙二醇溶液中的腐蚀研究进展 [J]. 热加工工艺, 2019, 48(2): 36
11 Chen X, Tian W M, Li S M, et al. Effect of chloride ion and temperature on corrosion of aluminum alloy in coolant [J]. J. Beijing Univ. Aeronaut. Astronaut., 2016, 42: 2243
11 陈鑫, 田文明, 李松梅等. 氯离子和温度对铝合金在冷却液中腐蚀的影响 [J]. 北京航空航天大学学报, 2016, 42: 2243
12 Gao S L, Yu M, Liu J H, et al. Effects of cupric ions on the corrosion behavior of aluminum alloy 5A02 in ethylene glycol-water solution [J]. Int. J. Min. Met. Mater., 2017, 24: 423
13 Abiola O K, Otaigbe J O E. Effect of common water contaminants on the corrosion of aluminium alloys in ethylene glycol-water solution [J]. Corros. Sci., 2008, 50: 242
14 May P M, Ritchie I M, Tan E T. The corrosion of copper in ethylene glycol-water mixtures containing chloride ions [J]. J. Appl. Electrochem., 1991, 21: 358
15 Samiento-Bustos E, Rodriguez J G G, Uruchurtu J, et al. Effect of inorganic inhibitors on the corrosion behavior of 1018 carbon steel in the LiBr+ethylene glycol + H2O mixture [J]. Corros. Sci., 2008, 50: 2296
16 Danaee I, Khomami M N, Attar A A. Corrosion of AISI 4130 steel alloy under hydrodynamic condition in ethylene glycol+Water+NO2- solution [J]. J. Mater. Sci. Technol., 2013, 29: 89
17 Wang B, Zhang L W, Su Y, et al. Investigation on the corrosion behavior of aluminum alloys 3A21 and 7A09 in chloride aqueous solution [J]. Mater. Des., 2013, 50: 15
18 Bazeleva N A, Herasymenko Y S. Corrosion-electrochemical behavior of aluminum alloys in aqueous ethylene glycol media [J]. Mater. Sci., 2007, 43: 851
19 Zhang G A, Xu L Y, Cheng Y F. Mechanistic aspects of electrochemical corrosion of aluminum alloy in ethylene glycol-water solution [J]. Electrochim. Acta, 2008, 53: 8245
20 Hung Y C, Zhu H Y, Xiao Z B. Effects of aging processes on microstructure, specific capacitance and surfacial corrosion morphology of 3003 aluminum alloy cathode foil [J]. Mater. Mech. Eng., 2013, 37(1): 25
20 黄元春, 朱弘源, 肖政兵. 时效工艺对3003铝合金阴极箔组织、比电容和表面腐蚀形貌的影响 [J]. 机械工程材料, 2013, 37(1): 25
21 El-Etre A Y. Inhibition of aluminum corrosion using Opuntia extract [J]. Corros. Sci., 2003, 45: 2485
22 Badawy W A, Al-Kharafi F M, El-Azab A S. Electrochemical behaviour and corrosion inhibition of Al, Al-6061 and Al-Cu in neutral aqueous solutions [J]. Corros. Sci., 1999, 41: 709
23 Szklarska-Smialowska Z. Pitting corrosion of aluminum [J]. Corros. Sci., 1999, 41: 1743
24 Cao C N. Principles of Electrochemistry of Corrosion [M]. 3rd Ed. Beijing: Chemical Industry Press, 2008
24 曹楚南. 腐蚀电化学原理 [M]. 第3版. 北京: 化学工业出版社, 2008
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





