摘要
利用充放电电容法、接触角测量法和电化学阻抗法研究了正十六硫醇在Ag镀层表面的自组装行为。在浓度为10和100 μmol·L-1条件下,由充放电电容法得到吸附速率常数分别为 (1.3±0.2)×106和 (2.8±0.5)×104 mol-1·L·s-1,由接触角方法得到的吸附速率常数分别为 (9.3±0.7)×105和 (3.4±0.6)×104 mol-1·L·s-1,两种方法得到的结果一致。同时,结果也表明低浓度的硫醇分子有更高的吸附速率常数。Tafel极化曲线表明,经5 mmol·L-1的正十六硫醇溶液浸泡15 min后,Ag镀件在阴极和阳极区域的电流密度显著降低,缓蚀率可达98.6%。80 °C下烘烤12 h实验、Na2S溶液腐蚀实验以及H2S气体腐蚀实验的结果进一步证实上述保护工艺既符合生产操作要求,又可以获得显著的耐蚀效果。
关键词: 十六硫醇; 自组装; 电银镀; 腐蚀
自组装单分子膜 (SAMs)[1]是利用自组装分子的头基与基底的强化学吸附作用,分子尾链间van der Waals力相互作用而形成的排列致密有序的单层分子组装体。其制备简单、性能优越,在材料防腐蚀上应用前景广阔[2]。电化学镀银是电子元器件、印刷线路板等工业领域[3]和家庭用具、工艺品等装饰[4]应用中的重要基础工艺。银镀层在使用过程中,由于自身化学性质和高温、潮湿、含硫气体等外部因素的影响,易于变色、腐蚀,故其防护要求较高。此外,银镀层的保护一般还要求不影响镀层的可焊接性和导电性[5],所以保护层不仅要有优良的抗腐蚀功能,又要足够的薄。探索自组装膜技术在镀银保护剂领域的应用具有重要意义。
生产实践中,保护剂浸泡为镀银的后一道工序,其浸泡时间需要与流水线运行的节奏匹配,因此处理时间不宜过长。自组装动力学研究是确定保护剂浓度、处理时间、操作条件的基础。自组装动力学的研究方法成熟,研究体系也较为完善。自组装分子在Au表面的组装动力学研究最为广泛。Ulman[5]对烷基硫醇在Au表面组装成膜的动力学过程进行了深入研究,认为成膜过程为两步:第一步是由扩散控制的快速吸附过程,由烷基硫醇的浓度所决定;第二步为表面结晶过程,硫醇分子发生由无序到有序的慢速重排过程。本课题组[6]研究了偶氮苯衍生物在Au表面的组装动力学,通过循环伏安曲线提出了组装过程的动态模型,并通过接触角测定和电化学数据求得了自组装过程的动力学参数。此外,烷基硫醇在Fe[7]、Cu[8]等金属表面的自组装研究也有报道。
烷基硫醇在Ag面的组装研究较少,已有工作主要基于烷基硫醇对于Ag制品的保护研究。Evesque等[9]将脱脂后的Ag样品经过稀硫酸活化,在30 ℃条件下,于0.15 mol·L-1的正十六烷基硫醇异丙醇溶液中组装1 h,在含有Na2S和NaCl的混合溶液中浸泡后仍保持原有的金属光泽,表现出较好的保护效果。鲁文晔等[10]提供了一种在Ag表面成膜的优化工艺条件,在60 ℃和0.1 mol·L-1的十六硫醇乙醇溶液中组装2 h后,其覆盖率和缓蚀率分别可达到94.8%和95.9%。但此工艺成膜时间过长,难以在生产中,特别是自动线上应用。同时温度过高,会产生大量的有机挥发物,对环境产生影响。Liang等[11]将银制品经丙酮脱脂、硫酸活化后,在含有十八烷基硫醇、十六烷基三甲基溴化铵、Triton X-100和月桂醇聚氧乙烯醚的胶束水溶液中,于60 ℃条件下浸泡5 min,保护效率可以达到91.9%,这对于银镀件保护剂配方的开发和优化具有很好的参考价值。上述研究虽充分表明烷基硫醇分子在Ag表面的组装可以有效地起到保护作用,但是组装动力学的信息还不丰富。
鉴于镀银保护在电子电镀等领域的重要意义,为了开发和优化以烷基硫醇为基础的保护剂,本文利用双电层电容法、接触角测量法和电化学阻抗对银镀件表面烷基硫醇的组装动力学开展系统研究,获得组装速率常数。参考生产实践,确定了主体成分的合理浓度和浸泡处理时间,并对此条件处理的样品开展了高温烘烤、Na2S溶液和H2S气体腐蚀等相关实验。
1 实验方法
1.1 试剂
ZHL-02无氰镀银母液 (嘉兴锐泽表面技术有限公司) 稀释一倍配制成工作液,其它试剂均为分析纯。实验用水为一次去离子水。
1.2 溶液配制
配制C16H33SH的乙醇溶液,浓度分别为1,10,100和1000 μmol·L-1。电化学实验的电解液分别为0.15 mol·L-1的KNO3溶液和3.5% (质量分数) NaCl溶液。所用溶液均现配现用。
1.3 镀银样品的制备与保护
以15 mm×15 mm的紫铜片为电镀基底,经过超声清洗、化学除油、电化学除油、强酸浸蚀和弱酸活化处理后,阴极带电入槽,以1.0 A·dm-2的电流密度恒流电镀5 min。电镀结束后,水洗,浸入给定浓度的C16H33SH乙醇溶液中进行自组装。
1.4 电化学性能测试
电化学实验采用DH7001电化学工作站,以其自带软件进行数据采集,利用Origin 8.0进行数据处理。采用三电极体系,工作电极为组装成膜前后的镀银铜片,参比电极为饱和甘汞电极,辅助电极为Pt片。实验在 (20±2) °C进行测量。循环伏安曲线测试采用的电解质溶液为0.15 mol·L-1的KNO3溶液,测试范围为-0.03~0.03 V,扫描速率为5 mV·s-1。电化学阻抗实验采用的电解质溶液为0.15 mol·L-1的KNO3溶液,频率范围为105~10-2 Hz,振幅为5 mV。Tafel极化曲线测试采用3.5% (质量分数) NaCl溶液,测试电位范围-0.25~0.10 V,扫描速率为1 mV·s-1。
1.5 接触角测试
接触角测量采用JJC-Ⅱ型接触角测定仪,每个样品选择5个不同点进行测量,取均值。
1.6 高温烘烤、Na2S和H2S腐蚀实验
以15 mm×15 mm的紫铜片为电镀基底,经过前处理后以1.0 A·dm-2的电流密度恒流电镀5 min,作为验证实验样品。
将银镀件分别于室温下在3个高浓度的C16H33SH溶液中浸泡15 min后,在大气环境中迅速将保护前后的银镀件放入烘箱中,在80 ℃下烘烤12 h,观察镀件表面状况。
将浸泡过硫醇溶液的银镀件在0.1 mol·L-1的Na2S溶液中浸泡不同时间,观察其表面腐蚀情况,并利用VHX-900F超景深三维显微镜观察腐蚀表面的微观形貌。
H2S腐蚀实验按照JEIDA-39标准进行[12]。称取120 g的Na2S·9H2O溶解于300 mL去离子水中,再称取14.0 g的KH2PO4溶解于200 mL水中,将两种溶液先后加入到14 L密闭容器中混合,迅速加盖密封,维持温度在 (40±2) ℃,将样片用线悬挂于溶液上方同一高度,1 h后取出观察。
2 结果与讨论
2.1 组装动力学研究
直链的烷基硫醇分子在Ag表面的吸附动力学研究对开发以其为主要成份的镀银保护剂至关重要。吸附动力学研究可以通过表征硫醇在银镀层表面的覆盖度来实现。尽管有很多宏观和微观的方法可用于表征硫醇在银镀层表面的覆盖度,但考虑到银镀层的化学活性以及实验操作的便利性和理论处理的可靠性,电极的双电层充放电电容法[13]和接触角测量法[14]是最为可行的两种宏观追踪表面覆盖度的技术。
银电极与电解质溶液接触形成双电层,当硫醇分子吸附后,双电层的厚度和介电常数发生变化,从而使其电容值相应改变。图1a给出了银镀件样品在100 μmol·L-1的C16H33SH溶液中浸泡不同时间后在0.15 mol·L-1的KNO3支持电解质溶液中的循环伏安图。由于特性吸附离子的存在,未覆盖硫醇电极的充放电电流大于其它样品。在电势扫描的开始阶段,电流有一个指数形式的上升,其上升的快慢所对应的时间常数反映了电极界面电容和电阻乘积的大小。随着电势扫描的继续,电流保持在相对稳定的阶段,上下两条电流曲线分别对应充电与放电。从图1a可以看出,随着在硫醇溶液中浸泡时间的延长,充放电电流曲线逐渐变窄。
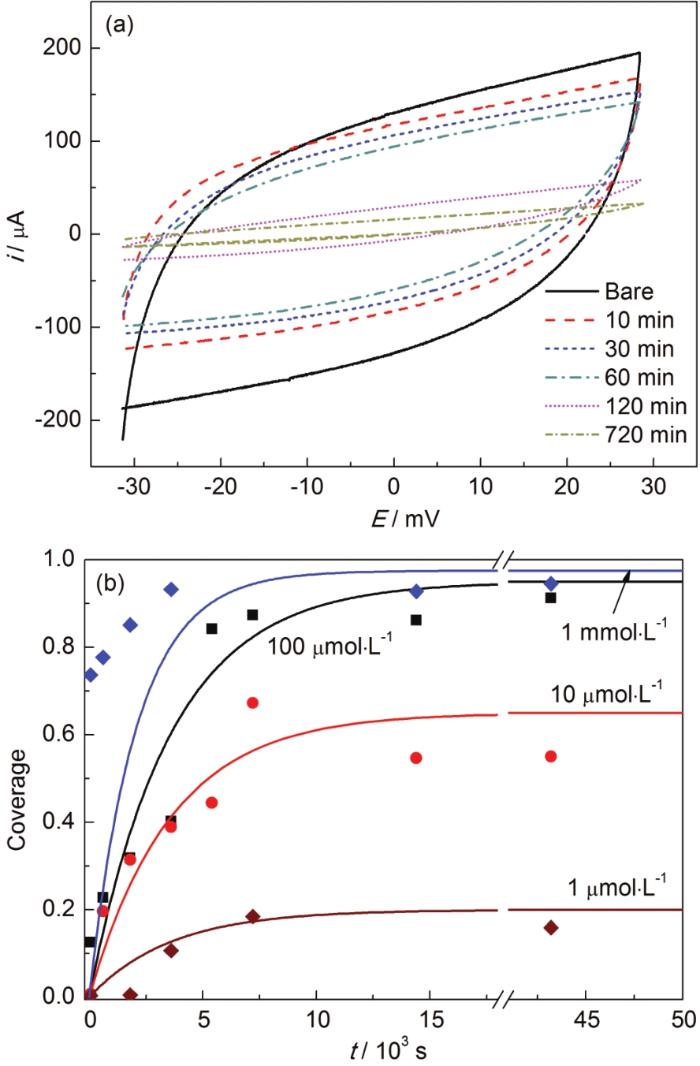
图1 银镀件在100 μmol·L-1的C16H33SH溶液中浸泡不同时间后在0.15 mol·L-1的KNO3溶液中的循环伏安曲线及不同浓度硫醇浸泡下覆盖度随时间的变化关系
假设被硫醇自组装膜覆盖部分电极的电容与未被覆盖部分彼此无影响,则依据电容并联公式,在t时刻的总电容值Cd(t) 为:
![]()
其中,α为银镀件样品在硫醇溶液中浸泡t时刻后的表面覆盖度,Cd(0) 和Cd(∞) 分别是未浸泡和浸泡足够长时间后样品的电容值。一般而言,银镀件在硫醇中浸泡12 h以上,覆盖度即达到饱和,因此可以选择浸泡24 h样品的电容值 (278.5 μF) 代替Cd(∞),因此覆盖度α为:

选择0 V电势的充放电电流绝对值之和的一半作为充电电流 (iaverage),则电容值可以由以下公式求得:
![]()
其中,v为电势扫描速率。
由式(1),(2),(3) 计算得到的在不同浓度硫醇中浸泡不同时间的覆盖度汇总于图1b。可以看出,在同一硫醇浓度下,随着浸泡时间的延长,覆盖度在初期经历了一个快速的增长,而后是一个缓慢的变化过程。这一点在10和100 μmol·L-1的硫醇溶液中表现更为突出。对于1 μmol·L-1的浓度,由于硫醇过于稀释,覆盖度变化缓慢,十余小时后覆盖度尚不足20%。而更高浓度则在电极界面提供了足够的硫醇分子,故可以快速地吸附到电极表面。其覆盖度即使在数秒的时间内也可达到饱和吸附的80%以上。如果将硫醇分子在Ag表面的吸附过程近似地看成一级反应,即裸银面积分数 (1-α) 的变化量正比于裸银的面积分数和硫醇浓度C:
![]()
其中,Kad为吸附速率常数,则表面覆盖度α与浸泡组装时间t的积分关系为:
![]()
进一步改写成:
![]()
利用式 (6) 对不同组装时间覆盖度的实验数据作拟合,进而可求出吸附速率常数Kad。
由于1和1000 μmol·L-1的硫醇溶液对组装过程的影响过于极端,难以获得理想的拟合数据,所以仅对10和100 μmol·L-1的数据进行拟合,得到吸附速率常数分别为 (1.3±0.2)×106和 (2.8±0.5)×104 mol-1·L·s-1。可见,低浓度溶液的吸附速率常数更大,推测硫醇分子的相互吸引作用在高浓度溶液中更为强烈,其形成胶束等微结构极大地降低了有效浓度,同时降低了扩散能力。进一步,利用吸附速率常数和式 (6) 对Ag在不同浓度溶液中的吸附行为进行模拟,如图1b中的实线所示。总体而言,组装液浓度对覆盖速度影响显著。低于100 μmol·L-1的硫醇溶液在合理的组装时间内,难以获得80%以上的覆盖度,因此不能作为镀银保护剂的使用条件。而1 mmol·L-1的浓度则可以在0.5 h内达到这一要求。因此,镀银保护剂浓度的合理选择应高于此浓度,尽管测量误差、工作条件变化等因素会对上述模拟结果带来影响,但其一般性结论还是可以为镀银保护剂的开发与优化提供合理的参考。
润湿性是用来表征表面自由能的一个重要物理量,清洁新鲜的镀银表面是完全亲水的,而烷基硫醇自组装膜是疏水的。其润湿性的巨大反差,可以用于表征硫醇分子在银镀件表面覆盖度的变化。图2a给出了对应不同浓度硫醇的接触角随时间的变化关系。
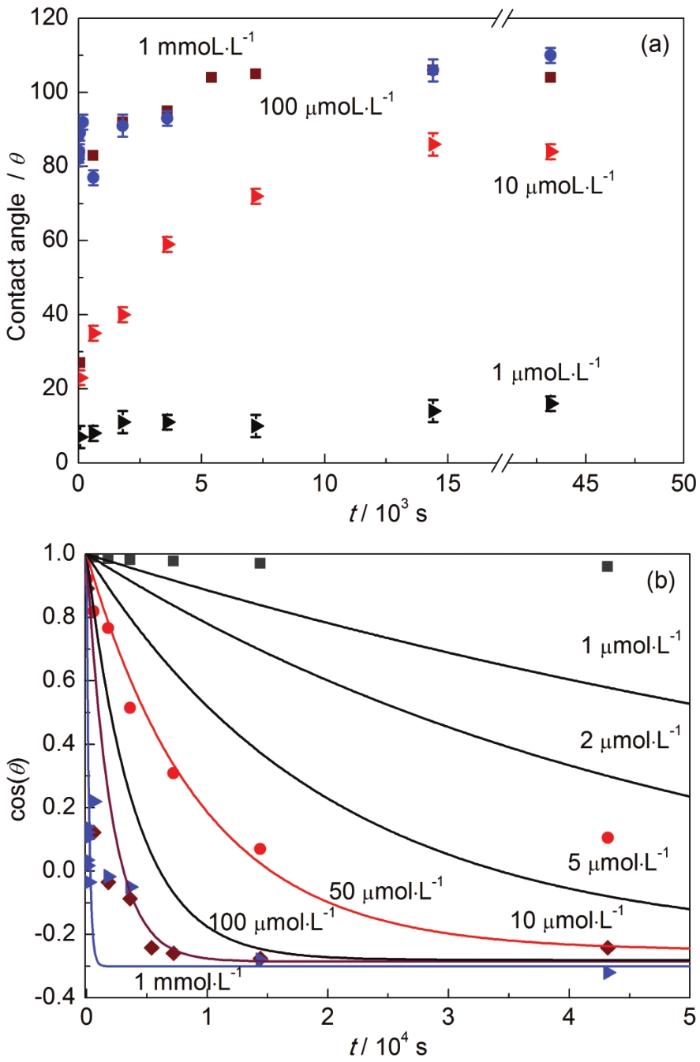
图2 不同硫醇浓度条件下银镀层的接触角测试值和理论模拟值随自组装时间的变化
对于1 μmol·L-1的硫醇浓度,即使是十余小时的浸泡,样品表面的接触角仍约在15º,亲水性强,说明覆盖度极低,这与电容法得到的结果相一致。而1 mmol·L-1的高浓度下,即使数秒的浸泡接触角也可达90º,表现较强的疏水性质。这一数值也接近该浓度24 h组装的接触角 (110º±2º),说明覆盖较完整。而浸泡于10和100 μmol·L-1的硫醇溶液,接触角表现出清晰的随时间的变化关系。在吸附过程中,亲水的裸银与疏水的硫醇共存于表面。假设两者在该混合表面中彼此互不影响,则有如下Cassie[14]关系:
![]()
其中,θt为浸泡t时间的接触角;θ1为硫醇饱和吸附后的接触角,本研究以1 mmol·L-1组装24 h样品的接触角 (110?±2?) 替代;θ2为裸银表面接触角,因其完全亲水,故θ2=0?。则覆盖度α为:
![]()
结合式 (5),可由实验数据的拟合得到吸附速率常数为 (9.3±0.7) ×105和 (3.4±0.6) ×104 mol-1·L·s-1,分别对应10和100 μmol·L-1的硫醇浓度。低浓度的硫醇溶液有着更大的吸附速率常数,这与利用电容法测量的结果一致,利用式 (7) 并结合式 (5) 可以进一步得到:
![]()
利用式 (9) 对实验数据进行理论模拟,结果如图2b实线所示。从模拟结果可以看出,低于100 μmol·L-1的硫醇溶液中,在合理的组装时间内 (<1 h),难以获得理想的疏水表面。这一点与利用电容所做的模拟结果一致。因此1 mmol·L-1以上的浓度是确定以硫醇为主成分的镀银保护剂的基本条件。
同时,利用电化学阻抗法[15]对硫醇分子在Ag表面的组装过程做了考察,图3给出代表性的100 μmol·L-1溶液中组装过程的电化学阻抗谱。少于1 h的组装时间,Ag表面吸附的C16H33SH分子少,覆盖不完全,从图谱中仅能观察到扩散的过程 (图3a)。随着组装的进行,特别是2 h之后,从图中可以明显观察到高频区域形成的半圆形结构,并且随着组装时间的延长,半圆的圆心向高阻方向移动,并且半径增大,说明Ag表面覆盖度增加,且覆盖的自组装膜提供了较大的阻抗。这些特征与前文利用电容和接触角对组装过程的表征一致。
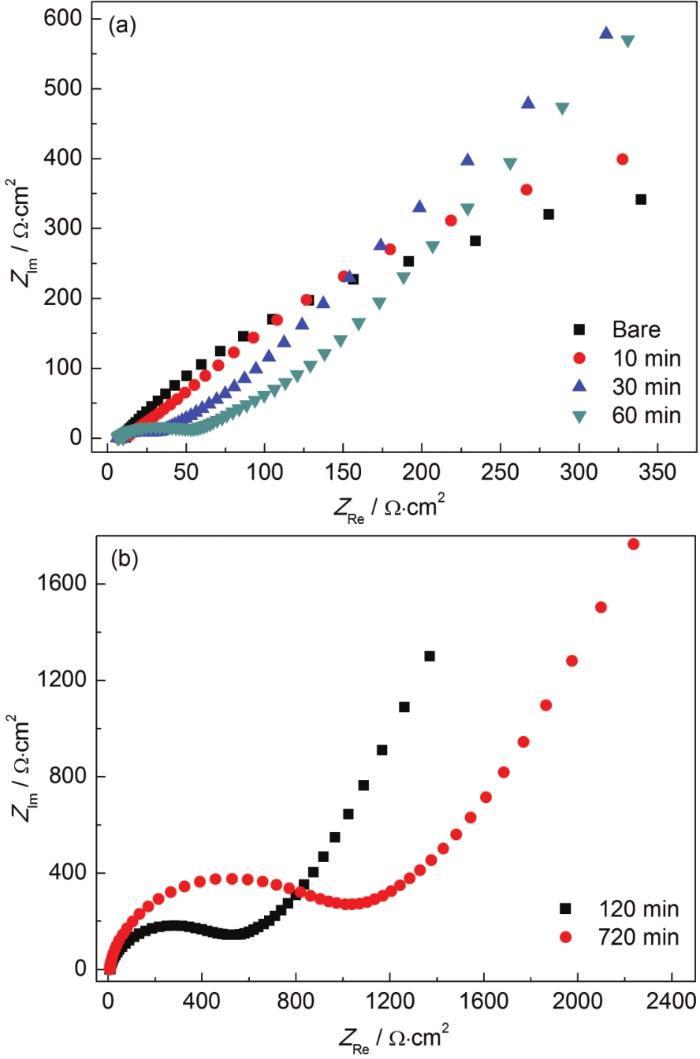
图3 银镀件在含100 μmol·L-1 C16H33SH的溶液中浸泡不同时间后在0.15 mol·L-1的KNO3溶液中的电化学阻抗谱图
2.2 抗腐蚀性能研究
从上述硫醇分子的组装动力学研究可以看出,为了配合生产流水线上的镀银保护,即浸泡时间控制在10~20 min,硫醇的浓度应该在1 mmol·L-1以上。因此接下来考察了1,3和5 mmol·L-1的C16H33SH溶液的抗腐蚀作用。Tafel极化测试是一种使用较多的用于研究材料抗腐蚀性能的电化学测试技术,通过Tafel外推法,可以求得材料的腐蚀电位、腐蚀电流和缓蚀率等参数[16,17,18],进而反映出材料发生腐蚀的难易程度。本文对上述3个浓度的C16H33SH溶液在室温下浸泡15 min的银镀件进行了Tafel极化测试,其结果如图4所示。
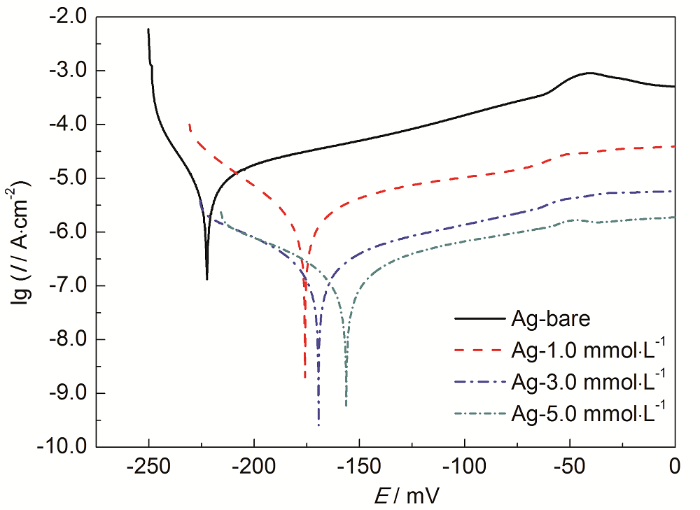
图4 银镀件在3个高浓度的C16H33SH溶液中浸泡15 min后在3.5%NaCl溶液中的Tafel极化曲线
可以看出,裸银镀件腐蚀电位较低,电流密度较大。阴极区电流增长迅速,阳极区虽然钝化明显,但有着明显的峰位,说明镀件遭受腐蚀。经过C16H33SH浸泡后,银镀件表面形成自组装膜,可以有效隔绝O2、H2O和Cl-等与Ag表面的接触,所以阴极区和阳极区的电流密度均有大幅度下降。阴极区电流增长变缓,特别是当浓度在3 mmol·L-1以上时,两侧电流在低极化区间显得更为对称。显然,低极化时阴极区域受抑制程度明显大于阳极。除腐蚀电流外,相应的腐蚀电位也随着硫醇浓度增加而显著正移。
具体得到的与腐蚀有关的参数列于表1。其中,缓蚀率η可以由下式[19]计算:
![]()
式中,Icorr和I'corr分别为未浸泡和浸泡C16H33SH溶液的银镀件的腐蚀电流密度。
表1 由Tafel曲线得到的腐蚀参数
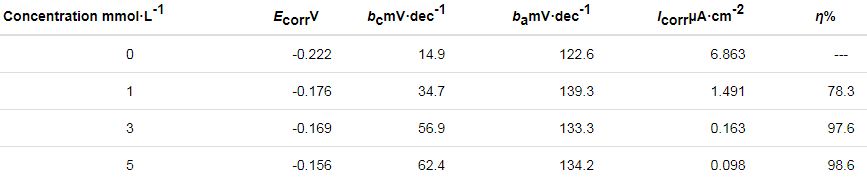
可以看出,随着C16H33SH溶液浓度的增大,缓蚀效果越来越明显。当浓度在3 mmol·L-1时,缓蚀率可达97.6%。但更高的浓度对缓蚀效果的提升影响不大。同样的,腐蚀电位也有着类似的变化,电位正移说明银镀件更难发生腐蚀。因此当以长链烷基硫醇为保护剂主成分时,3~5 mmol·L-1的浓度较为适宜。
高温烘烤实验、Na2S溶液腐蚀和H2S气体腐蚀是考察保护性能的重要实验。高温烘烤样品外观如图5所示。未经保护的银镀层表面明显泛黄,而硫醇保护剂的作用显著。虽然经过1 mmol·L-1的保护剂处理银镀层也会出现边缘和部分表面泛黄,但当浓度增加到3 mmol·L-1以上时,镀层表面色泽基本不变。

图5 含不同浓度C16H33SH溶液未处理与处理的银镀件高温烘烤后的宏观形貌图
利用光学显微镜观察0.1 mol·L-1 Na2S溶液对银镀层的腐蚀,如图6所示。未经保护时,银镀件在放入Na2S溶液的瞬间即完全变黑,后逐渐变为暗灰色,这是S与Ag迅速反应的表现[20]。图6a为未做保护处理的样品在Na2S溶液中浸泡0.5 h后的微观形貌图,展示了镀层受到严重腐蚀的状况。而经过C16H33SH保护处理的样品则大大增强了抗Na2S溶液腐蚀的性能。图6b~d对应的保护剂浓度分别为1,3和5 mmol·L-1,即使浸泡仅15 min,从宏观和微观上表面均未发生显著变化。该结果说明保护剂对短时间的Na2S溶液腐蚀有良好的抵抗效果。但进一步延长在Na2S的腐蚀时间,则低浓度保护剂的作用略显不足。如图6e所示,Na2S腐蚀1 h后,经3 mmol·L-1保护剂处理的银镀件,局部出现了点状腐蚀;而经5 mmol·L-1保护剂处理的银镀件在全部表面未观察到腐蚀点 (图6f)。综上所述,当C16H33SH溶液浓度为3~5 mmol·L-1,室温浸泡15 min可以达到较好的保护效果。在实验中也测试了更高的组装液温度和浓度。但在这些条件下硫醇挥发严重,对环境和操作者影响较大。而当C16H33SH溶液浓度在10 mmol·L-1以上时,浸泡后的镀银样品置于空气中反而会发生氧化而变黑,影响其色泽。

图6 在不同浓度C16H33SH溶液中处理的银镀件在0.1 mol·L-1 Na2S溶液中浸泡不同时间后的显微照片
H2S气体腐蚀结果如图7所示 (从左至右保护剂浓度依次增加)。未经保护的银镀层表面发生了严重腐蚀,经1 mmol·L-1的保护剂处理后银镀层边缘也会出现腐蚀点迹;但当浓度增加到3 mmol·L-1以上时,镀层表面色泽基本不变。这与之前实验结果基本相一致。

图7 在不同浓度C16H33SH溶液中处理的银镀件经H2S气体腐蚀后的形貌图
3 结论
(1) 利用充放电电容法和接触角方法测试的硫醇在10和100 μmol·L-1硫醇溶液中镀银件表面上吸附速率常数结果一致,且得到电化学阻抗法测试结果的验证。确定了3~5 mmol·L-1的硫醇溶液浓度是其作为镀银保护剂的基本条件。
(2) 当硫醇溶液浓度为5 mmol·L-1时,镀银件自腐蚀电位提高了66 mV,缓蚀率可达98%以上。
(3) 高温烘烤实验、Na2S溶液腐蚀实验以及H2S气体腐蚀实验均表明,在室温条件下对镀银件进行3~5 mmol·L-1 C16H33SH溶液中浸泡15 min处理,既符合工艺要求,又可以获得显著的抗腐蚀效果。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





